- Effects of Mixed Planting of Green Manure Crops Supplemented with Humic Substance on the Biological Soil Health Indicators of Reclaimed Soils
Bumhan Bae*·Hyesun Park·Sua Kang
Department of Civil & Environmental Engineering, Gachon University
- 녹비식물 혼합재배에 휴믹물질 투입이 정화처리토양의 생물학적 토양 건강성 지표에 미치는 영향
배범한*·박혜선·강수아
가천대학교 토목환경공학과
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The effects of green manure crops, hairy vetch and sesban, supplemented with HS (humic substance) on biological soil health indicators was studied in a pot containing two kinds of reclaimed soil previously contaminated with petroleum hydrocarbons; a soil remediated by land-farming (DDC) and another soil by low-temperature thermal desorption (YJ). Treatments include no plant (C), plants only (H), and plants+2% HS (PH), which were evaluated in a pot containing respective soil. Biological indicators include microbial community analysis as well as soil enzyme activities of dehydrogenase, β-glucosidase, N-acetyl-β-D-glucosaminidase (NAG), acid/alkaline phosphatase, arylsulfatase, and urease. Results showed an increase of enzyme activities in pot soils with plants and even greater in soils with plants+HS. The enzyme activities of DDC soil with plants (DDC_P) and with plants+HS (DDC_PH) increased 1.6 and 3.9 times on average, respectively than those in the control. The enzyme activities YJ soil with plants (YJ_P) and with plant+HS (YJ_PH) increased 1.8 and 3.8 times on average, respectively than those in the control. According to microbial community analysis, the relative abundance of nitrogen-fixing bacteria in DDC and YJ soil was increased from 1.5% to 7% and from 0 to 5%, respectively, after planting hairy vetch and sesban. This study showed that mixed planting of green manure crops with a supplement of humic substance is highly effective for the restoration of biological health indicators of reclaimed soils.
Keywords: Green manure crop, Humic substance, Reclaimed soil, Soil enzyme, Soil health
토양은 인간생활의 기반으로 사회-경제적, 기술-공업적 및 생태적 기능이 일어나는 환경매질이다. 토양 연구자 사이에서 토양이 갖는 다양한 기능의 정의와 분류에 대한 연구와 토론이 지속되었고, Millennium Ecosystem Assess- ment(MEA) 보고서 이후에는 토양 생태서비스 개념으로 정리되고 있다(MEA, 2005). 토양 생태서비스는 지구생태계에 대한 (i) 영양물질 순환, 토양형성 및 1차생산자에 의한 지구생명 지지기능, (ii) 식량, 물, 목재와 섬유 및 연료의 공급기능, (iii) 기후, 홍수, 질병 및 수질 정화 등과 같은 조절기능, (iv) 미적, 영적, 교육적 토대 및 여가 공간 제공 등의 문화적 기능으로 구분한다(Baveye et al., 2016). 이는 본질적으로 토양건강성과 생물다양성에 비례하는데, Kibblewhite et al.(2008)은 토양건강성을 식물 및 상위 영양단계 생물의 생산성과 건강성을 유지하고 생태계의 공기와 수질을 유지/증진하는 것으로 정의하고, 토양시스템의 물리화학적 특성이 근간을 이루지만 환경변화에 대응하는 것은 토양생물상이라고 하였다.
토양생물상은 박테리아, 바이러스 및 균근균(mycorrhizal fungi) 등의 주요 미생물과, 원생동물, 무척추동물 및 식물을 포함한다. 토양의 생물학적 안정성은 토양구조에 의해 발생하는 물리화학적 변화에 영향을 받지만(Griffiths et al., 2008), 토양식물상도 탄소공급 이외에도 다양한 경로로 미생물상에 영향을 준다. 토양 식물상은 식물 근권의 타감작용 물질을 포함하는 유기물질 삼출, 식물성장증진 근권미생물상 발달, 영양물질(N, P, S)의 순환 및 이용도 변화에 영향을 주며, 식물 사체는 입자상 유기물을 공급원이 되어 토양특성을 변화시킬 수 있다. 그러므로 토양생태계에서 식물상과 미생물상의 다차원적인 상호관계가 토양건강성 증진에 핵심이 될 수 있다(Baer and Birge, 2018).
토양 내 자연적으로 존재하는 휴믹물질(Humic Substance, HS)은 토양유기물의 60%를 차지하며, 토양 생태계에서 발생하는 수많은 복합적 화학반응에 관여한다(Trevisan et al,, 2010). HS는 토양의 물리화학적 특성 변화, 미생물 종다양성 증가, 토양효소활성 증가, 영양물질 흡수 증가, 지상부 및 근권 발달 및 생장, 토양 미생물 개선 등의 효과가 있다고 보고되었다. 수경재배에 500 mg-HS/L를 첨가하여 거베라(Gerbera jamesonii L.)를 재배하면 수확가능한 꽃이 52% 증가하고, 수확한 생화 생존기간도 2~3.7일 증가하였다(Nikbakht et al., 2008). 염분 스트레스(20~40 mM)를 받는 사질 토양에서 옥수수를 재배할 때 토양 1 kg당 0.2%의 HS를 투입하자, 토양에서 지상부 생체량은 변화가 없었으나 영양물질 흡수가 최소 2배 이상 증가하였다(Khaled and Fawy, 2011). 감자 괴경(tuber)을 PGPR(Plant growth promoting rhizobacteria)로 처리하고 재배과정에서 HS(400 kg/ha)를 투입한 경우, 비료(NPK 100%) 처리구에 비해 감자 수확량이 1.3배 증가하였다(Ekin, 2019). 휴믹물질을 장기간 사용하여도 증진 효과가 지속되었다. 땅콩 재배에 HS(1000 kg/ha, 75% HS)를 비료로 사용하여 대조군과 비교한 결과, 수확량이 44~78%로 증가하였는데 연차가 증가할수록 수확량도 증가하였다. 이와 동시에 토양효소(urease, sucrase, and phosphatase)도 모두 20% 이상 유의적으로 증가하였고, 미생물 군집분석 결과 박테리아 종은 감소하고 곰팡이 종은 증가하였는데, 유해한 Ascomycota 종은 감소하였다(Li et al., 2019). Trevisan et al.(2010)는 HS를 성장호르몬 auxin과 같은 작용으로 뿌리 세포 분할 및 분화를 자극하는 기작에 관여하고, 세포 발달을 촉진하는 생물학적자극제(biostimulant)로 정의하였다. 다른 연구에 의하면 저분자 용해성 HS는 뿌리세포의 전사 및 전사 후 단계에 영향을 주어 뿌리 세포막에서의 이온수송체 기능을 높임으로써 영양물질 흡수를 증진하며, 킬레이트 결합으로 근권에서의 철 흡수를 증진하였다(Zanin et al., 2019). 이상과 같이 HS는 토양에서 다양한 기작으로 식물생장을 증진하고 토양의 미생물상을 건강하게 한다.
최근 오염토양의 반출정화처리가 증가하고 있으나, 토양정화공정에 따라 원토양의 특성이 변화하면서 토양으로서의 가치와 건강성이 저하되어 재활용되지 못하고 복토재 등으로만 사용되고 있다(한수호 등, 2020). 녹비식물은 토양의 물리적 특성을 변화할 수 있는 효과적인 방법으로 토양 입단성, 용적밀도와 표토층의 침투저항, 보수성 및 공극율 등을 개선한다(Villamil et al., 2006). 또한 녹비식물은 K, Ca, Mg 감소로 염류농도 감소, 유기물량 증가, pH 상승, TN 및 K2O 고정량 증가, 미생물량 및 군집의 긍정적 변화를 유도하며, 1종 식물 단파보다는 2종을 혼파 재배할 경우, 풋거름 생산이 증진되고 토양환원량이 증가하여 정화공법에 의해 저하된 토양 건강성을 증진시킬 수 있다(양창휴 등, 2014). 이에 본 연구에서는 실험실 규모 화분에서 녹비식물을 혼합재배하면서, 혼합 녹비식물 혹은 녹비식물과 HS 투입에 의해 생물학적 토양 건강성지표가 변화하는 것을 정량적으로 평가하고 미생물상의 변화를 관측하여, 식물 및 HS에 의한 처리토의 토양건강성 증진방안을 탐색하였다.
2.1. 화분실험
실험에 사용한 처리토(reclaimed soil)는 TPH 오염토를 토양경작법으로 정화처리한 토양(DDC)과 저온열탈착법으로 처리한 토양(YJ)이었다. 상부 직경 20 cm 화분에 각각의 토양 1.8 kg을 넣고 식물을 식재하지 않은 대조구(Control), 식물만 식재한 식물식재구(P) 및 중량비로 2% 입상 HS(36 g)을 첨가한 식물식재-HS 처리구(PH)를 모두 3배수로 준비하였다. 녹비식물은 헤어리베치(Vicia villosa)와 세스바니아(Sesbania sesban)를 파종하였다. 헤어리베치는 콩과식물로 질소공급과 미생물상 개선을 위해, 세스바니아는 내염성 식물로 생체량이 커서 토양 물리성을 개선할 수 있기 때문이다(Singh et al., 2006). 그러나 두 식물의 발아율이 좋지 않아 종자 10여개를 파종하고, 발아한 유식물이 성장하면 각각 4개체씩 남기고 제거하는 방법을 사용하였다. 준비된 화분은 온도 25oC, 습도 60%, 낮/밤을 18/6시간으로 설정한 식물생장상에서 재배하였다. 식물생장상의 조도는 약 9,500 Lux이었으며, Apogee Quantum Flux Meter(MQ-200)로 측정한 PAR(photosy- nthetically active radiation)은 145 μmol/cm2-s이었다.
초기 3주간 4일 간격으로 대조군에 50 mL, P 및 PH처리구는 100 mL씩 관수하였고, 재배 22일 부터 모든 화분에 물이 침출되지 않지만 토양이 마르지 않도록 2~3일 간격으로 액체비료(N:P:K 6%-8%-5%)를 물 100 mL과 함께 관수하였다. 실험이 완료될 때까지 액체비료는 3/1000으로 희석하여 13회, 식물이 크게 성장한 다음에는 6/1000으로 희석하여 9회 주입하였다. 이를 화분당 주입한 비료총량을 환산하면, N 576, P 744, K 465 mg이었다. 식물생장은 1주일 간격으로 지상부 길이로 관측하였다. 실험은 80일간 지속하였고, 최종일에는 지상부를 수확하여 건량을 측정한 다음, 토양시료를 채취하여 토양효소와 미생물군집을 분석하였다. 식물뿌리는 헤어리베치 뿌리가 가늘고 토양과 함께 부서져 채취하지 못하였다.
2.2. 분석방법
토양의 물리화학적 특성은 국립산림과학원(2014) 방법에 의거하여 측정하였다. 토양 pH 및 EC는 토양:증류수(1:5) 방법으로, 토성은 피펫법으로 유기물함량은 강열감량시험법으로 측정하였고 모두 2배수 실험하여 평균값을 사용하였다. 토양 미생물군집 분석은 Chun Lab.에 위탁하여 NGS(next generation sequencing)법으로 분석하였고, 식물체는 60oC에서 3일간 건조한 다음 건조중량을 측정하였다.
토양효소는 모두 7종을 측정하였다. DHA(dehydrogenase activity)는 Pepper and Gerba(2004)방법으로 측정하였는데, 습윤토양으로 실험하고 함수량을 보정하였다. 탄소순환에 관여하는 β-glucosidase(BG) 탄소 및 질소순환에 연관된 N-acetyl-β-D-glucosaminidase(NAG), 인 순환 관련 acid 및 alkaline phosphatase(Pase_a 및 Pase_alk)과 황 순환에 영향을 주는 Arylsulfatase(AS)는 Scott(2019)이 추천하는 방법을 사용하였다. 상기 방법은 모두 효소반응산물인 PNP(para-nitrophenol) 측정으로 활성도를 평가한다. 토양 Urease는 Kandeler and Gerber(1988)의 방법으로 측정하였다.
2.3. 종자 및 화학약품
실험에 사용한 헤어리베치 및 세스바니아 종자는 태림글로벌(대한민국)에서 구매하였고, 사용 전까지 4oC에서 냉장보관하였다. 육안선별한 종자는 HOCl 소독 후 세척하고, 다시 80% 에탄올로 소독하여 실험에 사용하였다. 액체비료는 상품명 바이오가든(E&G, 대한민국)으로, 1/1000배 희석하여 사용하였다. 입상 HS는 상용제품(HumicDG, The Anderson, USA)을 구매하였는데, 직경 4~5 mm 정도 구형으로 성형되어 있었고, humic acid 함량은 70%이었다.
토양효소 활성측정에 사용한 기질 및 화학물질은 triphenyltetrazolium chloride(³98.0%, Sigma), p-nitrophenyl- β-D-glucopyranoside(³98%, Sigma), p-nitrophenyl-N-acetyl- β-D-glucosaminide(³99%, Sigma), p-nitrophenyl phosphate disodium salt hexahydrate(Calbiochem), potassium 4-nitrophenyl sulfate(Sigma), p-nitrophenol(³99%, Junsei)이었다. 기타 실험에 사용된 화학물질은 모두 최소한 ACS grade이었으며, 용액제조 및 식물 급수에는 탈이온수(18.3 MW-cm)를 사용하였다.
3.1. 토양의 물리화학적 특성 및 토양효소활성
두 종의 토양에 대하여 측정한 물리화학적 특성 및 토양효소활성은 Table 1과 같다. 실험에 사용한 DDC토양 토성은 양토(loam)이었고, YJ토양은 식양토(clay loam)이었다. 토양 pH와 EC는 DDC 토양이 각각 7.0 및 36.9 μS/cm이었으며, YJ토양은 각각 8.2 및 555 μS/cm로 열처리 토양 특성인 pH 및 전기전도도 증가가 관측되었다(Pape et al., 2015; Vidonish et al., 2016). 두 종의 토양은 WHC(water holding capacity, 1/3 bar)가 24.8 및 26.0%로 큰 차이를 보이지 않았으나, YJ토양은 뭉치지 못해 입단성이 떨어졌고, 수분이 많으면 졸(sol) 상태가 되어 흐르고 건조해지면 딱딱하게 굳었다. 토양의 용적밀도는 DDC토양이 1.193±0.005 g/cm3이며, YJ토양이 1.314± 0.019 g/cm3으로, YJ토양이 약 10% 더 높았다(Table 1).
동일 지역에서 채취한 비오염토양과 처리토의 토양효소활성은 Tabel 2와 같다. DDC토양은 처리 후 urease를 제외한 나머지 항목에서 토양효소활성이 증가하였다. 토양경작에 의한 생물활성증가가 원인으로 판단되며, urease 감소는 토양경작 과정에서 발생하는 N 부족현상에 기인한 것으로 판단된다. 반면, YJ토양에서는 열처리 과정에서 미생물이 사멸하여 모든 항목에서 효소활성이 크게 감소하였다. DDC토양과 YJ토양을 비교하면, 토양효소활성은 Pase_a만 제외하고, DDC토양에서 YJ토양에 비해 훨씬 높은 효소활성을 보였다.
동일 지역에서 채취한 YJ 비오염토양에서는 AS는 75.62±4.14, urease는 449.4±14.8로 높은 반면, 열처리한 YJ토양의 AS와 urease 활성은 각각 1.1±0.4 mgPNP/g-soil-hr 및 4.1±2.9 mgNH4+/g-soil-hr로 비오염토의 1/70배로 낮았는데, 열처리에 의한 미생물 사멸이 원인이라 판단된다. YJ 토양이 열처리 토양임에도 불구하고, BG, NAG, Pase_a 및 Pase_alk 등에서 활성을 보인 것은 고분자 탄화수소 분해로 토양에 C를 함유한 저분자 탄화수소가 미생물이 이용가능한 형태로 전환되어 축적되었고, 처리 후 대기 및 물과 접촉하여 새로운 미생물상이 형성되었기 때문으로 판단된다. 반면, DDC 비오염토양의 AS와 urease는 각각 1.91±0.3 mgPNP/g-soil-hr 및 35.4±3.1 mgNH4+/g-soil-hr에서, 토양경작 처리 후 각각 22.8±1.21 mgPNP/g-soil-hr 및 26.3±9.0 mgNH4+/g-soil-hr으로 AS 활성만이 크게 증가하고, urease는 큰 변화가 없었다. TPH 오염토양을 토양경작으로 처리한 다른 연구(Besalatpour et al., 2011)에서도 초기 urease 활성은 약 170 mgNH4+/g-soil-hr으로 대조군에 비해 약 20% 높았지만, 4개월 후에는 대조군과 비슷한 150 mgNH4+/g-soil-hr으로 감소하였다.
3.2. 식물성장 및 지상부 건량
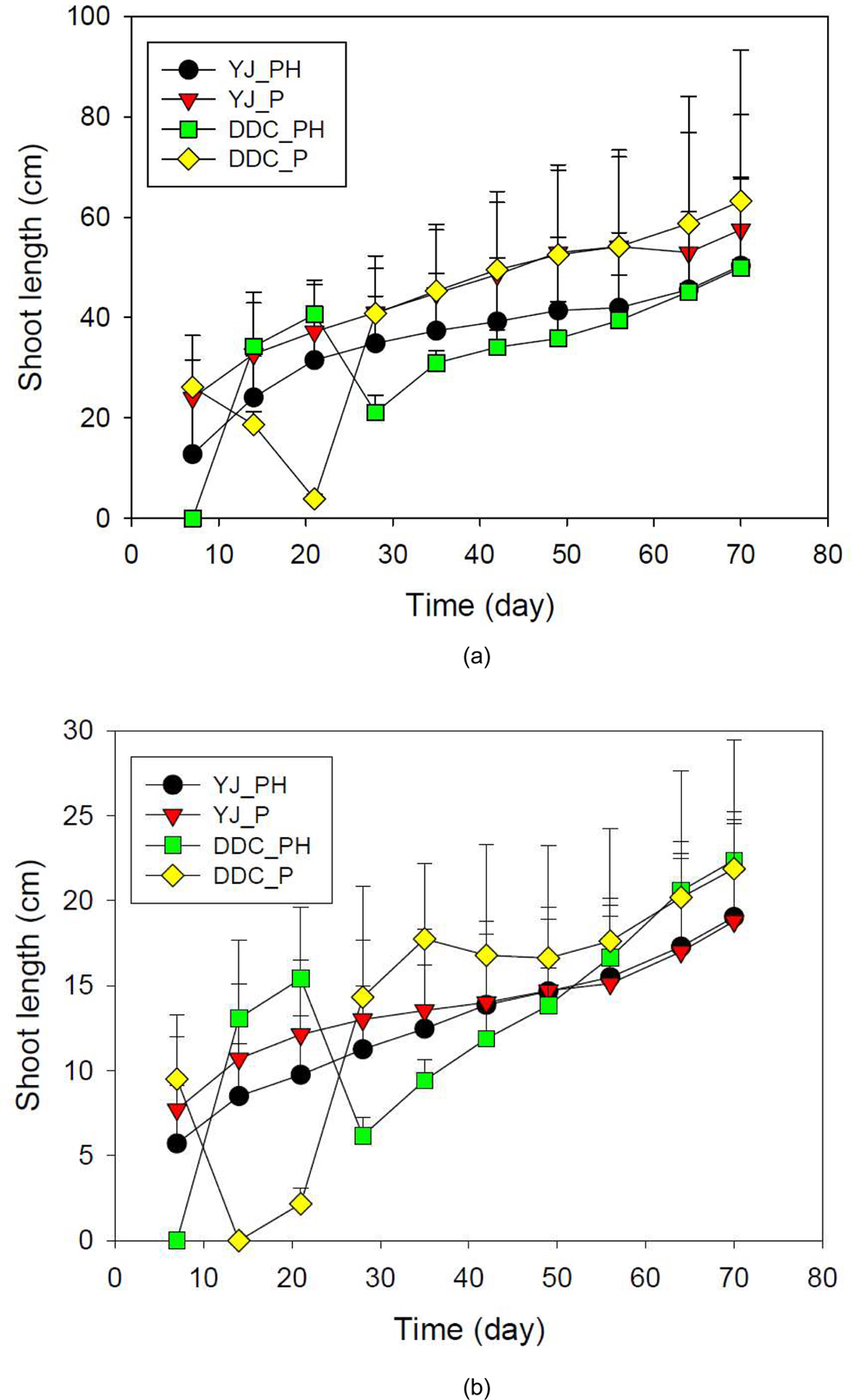
처리토에 파종한 녹비식물 발아율은 50% 미만이었고, 발아한 유식물도 생장이 멈추는 경우가 있어 재파종이 필요했다. 특히 DDC토양에 파종한 식물은 발아 후 유식물이 시들어서, 헤어리베치는 실험 시작 후 21일, 세스바니아는 14일에 각각 재파종하였다. 화분에 재배한 식물의 지상부 평균길이를 비교하면 Fig. 1과 같다. 헤어리베치는 두 종류의 토양 모두에서 HS를 첨가하지 않은 포트에서 길이성장이 더 활발하였다. 세스바니아도 YJ토양에서는 50일경까지, DDC토양에서는 약 58일경까지 HS를 첨가하지 않은 토양에서 식물 지상부 길이가 더 길었으나 70일 경에는 평균길이에서 차이가 없었다. 그러나 헤어리베치는 줄기가 덩굴이어서 측정이 어려웠고 편차가 심해 길이성장이 통계적으로 유의하지 않았다(p>0.05). 세스바니아는 중간에 시들어 재파종한 개체로 인해 편차가 컸고, 헤어리베치와 동일하게 길이성장이 통계적으로 유의하지 않았다(p>0.05).
화분 식물은 외견상으로는 HS처리군에서 식물의 가지와 잎이 더욱 무성하였다(Fig. 2). 이에 재배 80일에 지상부 식물을 수확하여 건량을 측정한 결과는 Table 3과 같다. DDC토양에서의 지상부 생체량은 DDH_PH 및 DDH_P에서 각각 10.24±0.84 및 9.56±0.66 g이었고, YJ토양에서는 YJ_PH 및 YH_P에서 각각 10.64±0.65 및 10.15±0.58 g이었다. 평균값으로는 HS 첨가구 지상부 생체량이 5~7% 많았지만, 두 토양 모두에서 통계적으로는 유의하지 않았다(p>0.05). HS는 Fe-HS 복합물 형성에 의한 Fe 섭취 및 필수영양물질 섭취 증가(Chen et al., 2004; Zanin et al., 2019), 성장호르몬 효과(Trevisan et al., 2010) 및 근권 발달 및 강화 효과(Canellas and Olivares, 2014) 등으로 식물생장을 증진하는 것이 이미 확인되었다. 본 연구에서 생체량 증가가 없었던 가장 큰 이유는 광합성을 결정하는 PAR값이 145 μmol/cm2-s로 매우 낮아, HS를 첨가한 효과가 크지 않았던 것으로 추정된다.
또한 뿌리를 회수하여 건량을 측정하려고 시도하였으나, 토양이 판상으로 경화되었을 뿐 아니라 식물뿌리가 가늘어, 해체하는 과정에서 분쇄되었기에 뿌리건량은 측정하지 못하였다. 반면 투입한 HS가 구형을 그대로 유지하는 것이 관측되었다. 용해된 HS는 수체에서는 오염물질 흡착 및 원거리 이동, 정수처리 공정에서의 소독부산물 발생의 원인물질이다. 화분 토양을 절개하였을 때 80일 후에도 HS가 용해되지 않고 그 형태를 유지하고 있어, 식물재배에 같이 사용하였을 때 발생할 수 있는 수계유출에 대해 크게 우려하지 않아도 될 것이라 판단된다.
3.3. 토양효소활성 비교
토양효소활성은 토양생물상과 영양물질 순환에 밀접하게 관련되어있고, 쉽게 측정가능하며, 미생물상태와 토양의 물리화학적 상태에 대한 정보를 포함하며, 토양상태 변화에 따라 신속한 반응을 보이는 특징을 가지고 있어 식물-토양계의 변화를 확인하는 지표로 사용할 수 있다(Aon et al., 2001). 이에 화분 토양을 균일하게 혼합하고 시료를 채취하여 토양효소활성을 측정한 결과는 Fig. 3~4과 같다.
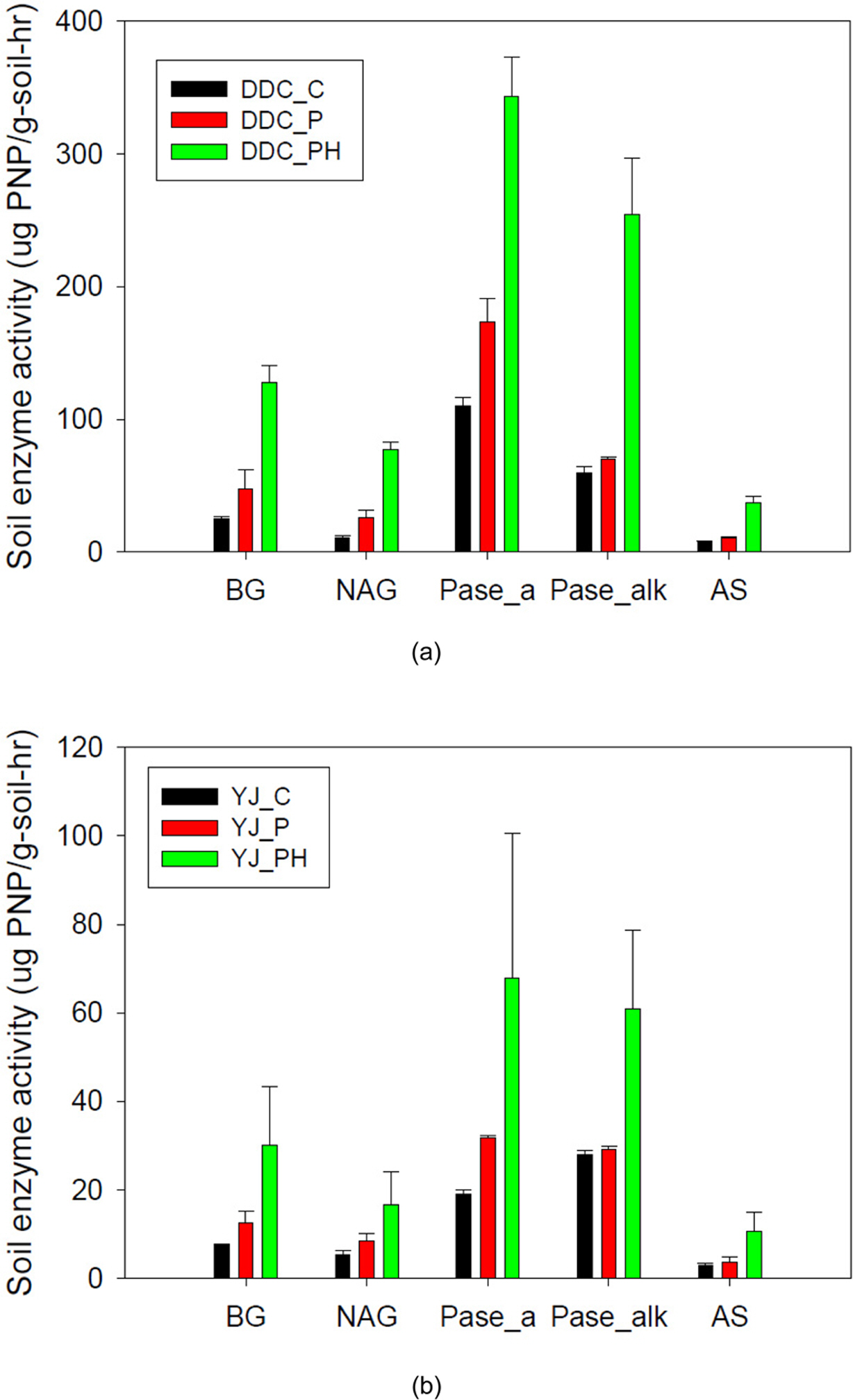
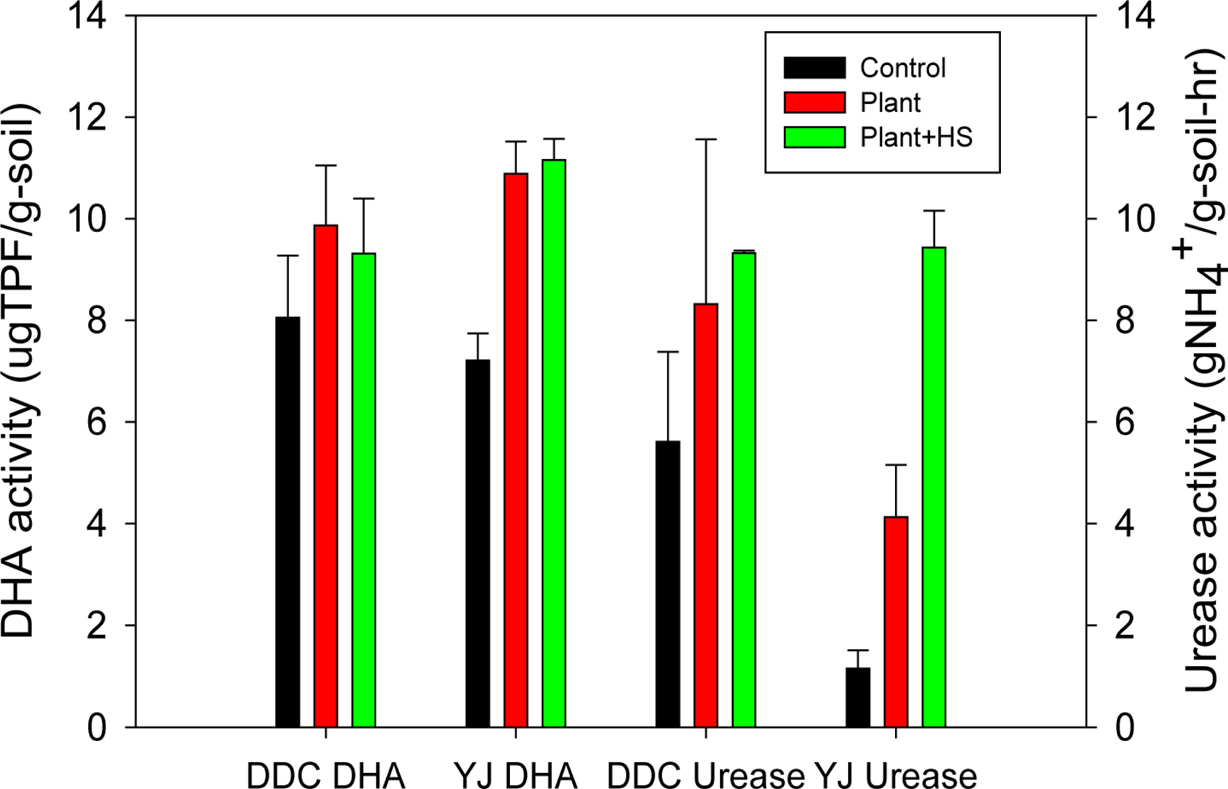
효소활성 중에서 BG, NAG, Pase_a, Pase_alk 및 AS는 식물식재구(P)에서 식물을 식재하지 않고 관수한 대조구에 비해 최소 1배~최대 2.4배 증가한 반면, 식물식재-HS처리구(PH)에서는 약 2배 이상 유의적으로 증가하였다(Fig. 3). DDC토양 PH처리구에서는 대조구에 비해 BG는 5.1배, NAG는 7.1배, AS는 4.7배, Pase_a는 3.1배, Pase_alk은 4.3배 증가하였다. YJ토양에서도 PH처리구에서 대조구 대비 BG는 3.9배, NAG는 3.1배, AS는 3.8배, Pase_a는 3.6배, Pase_alk은 2.2배 증가하였다. HS 처리유무에 따라서도 토양효소활성이 증가하였으며, P처리구에 비해 PH처리구에서 5종 토양효소활성 평균값이 DDC토양에서는 2.9배 증가하였고, YJ토양에서는 2.3배 증가하였다. 토양효소 중에서 DHA와 urease 활성증가는 높지 않았다. DHA는 DDC토양에서 처리구 평균 1.2배 증가하였고, YJ토양에서는 평균 1.5배 증가하였다. Urease활성은 DDC토양에서는 1.5~1.7배밖에 증가하지 않았다. YJ토양에서는 P처리구와 PH처리구에서 각각 3.6배 및 8.2배로 증가하였으나, 이는 YJ토양 대조구 urease활성이 1.2±0.4(mgNH4+/g-soil-hr)로 매우 낮기 때문이며, PH처리구의 9.4±0.7(mgNH4+/g-soil-hr)은 DDC_PH처리구 urease활성과 유사한 값이다(Fig. 3).
수용성 혹은 산을 끓여 추출한 HS는 비트, 당근, 감자, 콩 및 밀에 있는 phosphatase 활성을 저해하였다(Malcolm and Vaughan, 1979). 화산토양(andisol)에 HS를 첨가하면 토양효소인 BG, Pase_a, urease, NAG 및 polyphenol oxidase가 유의적으로 크게 감소하였다(Allison, 2006). 효소활성 저하는 HS-단백질 복합체 형성에 의해 발생한다. 예를 들어 urease는 pH 5.2이상에서 순(net) 전하가 양으로 하전되고, 순전하가 (-)인 HS와 결합하여 HS복합체가 형성되면 활성이 저하되며, HS-단백질의 등전점(isoelectric point)에서 가장 큰 활성저해를 받았다(Li et al., 2013). 그러므로 HS에 의한 효소활성저하는 토양 pH에 따른 효소단백질과 HS의 표면 전하상태가 가장 큰 원인이라 할 수 있다.
반면, Martinez et al.(2018)은 포도생산에 HS를 투입하는 것이 용해성 탄소함량(WSC, water soluble carbon) 증가에 가장 효과적이라고 하였는데, WSC 증가는 토양효소 BG 활성을 높이는 주 요인이다. Sun et al.(2020)은 토양에 HS를 분자량 크기별로 구분하여 투입한 후, 토양효소 및 영양물질 농도변화를 관측하였다. 저분자량 HS 첨가토양에서 Pase_a 및 Pase_alk가 약 1.5배 증가한 반면, 고분자량 HS 첨가토양에서는 urease 활성이 감소하고 HS 첨가량에 비례하여 암모니아(NH4+-N) 농도도 감소하였다. 본 연구에서는 입상HS를 토양과 혼합하였기에 물에 용해되는 저분자량 HS가 먼저 용출되고, 고분자량 HS는 토양 내에서 유동하지 않고 그 형태를 유지한 것으로 판단된다. 그 결과, 저분자량 HS에 의해 phosphatase 활성이 평균 3배정도 증가하였고 urease는 HS 미첨가 토양과 다르지 않았다고 판단된다.
3.4. 미생물 군집변화
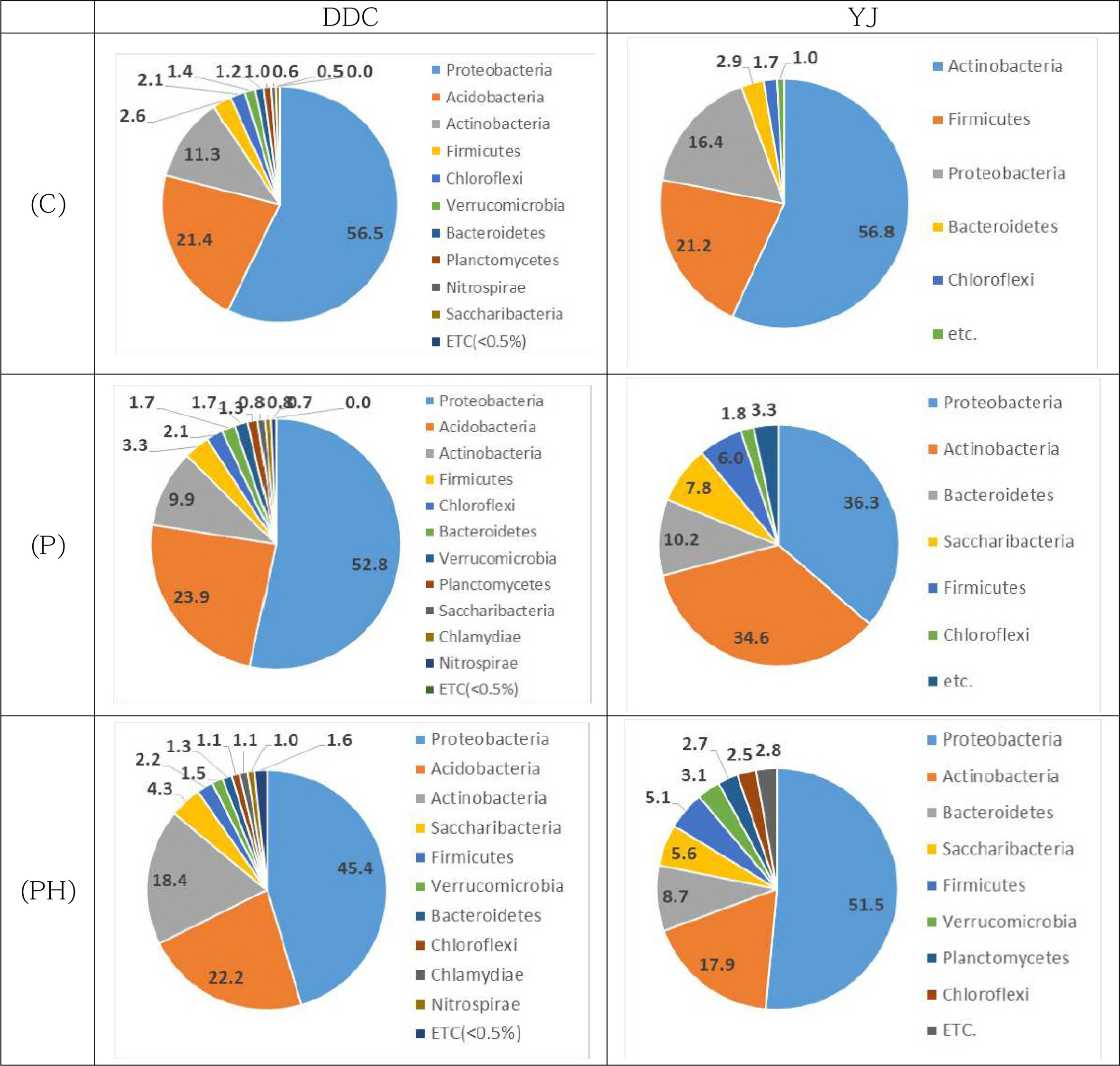
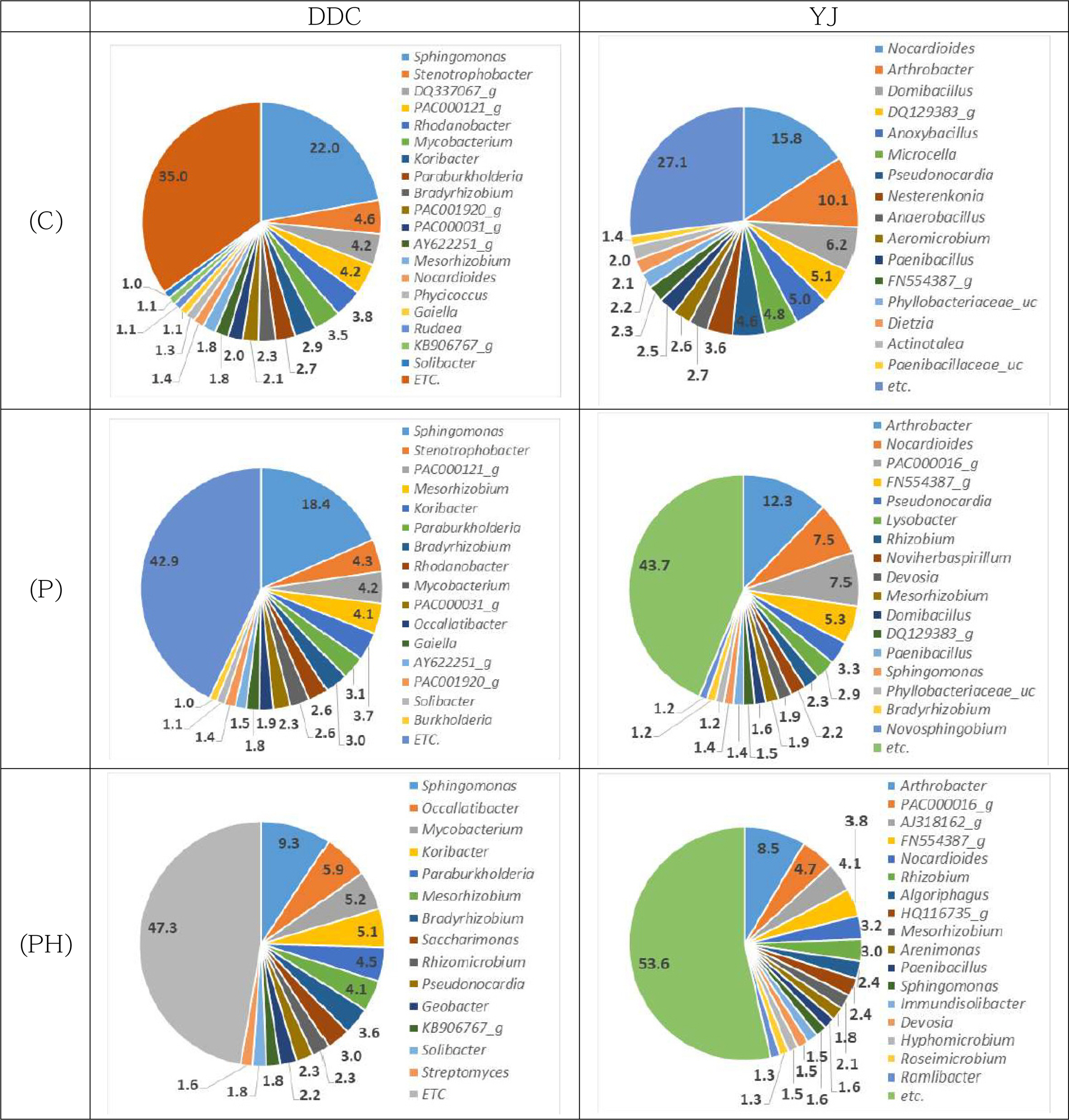
미생물군집 분석결과를 문(phylum) 수준에서 비교하면 Fig. 5와 같다. DDC토양 우점미생물은 모든 처리구에서 Proteobacteria > Acidobacteria > Actinobacteria 순이지만, P 및 PH처리구에서는 상대적 비율이 변화하였다. P 및 PH처리구에서 Proteobacteria가 감소하고, Acidobacteria이 23.9%로 증가하였고, PH처리구는 대조군 대비 Acido- bacteria는 0.8% 소폭 증가하고 Actinobacteria는 7.1% 증가하였다. YJ토양의 미생물군집은 변화폭이 컸는데, 대조구에서 Actinobacteria가 56.8%로 우점하였으나, P 및 PH처리구에서 Proteobacteria가 우점종이 되었고, Firmi- cutes가 5% 내외로 감소하였다. DDC토양과 YJ토양에서 미생물군집의 가장 큰 차이는 Acidobaceria의 우점여부이다. DDC토양에서 최소 21.4%이었으나, YJ토양에서는 처리구에 관계없이 전무하였다. Acidobacteria는 토양미생물 과반이상을 차지하며 가장 광범위하게 분포하는 미생물로 C, N 순환의 keystone 미생물이며, siderophore 생산으로 식물-근권미생물 관계에서 매우 중요한 미생물이다(Kalam et al., 2020). 그러나 이름에서도 알 수 있듯 산성조건을 선호하는 미생물이기에(Kuske et al., 1997), YJ토양의 높은 pH 조건에서는 우점하지 못한 것으로 판단된다. 이외에도 YJ토양 PH처리구에서 특이하게 Planctomycetes가 2.7%로 새롭게 증가하였는데, 이 미생물은 혐기성 암모니아 산화인 anammox 반응으로 탄소 및 질소 순환에 관여한다. 콩과식물 뿌리의 질소고정미생물이 질소를 공급하고, 통기성이 좋지 않은 YJ토양 특성으로 인해 국부적으로 혐기성 상태가 형성되었기에 생장이 가능했던 것이라 사료된다.
TPH오염 정화과정에서 우점미생물 및 미생물군집 천이는 연구에 따라 차이가 있다. 고농도(6~25%) 석유오염 토양의 생물정화 후에는 Actinobacteria와 Saccaribacteria가 순서대로 우점하였고, Bacteroidetes는 감소하였다(Galitskaya et al., 2001). 원유슬러지 오염토 정화에서는 Proteobacteria(50%)와 Firmicutes(16.6%)가 우세하였다(Reddy et al., 2011). 유사한 다른 연구에 의하면 원유로 오염된 고염도 토양릐 정화 초기에는 γ-Proteobacteria, β-Proteobacteria 및 Actinobacteria가 우세하고, 말기에는 Firmicutes가 우점종으로 난분해성 물질을 분해하였다(Gao et al., 2014). 디젤유로 오염된 토양에서는 Proteobacteria가 우점한 반면, 대조군 토양에서는 Actinobacteria가 우점하였다(Mitter et al., 2021). 이상의 결과를 종합하면, 오염 초기에는 Proteobacteria가 우점하고, 미생물에 의해 오염도가 감소되면 다음으로 Actinobacteria와 Firmicutes가 우점하는 것으로 판단된다. 본 연구에서는 토양경작으로 생물학적 정화가 완료된 DDC 토양에서는 Pro- teobacteria가 감소하는 추세를 보였고, YJ토양은 새로운 미생물군집이 자리를 잡는 단계이어서 Proteobacteria가 우점한 것이라 할 수 있다.
미생물 군집을 속(genus) 수준에서 비교하면 Fig. 6과 같다. DDC토양이 토양경작으로 TPH를 처리하였기에, 유류 및 유기물 분해에 관여하는 Sphingomonas 및 Stenotro- phobacter가 우점하고(Zhou et al., 2016), Mesorhizobium은 1.5%에 불과하였다. 처리구(P 및 PH)에서도 두 미생물이 우점하고 있지만, 질소고정 미생물인 Mesorhizobium과 Paraburkholderia의 우점도가 DDC_P 및 DDC_PH 처리구에서 각각 7.2 및 8.6%로 증가하였다. 이 결과는 콩과식물재배가 토양 미생물상에 영향을 주었기 때문이며, HS를 처리한 경우 질소고정미생물의 우점도가 더 높게 증가하였다. 타 연구에서도 HS에 의한 질소고정미생물 증가를 보고하고 있다. 강낭콩 재배에 HS를 처리할 경우, 저분자 처리구에서의 뿌리혹 건량은 식물체당 평균 818.7 mg으로 대조군의 449.4 mg에 비해 1.82배 증가하였고(Haghighi et al., 2011), 땅콩 재배 토양에 3년 연속 HS를 처리하자 토양 내 총질소량이 비처리구에 비해 유의적으로 크게 증가하였다(Li et al., 2019). 그러므로 처리토와 같이 질소가 부족상태인 토양에 콩과식물을 재배하면서 HS를 첨가하면, 질소고정미생물 성장을 촉진하여 토양 내 질소함량을 높이는 효과적인 방법이라고 할 수 있다.
YJ토양에서는 처리군에 따라 미생물군집의 급격한 변화가 관찰되었다. YJ대조군에서는 Nocardioides와 Arthro- bacter가 우세하였으나, YJ_P 및 PH처리구에서는 Arthro- bacter가 우점도가 감소하고 다양성이 확대되었다. 콩과식물 식재의 영향으로 질소고정미생물인 Rhizobium 및 Mesorhizobium 우점도가 상승하였는데, YJ_P 및 PH 처리구에서 질소고정미생물 우점도는 각각 4.2 및 5.1%이었다.
Silva et al.(2021)에 의하면 수경재배 중인 벼에 HS를 투입한 결과, 식물병원균이 사멸하고, Pseudomonas와 Acidobacteria와 같은 siderophore를 생산하는 미생물이 크게 증가하는 등, HA-root 상호작용이 식물 근권미생물 구조를 변화시킨다고 하였다. 본 연구에서도 콩과식물 식재 그리고/혹은 HS 투입에 의해 식물근권이 강화되고, 식물생장에 영향을 주었을 뿐 아니라, 토양미생물과의 상호 작용에 의해 미생물군집, 특히 질소고정미생물 생장을 증진하는 선순환이 확인되었다. Table 2
|
Fig. 1 Elongation of shoot length of mixed planted hairy vetch and sesban in a pot containing reclaimed soil and/or humic substance amendment. (a) Hairy vetch, (b) Sesban. |

|
Fig. 2 Photographs of hairy vetch and sesban mixed-planted in the reclaimed soil with or without HA amendment. (a) YJ_P, (b) YJ_PH, (c) DDC_P, (d) DDC_PH. Photographs were taken at Day 79 of cultivation. |
|
Fig. 3 Soil enzymes, BG, NAG, Pase_a, Pase_alk, and As, activities in pot soils at Day 80. (a) DDC soil, (b) YJ soil. |
|
Fig. 4 Soil enzymes, DHA, and urease activities in pot soils at Day 80. |
|
Fig. 5 Phylum level classification of soil microbial communities after 80 days of cultivation under different combinations of plant and HS supplement. (C) control, (P) Plant only, (PH) Plant with HS supplement. |
|
Fig. 6 Genus level classification of soil microbial communities after 80 days of cultivation under different combinations of plant and HS supplement. (C) control, (P) Plant only, (PH) Plant with HS supplement. |
|
Table 1 Physicochemical properties of reclaimed soil |
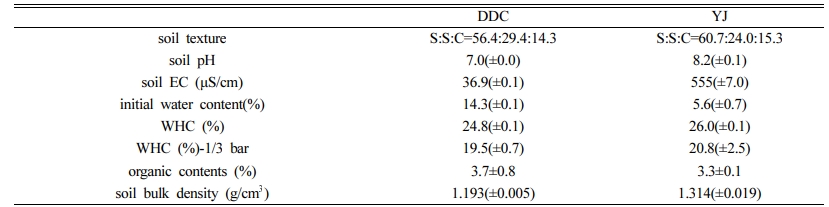
EC, Electrical conductivity; WHC, Water holding capacity DDC, a soil remediated by land farming, YJ, a soil remediated by thermal desorption |
|
Table 2 Soil enzyme activities† of the uncontaminated and reclaimed soils |
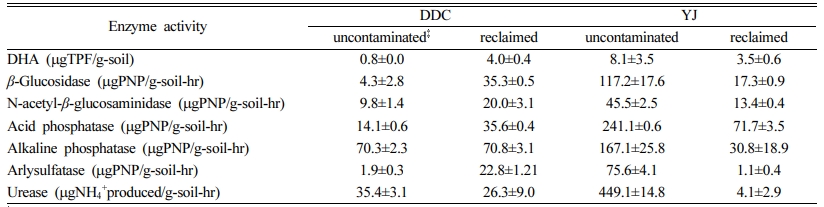
† Enzyme activity was measured by product formation through a specific catalytic reaction of an enzyme, such as PNP or NH4 + , at a given time with a unit amount of soil. |
|
Table 3 Dry weight of the above-ground plant biomass grown in reclaimed soil for 80 days |
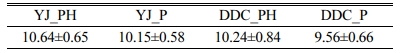
정화과정에서 토양의 특성변화가 발생하여 재활용에 어려움이 있다. 처리토의 건강성을 회복하기 위해 토양경작 및 열탈착으로 정화한 TPH 오염 처리토를 각각 담은 화분에 녹비식물인 헤어리베치와 세스바니아를 혼합식재하고 80일간 식물생장상에서 재배한 다음, 토양의 생물학적 건강성 지표에 미치는 영향을 조사하였다. 이때 녹비식물이외에도 천연유기물질인 휴믹물질(HS)이 미치는 영향도 함께 조사하였다.
그 결과, 두 종의 녹비식물은 처리토에서 생장할 수 있었고, 식물+휴믹물질 첨가구에서 식물생장이 외견상 활발하였고 지상부 건량이 식물식재구에 비해서 조금 높았으나, 통계적으로 유의하지 않았다. 이는 실험에 사용한 식물생장상의 광량이 낮은 것에 기인하며, 자연 상태에서 지상부외에 지하부 성장까지 관측할 수 있는 칼럼실험 등이 필요할 것이라 판단된다.
토양의 생물학적 건강성인자로 7종 토양효소 및 미생물 군집을 분석하여 비교하였다. 토양경작처리토(DDC토양)에서는 식물식재구 및 식물식재+HS처리구에서 7종 토양효소활성 평균값이 미식재 대조구 대비 1.6 및 3.9배 증가하였고, 저온열탈착처리토(YJ토양)에서는 미식재 대조구 대비 1.8 및 3.8배 증가하였다. 미생물군집 분석결과, 녹비식물 혼합식재 후에 미식재구에서는 매우 낮거나(<1.5%) 발견되지 않았던 질소고정미생물의 우점도가 DDC토양에서는 약 7% 이상으로 증가하였고, HS 첨가구에서는 약 1% 더 높은 8% 이상이었다. YJ 토양에서도 질소고정미생물 우점도가 5% 정도로 증가하였고, HS 첨가에서 조금 더 높았다.
이상의 결과로 녹비식물 혼합재배 및 HS는 처리토의 생물학적 건강성 회복/증진에 효과적인 방법임이 확인되었으나, 토양건강성은 물리화학적 요인도 포함된다. 그러므로 토양건강성 회복을 전체적으로 평가하기 위해서는 녹비식물을 토양으로 환원하고 숙성한 다음, 물리화학적 지표변화도 포함하여 관측하는 연구가 계속되어야 할 것이다.
본 연구는 한국환경산업기술원의 연구비지원(RE20200 2009)으로 수행되었습니다
- 1. 국립산림과학원, 2014, 토양및 식물체 분석법: 토양 물리성, 등록번호 11-1400377-000748-01.
- 2. 양창휴, 신평, 백남현, 조광민, 이상복, 노태환, 이경보, 이건휘, 2014, 간척지에서 헤어리베치와 밀 혼파재배에 따른 녹비 생산성 증진 효과, J. Agric. Life Sci., 48(3), 85-91.
- 3. Han, S.H., Jung, M.C., Kim, J.W., Jeon, S.W., Nguyen, Q.T., Yoon, K.W., and Min, S.K., 2020, The occurrence and treatment status of off-site contaminated soils in Korea, J. Soil Groundw. Environ., 25(4), 1-6.
-

- 4. Allison, S.D., 2006, Soil minerals and humic acids alter enzyme stability: implications for ecosystem processes, Biogeochemistry, 81, 361-373.
-

- 5. Aon, M.A., Cabello, M.N., Sarena, D.E., Colaneri, A.C., Franco, M.G., Burgos, J.L., and Cortassa, S., 2001, Spatio-temporal patterns of soil microbial and enzymatic activities in agricultural soils, Appl. Soil Ecol., 18(3), 239-254.
-

- 6. Baer, S.G. and Birge, H.E., 2018, Soil Ecosystem Service: An Overview, in Reicosky, D. (ed.), Managing Soil Health for Sustainable Agriculture Volume 1: Fundamentals, Burleigh Dodds Science Publishing, Cambridge, UK.
- 7. Baveye, P.C., Baveye, J., and Gowdy, J., 2016, Soil ¡°Ecosystem¡± services and natural capital: Critical appraisal of research on uncertain ground, Front. Environ. Sci., 4(41), 1-49.
-

- 8. Besalatpour, A., Hajabbasi, M.A., Khoshgoftarmanesh, A.H., and Dorostkar, V., 2011, Landfarming process effects on biochemical properties of petroleum-contaminated soils, Soil Sediment Contam., 20(2), 234-248.
-

- 9. Canellas, L.P. and Olivares, F.L., 2014, Physiological responses to humic substances as plant growth promoter, Chem. Biol. Technol. Agric., 1(3), 1-11.
-

- 10. Chen, Y., Clapp, C.E., and Magen, H., 2004, Mechanisms of plant growth stimulation by humic substances: the role of organo-iron complexes, Soil Sci. Plant Nutr., 50(7), 1089-1095.
-

- 11. Ekin, Z., 2019, Integrated use of humic acid and plant growth promoting rhizobacteria to ensure higher potato productivity in sustainable agriculture, Sustainability, 11(12), 3417-3429.
-

- 12. Galitskaya, P., Biktasheva, L., Blagodatsky, S., and Selivanovskaya, S., 2021, Response of bacterial and fungal communities to high petroleum pollution in different soils, Sci. Rep., 11, 164.
-

- 13. Gao, Y.-C., Guo, S.-H., Wang, J.-N., Li, D., Wang, H., and Zeng, D.-H., 2014, Effects of different remediation treatments on crude oil contaminated saline soil, Chemosphere, 117, 486-493.
-

- 14. Griffiths, B.S., Hallett, P.D., Kuan, H.L., Gregory, A.S., Watts, C.W., and Whitmore, A.P., 2008, Functional resilience of soil microbial communities depends on both soil structure and microbial community composition, Biol. Fertil. Soils, 44(5), 745-754.
-

- 15. Haghighi, S., Nejad, T.S., and Lack S., 2011, Effect of biological fertilizer of humic acid on metabolic process of biological nitrogen fixation, J. Life Sci., 8(3), 43-48.
- 16. Kalam, S., Basu, A., Ahmad, I., Sayyed, R.Z., Ali El-Enshasy, H., Dailin, D.J., and Suriani, N.L., 2020, Recent understanding of soil Acidobacteria and their ecological significance: A critical review, Front. Microbiol., 11, 580024.
- 17. Kandeler, E. and Gerber, H., 1988, Short-term assay of soil urease activity using colorimetric determination of ammonium, Biol. Fertil. Soils, 6, 68-72.
-

- 18. Khaled, H. and Fawy, H.A., 2011, Effect of different levels of humic acids on the nutrient content, plant growth, and soil properties under conditions of salinity, Soil Water Res., 6(1), 21-29.
-

- 19. Kibblewhite, M.G., Ritz, K., and Swift, M.J., 2008, Soil health in agricultural systems, Philos. Trans. R. Soc. London, Ser. B, 363, 685-701.
-

- 20. Kuske, C.R., Barns, S.M., and Busch, J.D., 1997, Diverse uncultivated bacterial groups from soils of the arid southwestern United States that are present in many geographic regions, Appl. Environ. Microbiol., 63(9), 3614-3621.
-

- 21. Li, Y., Fang, F., Wei, J., Wu, X., Chui, R., Li, G., Zheng, F., and Tan, D., 2019, Humic acid fertilizer improved soil properties and soil microbial diversity of continuous cropping peanut: a three-year experiment, Sci. Rep., 9, 12014.
-

- 22. Li, Y., Tan., W.F., Koopal, L.K., Wang, M.X., Fan Liu, F., and Norde, W., 2013, Influence of soil humic and fulvic acid on the activity and stability of lysozyme and urease, Environ. Sci. Technol., 47(10), 5050-5056.
-

- 23. Malcolm, R.E. and Vaughan, D., 1979, Humic substance and phosphatase activities in plant tissues, Soil Biol. Biochem., 11(3), 253-259.
- 24. Martinez, M.M., Ortega, R., Janssens, M., and Fincheira, P., 2018, Use of organic amendments in table grape: effect on plant root system and soil quality indicators, J. Soil Sci. Plant Nutr., 18(1), 100-112.
-

- 25. Millennium Ecosystem Assessment, 2005, Ecosystems and Human Well-Being, Island Press, Washington DC.
- 26. Mitter, E.K., Germida, J.J., and Freitas, J.R., 2021, Impact of diesel and biodiesel contamination on soil microbial community activity and structure, Sci. Rep., 11, 10856.
-

- 27. Nikbakht, A., Kafi, M., Babalar, M., Xia, Y.P., Luo, A., and Etemadi, N., 2008, Effect of humic acid on plant growth, nutrient uptake, and postharvest life of gerbera, J. Plant Nutr., 31, 2155-2167.
-

- 28. Singh, H.P., Batish, D.R., and Kohli, R.K., 2006, Handbook of Sustainable Weed Management, CRC Press, Boca Raton, Florida, USA.
- 29. Pape, A., Switzer, C., Mccosh, N., and Knapp, C., 2015, Impacts of thermal and smouldering remediation on plant growth and soil ecology, Geoderma, 243-244, 1-9.
-

- 30. Pepper, I.L. and Gerba, C.P., 2004, Environmental Microbiology: A Laboratory Manual, 2nd Ed., Elsevier Academic Press, MA, USA.
- 31. Reddy, M.V., Devi, M.P., Chandrasekhar, K., Goud, R.K., and Mohan, S.V., 2011, Aerobic remediation of petroleum sludge through soil supplementation: Microbial community analysis, J. Hazard. Mater., 197, 80-87.
- 32. Silva, M.S.R.A., Tavares, O.C.H., Ribeiro, T.G., Silva, C.S.R.A., Silva, C.S.R.A., Garcia-Mina, J.M., Baldani, V.L.D., Garcia, A.C., Berbara, R.L.L., and Jusus, E.C., 2021, Humic acids enrich the plant microbiota with bacterial candidates for the suppression of pathogens, Appl. Soil Ecol., 168, 104146.
- 33. Sun, Q, Liu J.L, Huo L.F, Li Y.C, Li X, Xia L.R, Zhou, Z., Zhang, M., and Li, B., 2020, Humic acids derived from Leonardite to improve enzymatic activities and bioavailability of nutrients in a calcareous soil, Int. J. Agric. Biol. Eng., 13(3), 200-205.
-

- 34. Trevisan, S., Francioso, O., Quaggiotti, S., and Nardi, S., 2010, Humic substances biological activity at the plant-soil interface, Plant Signaling Behav., 5(6), 635-643.
-

- 35. Villamil, M.B., Bollero, G.A., Darmody, R.G., Simmons, F.W., and Bullock, D.G., 2006, No-till corn/soybean systems including winter cover crops: effects on soil properties, Soil Sci. Soc. Am. J., 70(6), 1936-1944.
-

- 36. Vidonish, J.E., Zygourakis, K., Masiello, C.A., Sabadell G., and Alvarez, P.J., 2016, Thermal treatment of hydrocarbon-impacted soils: A review of technology innovation for sustainable remediation, Engineering, 2(4), 426-437.
-

- 37. Zanin, L., Tomas, N., Cesco, S., Varanini, Z., and Pinton, R., 2019, Humic substances contribute to plant iron nutrition acting as chelators and biostimulants, Front. Plant Sci., 10, 675.
-

- 38. Zhou, L., Li, H., Zhang, Y., Han, S., and Xu, H., 2016, Sphingomonas from petroleum-contaminated soils in Shenfu, China and their PAHs degradation abilities, Braz. J. Microbiol., 47, 271-278.
 This Article
This Article
-
2021; 26(5): 49-59
Published on Oct 31, 2021
- 10.7857/JSGE.2021.26.5.049
- Received on Sep 23, 2021
- Revised on Oct 6, 2021
- Accepted on Oct 19, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumhan Bae
-
Department of Civil & Environmental Engineering, Gachon University
- E-mail: bhbae@gachon.ac.kr





