- Evaluation on Soil Washing of Metal-contaminated Soil using Non-Inorganic Acids
Ga-Bin Lee1,a·Won-Gune Jeong1,a·Su-Min Lee1·Jin Park1·Yong-Hwan Jo1·Kitae Baek1*
1Department of Environment & Energy and Soil Environment Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin, Jeonju, Jeollabukdo 54896, Republic of Korea
- 비 무기산 세척제에 의한 중금속 오염 토양 세척효과 평가
이가빈1,a·정원균1,a·이수민1·박 진1·조용환1·백기태1*
1전북대학교 환경에너지융합학과 및 토양환경연구센터
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Inorganic acids such as HCl, HNO3, and H2SO4 have been commonly applied to soil washing of heavy metals-contaminated soil due to their cost-effectiveness. However, implementing the ‘Chemical Substance Control Act’ requires off-site risk assessment of the chemicals used in the soil washing. Therefore, in this study, organic acids or Fe(III)-based washing agents were evaluated to replace commonly used inorganic acids. Ferric removed heavy metals via H+ generated by hydrolysis, which is similar to the HCl used in the control group. Oxalic acid and citric acid were effective to remove Cu, Zn, and Cd from soil. Organic acids could not remove Pb because they could form Pb-organic acid complexes with low solubility. Furthermore, Pb could be adsorbed onto the iron-organic acid complex on the soil surface. Ferric could remove exchangeable-carbonate, Fe-Mn hydroxide, and organic matter and sulfides bound heavy metals (F1, F2, and F3). Organic acids could remove the exchangeable-carbonate and Fe-Mn hydroxide bound metals (F1&F2). Therefore, this research shows that the fractionation of heavy metals in the soil and the properties of washing agents should be considered in the selection of agents in the process design.
Keywords: Soil washing, Heavy metal, Ferric chloride, Organic acid
산업단지, 광산, 제련소와 같이 중금속으로 오염된 부지의 정화에는 고형화/안정화(Solidification/Stabilization), 전기동력학적 정화(Electrokinetic method), 토양세정/세척(Soil flushing/washing), 식물정화법(Phytoremediation)이 활용되고 있다(Feng et al., 2020; Yang et al., 2013; Shin et al., 2016; Park et al., 2021). 이러한 기술들 중 토양세척은 세척제를 이용하여 토양 입자에 결합되어 있는 중금속을 용해시키거나 복합체 형성과 같은 화학적 작용으로 단시간에 높은 효율로 중금속을 제거할 수 있으며, 국내 토양 규제를 만족할 수 있어 현장적용성이 뛰어난 공정이다(Baek et al., 2007; Lee et al., 2018; Kim et al., 2014). 토양세척은 무기산류(염산, 질산, 황산), 유기산류(아세트산, 구연산), 킬레이트제(EDTA, EDDS), 계면활성제 등의 세척제가 사용된다(Lee and Park, 2010; Yoo et al., 2017). 그동안 대부분의 정화 현장에서는 높은 세척효율과 저렴한 세척제 비용으로 염산, 질산과 같은 무기산을 세척제로 사용하였다(Oh et al., 2018). 하지만 기존에 사용되던 강산성 무기산(염산, 질산, 황산)은 유독성 흄 발생 및 장비 부식 등을 고려해야 하며 토양구조가 변해 토양 생태계에 악영향을 줄 수 있다. 또한 화학물질관리법의 시행에 따라, 무기산인 염산, 질산, 황산 등이 유독물질로 지정되어 유해화학물질에서 발생되는 화학물질 배출량 저감 및 화학물질의 영향평가를 수행해야 한다. 따라서 토양 세척기술에 주로 사용되던 무기산을 대체할 수 있는 세척제로 유기산과 철 기반의 세척제의 세척효율 평가가 필요하다.
옥살산(Oxalic acid)이나 구연산(Citric acid)과 같은 유기산은 1) 리간드 교환 반응을 통해 토양 표면에 흡착된 금속의 치환, 2) 금속산화물 형태로 표면에 흡착된 금속을 용해, 3) 용액 상에서 금속-유기물 복합체 형성 반응을 통해 중금속을 토양입자에서 분리할 수 있다(Kim et al., 2013; Beiyuan et al., 2018). 또한 무기산에 비해 토양 특성을 유지하면서, 토양산성화 등의 부작용을 줄일 수 있다(Wuana et al., 2010; Lee et al., 2018). 이 외에 염화제이철(FeCl3), 황산제이철(Fe2(SO4)3)과 같은 철 기반 세척제는 중금속과 철(III) 이온이 직접적인 이온교환을 하거나 물과 반응하여 생성되는 수소이온(H+)으로 인하여 토양입자에 결합되어 있는 중금속의 용출을 촉진시킬 수 있다(Yoo et al., 2018).
세척제의 적용은 서로 다른 특징과 중금속 제거기작을 가지고 있어 중금속의 제거효율에 영향을 주기 때문에 중금속의 존재 형태를 고려할 필요가 있다(Kim and Baek, 2014). 토양에 존재하는 중금속은 산화/환원, 흡착/탈착 등의 반응으로 토양 입자에 다양한 형태로 존재할 수 있으며, 결합형태를 일반적으로 이온교환성 탄산염 결합태, 철-망간 수산화물 결합태, 유기물-황화물 결합태, 잔류태로 구분한다(Rauret et al., 1999; Moon et al., 2016). 이러한 결합형태를 정확하게 평가하여 토양세척공정에 적합한 세척제를 선정하는 것이 필요하다. 또한 각각의 세척제의 특성을 고려할 필요가 있다.
따라서 본 연구에서는 토양세척공정에서 보편적으로 사용되던 염산, 질산, 황산 등의 무기산 세척제를 대체하며, 화학물질관리법에 대응할 수 있는 세척제로서 유기산 및 철 기반 세척제를 선정하였다. 또한 토양 중 중금속의 결합형태를 바탕으로 유기산 세척제 및 철 기반 세척제의 중금속(납, 구리, 아연, 카드뮴) 제거효율을 평가하고자 하였다. 유기산 세척제의 경우 유기산의 리간드와 금속이온의 복합체를 형성하는 평형상수인 안정화상수(Ks, Sta- bility constant), 수소이온에 의한 금속이온의 용해를 의미하는 산 해리상수(pKa) 및 경제성 등을 고려하여야 한다(Eq. (1) and (2))(Sarý et al., 2020; Ke et al., 2020). 유기산 세척제는 납, 구리, 아연과 안정화상수가 상대적으로 높아 금속이온과 세척제의 결합에 따른 높은 세척효율을 기대할 수 있으며 상대적으로 경제성이 있는 옥살산과 구연산을 선정하여 실험을 진행고자 하였다(Table 1).
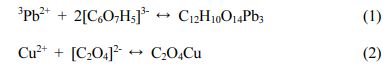
2.1. 토양시료 및 분석
본 연구에 사용된 토양(Soil 1-11)은 중금속(납, 구리, 아연, 카드뮴)으로 오염된 지역에서 채취하였다. 토양 시료는 24시간 이상 풍건 후, 균질성을 확보하기 위해 2 mm 이하로 체 거름하여 실험에 사용하였다. 토양 pH는 토양과 증류수를 1:10(W/V %)의 비율로 혼합한 뒤, 1시간 동안 정치 후 pH 미터기(K2200-pH, ISTEK, Korea)를 이용하여 측정하였다. 토양의 수분함량은 토양오염공정시험기준에 따라 105oC에서 4시간 건조된 시료의 무게차이를 이용하였으며, 유기물함량은 440oC에서 24시간 강열 감량을 측정하여 분석하였다. 모든 중금속 농도는 토양을 막자사발로 분쇄 한 후 혼합하여 150 mm 이하로 체 거름한 뒤, 왕수추출 후 ICP-OES(720-OES, Agilent Tech- nologies, USA)를 이용하여 분석하였다. 입경 별 토양과 중금속의 결합형태는 SM&T 분석법에 따라 1) 교환가능-탄산염 결합태, 2) 철-망간 수산화물 결합태, 3) 유기물-황화합물 결합태, 4) 잔류태로 구분하여 순차적으로 추출하여 평가하였다(Table 2) (Rauret, et al., 1999; Yoo et al., 2013). 세척 전, 후 토양의 작용기는 FT-IR(Alpha 2, Bruker, Germany)을 통해 분석하였다(Kim et al., 2022).
2.2. 토양세척실험
토양세척실험은 0.2 M의 세척제로 고액비를 1:5로 하여 30분동안 30 rpm(Rotator, FINEPCR, Korea)으로 교반하였다. 유기산 세척제는 옥살산(Oxalic acid, OA, 99.0%, SAMCHUN, Korea), 구연산(Citric acid, CA, ³ 99.5%, DAEJUNG, Korea)을 사용하였으며, 철 기반 세척제는 염화제이철(FeCl3, FC, ³ 97.0%, JUNSEI, Japan)을 사용하였다. 대조군으로 염산(HCl, 35.0~37.0%, SAMCHUN, Korea)을 사용하여 대상 세척제의 효율을 비교하였다. 토양 세척 후 8000 rpm에서 5분 동안 원심분리 후 여과하여 여과액을 ICP-OES로 분석하였다.
3.1. 토양의 물리화학적 특성 평가
본 연구에서 사용한 중금속 오염토양(S1-11)의 물리화학적 특성을 Table 3에 나타내었다. 11개의 토양 중 대부분은 중성 토양이었으며, Soil 1, 6, 7, 8은 산성을 나타내었다. 유기물함량은 S9을 제외한 모든 토양에서 국내 토양 평균 유기물 함량 2.3% 보다 높은 것을 알 수 있었다. 토양 중 중금속 농도는 Pb 7483.6-400.5 mg/kg, Cu 1282.8-61.4 mg/kg, Zn 1128.1-177.1 mg/kg, Cd 14.4-1.3 mg/kg로 모든 토양에서 한가지 중금속 이상이 토양오염우려기준을 모두 초과하였다.
토양입자와 중금속의 결합형태를 확인하기 위하여 SM&T방법으로 분석한 결과를 Fig. 1에 나타내었다. 1) 교환가능-탄산염 결합태, 2) 철-망간 수산화물 결합태, 3) 유기물-황화합물 결합태, 4) 잔류태로 구분하여 순차적으로 추출하였으며 일반적으로 뒷단계에서 추출될수록 토양입자와 강하게 결합되어 있는 것을 의미한다(Kim and Baek, 2014). 연속추출 결과 토양 중 Pb의 8.0-42.4%와 42.4-78.9%가 1단계(F1)와 2단계(F2)로 존재하였으며, Pb의 대부분이 상대적으로 추출하기 쉬운 형태인 교환가능한 탄산염과 철-망간 수산화물 결합태 형태로 존재하였다. 이와 반대로 Cd는 37.6-78.3%가 4단계(F4)인 잔류태로 존재하고 있어 중금속을 추출하기 어려울 것으로 판단된다. Cu와 Zn는 F1과 F2로 존재하는 비율이 약 50%이기 때문에 Cd보다는 상대적으로 추출하기가 용이할 것으로 판단된다.
3.2. 중금속 존재 형태에 따른 토양세척효율 평가
세척제별 토양의 정화효율을 평가하기 위하여 0.2 M의 세척제로 토양세척실험을 수행하였다(Table 4). 실험결과 유기산인 옥살산과 구연산은 납을 제외한 구리, 아연, 카드뮴에 대하여 세척효율이 대조군으로 사용된 염산보다 높거나 비슷한 효율을 보여주었다. 염화제이철은 납, 구리, 아연, 카드뮴 모두 제거하였지만 염산보다는 효율이 낮았다.
세척 전후 토양의 중금속 결합형태를 비교한 결과, 염산과 염화 철은 F1~F3으로 존재하는 중금속을 주로 추출하였다(Fig. 2). 수소이온을 이용하는 염산과 유사한 철 기반 세척제는 가수분해를 통해 수소이온을 생성할 수 있다(Eq. (3)). 이는 생성된 수소이온이 토양의 금속과 직접적으로 이온교환을 하는 acid-enhanced dissolution이 진행됨을 의미한다. 또한 3가 철이온은 0.77 V의 높은 산화전위를 가지고 있으며 다른 금속보다 유기물과의 친화성이 높다. 따라서 2가 철이온으로 환원되면서 산화제의 역할을 하거나, 유기물과 철복합체 형성을 통해 유기물, 황화물에 결합된 중금속을 추출할 수 있다(Eq. (4) and (5)) (Yoo et al., 2018; Yoo et al., 2017).
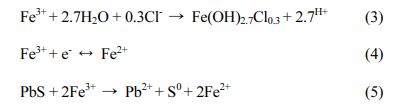
옥살산과 구연산을 적용한 토양세척에서 납은 교환가능-탄산염 및 철-망간 수산화물 결합태가 2.5%, 0.3% 감소하였다. 이는 납이 옥살염(Oxalate, C2O42-), 시트르산 이온(Citrate, C6H5O73-)와 직접적으로 불용성 침전물을 형성하거나, 수소이온에 의해 용출된 납이온이 토양의 철이온과 결합한 oxalate 또는 citrate 복합체에 흡착되었기 때문이다(Eq. (6) and (7))(Lee et al., 2016). 또한 유기산은 중금속과 안정한 형태의 복합체를 형성하는데, 유기산과 납의 복합체인 lead oxalate는 다른 중금속에 비해 낮은 용해도를 보인다(Table 5). 이는 염화제이철과 다르게 옥살산을 이용하였을 경우, 불용성인 lead oxalate가 침전되기 때문에 토양과의 분리가 어려워 납의 제거효율이 낮음을 의미한다. 구리와 아연 또한 불용성인 copper oxalate, zinc oxalate를 형성할 수 있지만, 구리 및 아연은 납에 비하여 상대적으로 낮은 농도로 존재하기 때문에 형성될 수 있는 침전물의 양이 적어 제거효율이 높게 나타났다.
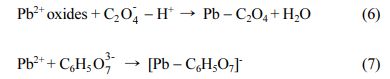
유기산에 의한 세척 전후 토양 표면의 작용기 변화를 확인한 결과, 토양 세척 후 토양 표면의 C=O가 증가한 것을 확인할 수 있었다(Fig. 3). 이는 oxalate, citrate의 carboxylic group(-COO)과 토양에 존재하는 철이 inner-sphere ring-type surface 복합체를 형성하며, 이 때 철 이온 중심으로 전자밀도가 이동해 토양으로부터 철복합체가 분리된다(Elliott and Shastri, 1999; Lee et al., 2017). 이에 따라 1637 cm-1에서 나타나는 C=O피크는 철 복합체가 분리된 이후, 유기산세척제에 존재하는 carboxylic group의 진동으로 인하여 나타나며, 세척 후 토양 표면의 C=O가 증가된 것을 의미한다(Kim, et al., 2022).
3.3.결합형태와 세척효율 회귀분석
Table 6에서 세척 전 토양의 중금속과 토양의 결합형태와 제거된 중금속의 농도를 회귀분석한 결정계수를 나타내었다. 각 중금속에 대한 결정계수를 바탕으로 상관성이 높은 결합형태를 선정한 결과, 염산과 비슷한 경향을 보여주었던 염화제이철은 F1 + F2 + F3를 의미하는 교환가능-탄산염 결합태, 철-망간 수산화물 결합태, 유기물-황화합물 결합태를 제거할 수 있는 것으로 나타났다(Fig. 4). 반면에 옥살산, 구연산은 납을 제외한 중금속의 제거에 적합하며, 중금속에 따라서 제거할 수 있는 형태가 다른 경향을 보였다. 유기산은 F1 + F2 + F3 형태의 구리와 아연을 제거할 수 있으나, 카드뮴은 F1 + F2 형태를 제거할 수 있는 것으로 확인되었다. 이는 염산 및 염화제이철과 같이 수소이온을 방출하여 산성조건을 형성하나, 중금속과 안정한 복합체를 형성하여 토양으로부터 중금속의 완전한 제거를 이루기 어렵다(Eq. (8)-(11)). 이러한 염화제이철과 유기산의 중금속 제거기작은 회귀분석 결과와 유사한 경향을 보여주었다.
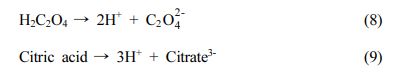
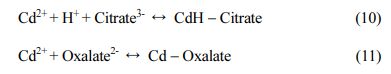

|
Fig. 1 Sequentially extracted fraction of a) Pb, b) Cu, c) Zn, d) Cd from initial soil. |

|
Fig. 2 Sequentially extracted fraction of heavy metals before and after soil washing from S9 |

|
Fig. 3 FT-IR spectra of soil 1, 7, 9 before and after washing with oxalic acid and citric acid. |

|
Fig. 4 Concentration of removed heavy metals ; Pb (a, e, i, m), Cu (b, f, j, n), Zn (e, g, k, o), Cd (d, h, l, p). |
|
Table 4 Removal efficiency (%) of heavy metal using extracting agents |

a)Ferric chloride (FeCl3) |
|
Table 5 Solubility equilibrium constant (Ksp) of lead, copper, zinc, cadmium oxalate |

|
Table 6 Determination Coefficient of soil washing efficiency regression analysis (Independent variable: soil-heavy metal forms of initial soil, dependent variable: removed concentration of heavy metals) |

본 연구에서 기존에 사용되던 염산, 질산, 황산과 같은 무기산을 대체하기 위하여 세척제의 화학적 특성 및 경제성을 고려해 유기산, 철 기반 세척제를 선정하였으며, 중금속으로 오염된 토양의 세척효율을 평가하였다. 납, 구리, 아연, 카드뮴에 대하여 연속추출을 통해 중금속의 결합형태를 확인하여 토양 중 중금속의 특성과 세척제의 영향을 확인할 수 있었다. 대조군으로 사용된 염산과 유사하게 염화제이철은 가수분해로 인하여 생성된 수소이온의 영향으로 중금속을 제거하였다. 유기산으로 사용된 옥살산과 구연산은 Pb을 제외한 Cu, Zn, Cd의 제거에 효과적이었다. 유기산을 사용하였을 때 Pb은 유기산과 납의 복합체 형성 또는 유기산에 존재하는 carboxilic group과 철의 결합에 의해 생성된 복합체에 Pb의 흡착으로 인하여 제거효율이 낮음을 보여주었다. 중금속의 결합형태와 세척효율을 회귀분석한 결과 염화제이철은 염산과 유사하게 교환가능-탄산염 결합태, 철-망간 수산화물 결합태, 유기물-황화합물 결합태를 제거할 수 있는 것으로 나타났으며 유기산은 1, 2단계의 합에 영향을 받는 것을 확인하였다. 따라서, 토양 중 중금속의 결합형태와 세척제의 특성은 세척효율에 큰 영향을 주는 것을 확인하였으며, 일반적으로 토양세척공정에 사용되는 염산을 대체할 수 있는 대체 세척제로 염화제이철이 적합함을 확인할 수 있었다. 또한 유기산의 경우 Pb의 제거에는 효과가 없으나 Cu, Zn, Cd의 제거에는 효과적이었다. 따라서 토양세척공정에서 화학물질관리법을 대응하면서, 친환경성 및 경제성을 답보할 수 있는 세척제의 발굴이 필요하며, 대체 세척제의 선정과정에서 세척제의 특성 및 중금속의 결합형태를 고려할 필요가 있다.
본 연구는 2022년 전북대학교 교육연구비와 ㈜ 현대건설의 지원을 받아 수행되었습니다.
- 1. Feng, W., Zhang, S., Zhong, Q., Wang, G., Pan, X., Xu, X., Zhou, W., Li, T., Luo, L., and Zhang, Y., 2020, Soil washing remediation of heavy metal from contaminated soil with EDTMP and PAA: Properties, optimization, and risk assessment, J. Hazard. Mater., 381, 120997.
-

- 2. Ke, X., Zhang, F.J., Zhou, Y., Zhang, H.J., Guo, G.L., and Tian,Y., 2020, Removal of Cd, Pb, Zn, Cu in smelter soil by citric acid leaching, Chemosphere, 255, 126690.
-

- 3. Kim, D.-H., Hwang, B.-R., Her, N., Jeong, S., and Baek,K., 2014, Environmental impact of soil washing process based on the CO2emissions and energy consumption, Korean Chem. Eng. Res., 52(1), 119-125.
-

- 4. Kim, E.J. and Baek, K., 2014, Effect of metal speciations on heavy metal removal from contaminated soils, J. Korean Soc. Environ. Anal., 17(2), 88-94.
- 5. Kim, H., Cho, K., Purev, O., Choi, N., and Lee, J., 2022, Remediation of toxic heavy metal contaminated soil by combining a washing ejector based on hydrodynamic cavitation and soil washing process, Int. J. Environ. Res. Public Health, 19(2), 786.
-

- 6. Kim, J.-O., Lee, Y.-W., and Chung, J., 2013, The role of organic acids in the mobilization of heavy metals from soil, KSCE J. Civ. Eng., 17(7), 1596-1602.
-

- 7. Lee, J.C., Kim, E.J., and Baek, K., 2017, Synergistic effects of the combination of oxalate and ascorbate on arsenic extraction from contaminated soils, Chemosphere, 168, 1439-1446.
-

- 8. Lee, J.-C., Kim, E.J., Kim, H.-W., and Baek, K., 2016, Oxalate-based remediation of arsenic bound to amorphous Fe and Al hydrous oxides in soil, Geoderma, 270, 76-82.
-

- 9. Lee, J.-H. and Park, K.-S., 2010, Comparison of soil washing for heavy metal contaminated shooting range using various extracts, Econ. Environ. Geol., 43(2), 123-136.
- 10. Lee, M.E., Jeon, E.-K., Kim, J.-G., and Baek, K., 2018, Oxalic acid-based remediation of arsenic-contaminated soil, J. Soil Groundwater Environ., 23(1), 85-91.
-

- 11. Lee, M.E., Jeon, E.K., Tsang, D.C.W., and Baek, K., 2018, Simultaneous application of oxalic acid and dithionite for enhanced extraction of arsenic bound to amorphous and crystalline iron oxides, J. Hazard. Mater., 354, 91-98.
-

- 12. Moon, D.H., Park, J.-W., Koutsospyros, A., Cheong, K.H., Chang, Y.-Y., Baek, K., Jo, R., and Park, J.-H., 2016, Assessment of soil washing for simultaneous removal of heavy metals and low-level petroleum hydrocarbons using various washing solutions, Environ. Earth Sci., 75(884).
-

- 13. Oh, S., Yoo, J., Baek, K., Kim, H., and Park, J., 2018, Research with statistical model to analyze efficiency of heavy metal soil washing, J. Soil Groundwater Environ., 23(1), 14-24.
-

- 14. Park, S.-M., Kim, T., Kim, Y.-H., and Baek, K., 2021, Hybrid process of combined soil washing and selective adsorption to treat Cs-contaminated soil, Chem. Eng. J., 423, 129921.
-

- 15. Rauret, G., López-Sánchez, J.F., Sahuquillo, A., Rubio, R., Davidson, C., Ure, A., and Quevauviller, P., 1999, Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials, J. Environ. Monit., 1(1), 57-61.
-

- 16. Sar©¥, Z.A., Turan, M.D., Nizamoğlu, H., Demiraslan, A., and Depci, T., 2020, Selective copper recovery with HCl leaching from copper oxalate material, Min. Metall. Explor., 37(3), 887-897.
-

- 17. Shin, S.-Y., Park, S.-M., and Baek, K., 2016, Electrokinetic removal of as from soil washing residue, Water Air Soil Pollut., 227(223).
-

- 18. Wuana, R.A., Okieimen, F.E., and Imborvungu, J.A., 2010, Removal of heavy metals from a contaminated soil using organic chelating acids, Int. J. Environ. Sci. Technol., 7(3), 485-496.
-

- 19. Yang, J.-S., Hwang, J.-M., Baek, K., and Kwon, M.J., 2013, Soil washing and effluent treatment for contaminated soil with toxic metals, Korean Chem. Eng. Res., 51(6), 745-754.
-

- 20. Yoo, J., Jeon, P., Tsang, D.C.W., Kwon, E.E., and Baek, K., 2018, Ferric-enhanced chemical remediation of dredged marine sediment contaminated by metals and petroleum hydrocarbons, Environ. Pollut., 243, 87-93.
-

- 21. Yoo, J.C., Jeon, P.Y., Tsang, D.C.W., Kwon, E.E., and Baek, K., 2018, Ferric-enhanced chemical remediation of dredged marine sediment contaminated by metals and petroleum hydrocarbons, Environ. Pollut., 243(Pt A), 87-93.
-

- 22. Yoo, J.C., Lee, C., Lee, J.S., and Baek, K., 2017, Simultaneous application of chemical oxidation and extraction processes is effective at remediating soil Co-contaminated with petroleum and heavy metals, J. Environ. Manage., 186(Pt 2), 314-319.
-

- 23. Yoo, J.-C., Lee, C.-D., Yang, J.-S., and Baek, K., 2013, Extraction characteristics of heavy metals from marine sediments, Chem. Eng. J., 228, 688-699.
-

- 24. Yoo, J.C., Park, S.M., Yoon, G.S., Tsang, D.C.W., and Baek, K., 2017, Effects of lead mineralogy on soil washing enhanced by ferric salts as extracting and oxidizing agents, Chemosphere, 185, 501-508.
-

 This Article
This Article
-
2022; 27(5): 10-17
Published on Oct 31, 2022
- 10.7857/JSGE.2022.27.5.010
- Received on Aug 23, 2022
- Revised on Aug 30, 2022
- Accepted on Oct 12, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kitae Baek
-
Department of Environment & Energy and Soil Environment Research Center, Jeonbuk National University, 567 Baekje-daero, Deokjin, Jeonju, Jeollabukdo 54896, Republic of Koreal
- E-mail: kbaek@jbnu.ac.kr








