- Evaluation of Ammonia Removal Mechanisms and Efficiencies Through Batch Experiments
Jieun Jang1·Jiyoung Kang1·Hye Won Kim2,3·Kyu Jin Shin2,4·Sung-Wook Jeen1,2*
1Department of Environment and Energy, Jeonbuk National University
2Department of Earth and Environmental Sciences & The Earth and Environmental Science System Research Center, Jeonbuk National University
3Korea Land and Geospatial Informatix Corporation
4Joongang Consultant- 배치 실험을 이용한 암모니아 제거 기작 및 효율 평가
장지은1·강지영1·김혜원2,3·신규진2,4·진성욱1,2*
1전북대학교 환경에너지융합학과
2전북대학교 지구환경과학과 & 지구환경시스템 연구소
3한국국토정보공사
4중앙컨설턴트This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
As the amount of livestock wastewater increases, ammonia contamination in surface water and groundwater is also increasing, and its treatment is urgently needed. In this study, indigenous soil bacteria was utilized for ammonia removal in artificial wastewater and associated removal mechanisms and efficiencies were evaluated. Two batch reactors were configurated to contain natural soil and artificial wastewater at 1:10 mass ratio, and incubated for 84 and 168 hours, respectively. The results showed that ammonia was completely removed within 48 and 72 hours in the first and second reactors, respectively. There were no significant changes in ammonia concentrations in the control groups without soil. Nitrate was formed in the reactors, indicating that the main removal mechanism of ammonia was nitrification by nitrifying bacteria. Nitrate was further converted to nitrogen gas by denitrification in the anaerobic environment, which was caused by consumption of oxygen during the nitrification process.
Keywords: Batch experiment, Nitrification, Ammonia, Remediation, Nitrifying bacteria
최근 1인당 육류 소비량이 증가하면서 농장 내 가축의 밀도가 증가하였고(Whitnall and Pitts, 2019), 그 결과 소규모 축사로부터의 가축분뇨 발생량 또한 증가하였다(Cai et al., 2021). 가축분뇨에서 발생하는 악취 문제로 인한 민원이 증가하고 있으며, 악취물질로는 암모니아가 우세하다(Lim et al., 2018). 이는 축산폐수 및 폐기물 처리가 적절하기 이뤄지지 않았음을 시사한다. 이러한 축산폐수는 지표수 및 지하수의 수질오염원이 되며(Kim et al., 2019), 더 나아가 미세먼지의 전구체로서 역할을 한다(Lovarelli et al., 2020).
고농도의 질소와 인이 포함된 축산폐수가 수계에 방류되면 영양성분을 과잉공급하게 되며(Cheung et al., 2003), 영양성분이 과잉공급된 수체에서는 조류가 급격한 성장을 이루어 부영양화 및 수체 내 산소 고갈을 초래한다(Glibert, 2017; Van Hulle et al., 2010). 발생된 녹조류나 남조류는 정수처리 과정에 악영향을 주고, 수돗물의 맛과 냄새 저하, 수생물에 피해를 입히는 등의 여러 가지 문제를 발생시킨다(Lee et al., 2002). 전 세계적으로 부영양화의 발생빈도는 점차 증가하고 있다(Spalding and Exner, 1993). 한편, 가축분뇨의 침출수가 지하수에 노출될 경우 고농도의 질산성 질소에 의해 지하수를 오염시키고, 오염된 지하수는 다시 지표로 흘러들어 지표수의 부영양화를 발생시켜 장기간에 걸친 수질오염을 야기한다. 또한, 축산폐수 내 암모니아가 대기 중으로 방출될 경우 대기 중에서 황산화물(SOx) 및 질산화물(NOx)과 반응해 황산암모늄((NH4)2SO4) 및 질산암모늄(NH4NO3)으로 합성되어 2차 미세먼지를 생성할 수 있다(Lovarelli et al., 2020).
현재까지 제안된 암모니아의 제거방법으로는 생물학적 처리, 화학적 침전, 산화 공정, 에어 스트리핑기술, 이온 교환, 흡착, 그리고 막 공정 등이 있다(Hasanoðlu et al., 2010). 기존의 생물학적 암모니아 제거 공정은 비교적 낮은 암모니아 농도의 폐수를 처리하는데 사용되며(Van Hulle et al., 2010), 고농도의 축산폐수를 처리하기엔 한계가 있다. 또한, 암모니아로 오염된 지표수를 제거하는 공정은 설치 면적이 크고 설비 비용이 많이 들며, 운영 조건(pH 및 폐수의 종류)이 까다롭고 처리시간이 길다는 한계점이 있다(Lee et al., 2007). 이러한 기존의 암모니아 처리 기법들의 한계점을 보완하기 위해 경제적이고 실용적인 기술의 개발이 필요하다. 특히, 농경지 및 축산시설에서 발생한 암모니아는 대부분 배출 지점 근처에 퇴적되며(Howarth, 2002), 폐수가 발생한 지점에서 수권으로의 방출 이전에 처리가 필요하다.
수권에서 암모니아(NH3)는 질소 오염의 주요 형태이며(Sprynskyy et al., 2005), 암모니아가 토양 내에서 암모늄(NH4+)으로 전환된다. 이후 호기성 박테리아에 의해 산화되어 아질산염(NO2-)을 거쳐 질산염(NO3-)이 되는 과정까지를 질산화 과정이라 하며, 질산화 과정은 식 (1)과 같이 표현된다. 한편 혐기성 환경에서 질산염이 질소가스(N2)로 환원되는 과정을 탈질화라고 한다. 탈질과정은 식 (2)과 같이 표현된다:
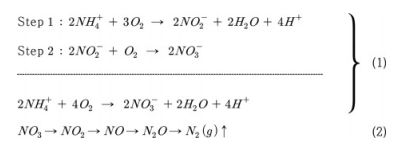
질산화 과정은 질소 순환 과정 중 속도가 가장 느린 단계로 전체 질소 순환의 속도를 제한할 수 있는 단계이다(Chu et al., 2008). 또한 질산화 과정은 토양의 pH, 온도, 수분 및 유기물의 유무에 의해 영향을 받을 수 있다(Qin et al., 2013). 암모니아의 질산화 과정으로부터 생성된 질산염은 식물이 사용할 수 있는 질소의 상태이며, 부산물인 아산화 질소(N2O)는 대표적인 온실가스이다(Zhang et al., 2015). 질산화 과정은 독립영양 박테리아에 의한 과정과 종속영양 박테리아에 의한 과정으로 분류되며, 박테리아의 종에 따라 질산화율이 다르다. Islam et al.(2007)은 산성 토양에서 독립영양 및 종속영양 박테리아에 따른 질산화율의 기여도를 계산하였는데, 전체 질산화율에서 종속영양 질산화가 7%에서 19%의 기여도를 가진다고 제시하였다. Li et al.(2020)은 전 지구적 규모에서의 토양 내 질산화율 패턴을 파악하였고 토양 질산화에 영향을 미치는 환경 요인들의 관계를 규명하였다. 한편 Duan et al.(2022)은 질소를 생물학적으로 저감하는 공정에서 종속영양 박테리아에 의한 질산화 특성을 파악하여 폐수 시스템에서의 종속영양 질산화 박테리아의 역할을 설명하였다. 이와 같이 질산화 과정은 질소 순환의 중요한 과정이며, 질산화율은 박테리아의 다양성 및 풍부함과 관련이 있기 때문에 토양 박테리아에 의한 암모니아의 질산화 연구는 중요하다.
이번 연구에서는 축산폐수 내 암모니아를 제거하기 위한 공학적 방법 또는 자연 저감 기법을 개발하기 위한 전 단계로서 자연 토양 내 존재하는 질산화 박테리아의 암모니아 제거 기작을 이해하고자 하였다. 이를 위해 실내 배치실험을 수행하여 자연 토양을 이용한 암모니아의 자연 저감이 가능한지 알아보고 자연 저감에 있어 최적의 반응시간 및 농도변화 기작을 알아보고자 하였다. 이번 연구는 암모니아 제거에 대한 생화학적 반응 기작의 이해를 통해 수질정화기법의 정립에 기여할 수 있을 것으로 생각된다.
2.1. 배치실험 과정
암모니아가 자연적으로 저감되는 기작을 확인하기 위하여 두 번의 배치실험을 수행하였다. 배치실험을 수행하기 하루 전 날에 실험에 사용할 모든 초자기구를 고압증기멸균기(autoclave)(Wonil Tech, Korea)를 이용하여 고온 및 고압 조건(120oC)에서 30분간 멸균하였고, 24시간 동안 110oC에서 건조시켰다. 플라스틱과 같이 고온/고압 환경에서 변형되는 실험 기구들은 70% 에탄올을 사용하여 소독하였다. 물리적 및 화학적 멸균이 완료된 실험기구는 멸균대(clean bench)(Wonil Tech, Korea)에서 20분 동안 자외선을 쬐어 표면을 살균시키고 보관하였다. 이후에 멸균대 내에서 토양 무게를 측정하고 실험에 사용될 용액을 제조하였다.
각 실험 용액의 부피는 100 mL이었고, 토양은 10 g씩 준비하여 용액과 토양의 비율이 10 mL:1 g이 되도록 하였다. 반응기로는 토양이 담긴 100 mL 갈색유리병을 사용하였다. 암모니아 제거에 필요한 질산화 박테리아가 포함된 토양은 전주시 덕진연못에서 채취하였다(Kang and Jeen, 2021). 오염에 취약한 토양의 표면은 걷어낸 후에 10 cm 이내로 토양을 채취하였으며, 실험에 쓰인 모든 토양은 2 mm 채에서 협잡물을 제거하여 사용하였다. 건식수분함량 측정법을 이용하여 토양의 수분함량을 측정하였고 측정된 토양의 수분함량은 16.1%이었다. 준비된 실험용액은 토양과 혼합 후 진탕기(shaker)(Hanbaek, Korea)에서 반응시켰고, 진탕기 내부 온도와 회전수는 각각 20oC와 90 rpm이었다. 1차 및 2차 배치실험의 총 반응 시간은 각각 168시간과 84시간이고, 각각 24시간과 12시간 마다 샘플링하여 분석하였다. 모든 실험은 각 시간당 3배수(triplicate)의 시료를 준비하였으며, 해석에는 3배수 시료의 평균값과 표준편차를 사용하였다.
2.2. 실험 용액 및 토양
Table 1은 배치실험에서 사용된 실험용액의 성분 및 농도와 토양의 종류를 보여준다. 1차 배치실험에서는 자연 토양을 이용한 암모니아의 저감 유무를 관찰하기 위해 토양의 유무에 따른 실험군과 대조군 실험을 실시하였다. 실험군 1A는 토양과 실험용액이 포함되어 암모니아 제거를 살펴보기 위해 준비되었고, 대조군 1B는 암모니아의 휘발양을 파악하고자 토양을 포함시키지 않았다. 폐수 내 암모니아성 질소의 농도는 최소 50 mg L-1에서 최대 500 mg L-1까지 보고되고 있다(Chiu et al., 2007; Hasanoðlu, 2010; Kargi and Pamukoglu, 2003; Wang et al., 2012). 이번 연구에서는 이전 연구에서 최소 농도로 검출된 암모니아성 질소의 농도 범위 내에서 인공 폐수를 제조하였다. 박테리아 활동에 필요한 영양분인 탄소와 인을 각각 구연산염(citrate)과 인산염(PO43-) 형태로 공급하였다. 또한 박테리아 활동에 적합한 중성의 pH를 유지하기 위해 중탄산염(HCO3-) 형태로 알칼리도를 보충하였다(Lee et al., 2002). 1차 배치실험의 용액에서의 암모니아성 질소, 인산염, 구연산염, 그리고 중탄산염의 농도는 각각 50.0 mg L-1, 2.7 mg L-1, 3041.1 mg L-1, 그리고 54.6 mg L-1이었다(Table 1).
고농도로 오염된 폐수에서의 제거 가능성을 평가하고자 2차 배치실험에서는 1차 배치실험(50 mg L-1 NH3-N) 보다 2배 높은 고농도(100 mg L-1 NH3-N)의 암모니아를 사용하였다. 2차 배치실험에서 실험군 2A와 대조군 2B는 1차 배치실험과 마찬가지로 토양이 포함되거나(2A) 포함되지 않았다(2B). 또한 2차 배치실험에서는 토양에 흡착되는 암모니아의 양을 파악하고자 박테리아 활동을 제어하기 위해 구연산염을 포함하지 않은 용액과 멸균시킨 토양을 혼합한 실험군 2C를 추가하였다. 2차 배치실험의 용액에서 암모니아성 질소, 인산염, 구연산염, 그리고 중탄산염의 농도는 각각 100.0 mg L-1, 83.0 mg L-1, 2667.1 mg L-1, 그리고 2011.1 mg L-1이었다. 1차 배치실험에서 빨리 소모되었던 산소의 공급을 위해 2차 배치실험에서는 12시간마다 뚜껑을 개방하여 산소를 공급하였다.
암모니아는 염화암모늄(Sigma-Aldrich, USA) 시약을 사용하였고, 인산염은 인산수소이칼륨(Sigma-Aldrich, USA)시약을 사용하여 제조하였다. 중탄산염과 구연산염은 각각 탄산수소나트륨(Duksan, Korea) 시약과 시트르산나트륨(Shinyo Co., Japan) 시약을 사용하여 제조하였다.
2.3. 분석 방법
공기 중 산소에 의한 영향을 최소화 하고자 샘플링 직후 5분 이내로 용존산소(dissolved oxygen; DO)를 측정하였고, 이후 pH, 산화-환원 전위(oxidation-reduction potential; ORP), 알칼리도(alkalinity)를 측정하였다. 음이온 분석을 위한 시료는 0.45 μm cellulose acetate(CA) 시린지 필터(Hyundai Micro, Korea)를 이용하여 여과하여 4oC 이하에서 다음 분석 때까지 냉장보관 하였다.
용존산소는 Orion VERSA STAR Advanced Electroche- mistry Meter(Thermo Fisher Scientific, USA)를 이용하여 측정하였으며, pH와 산화-환원 전위는 Orion STAR A215 pH/Conductivity Meter(Thermo Fisher Scientific, USA)를 이용하여 측정하였다. pH는 pH 4.01, 7.00, 10.01 완충용액으로 보정하였고, 산화-환원 전위는 ZoBell’s solution으로 보정 후 Eh 값으로 환산하였다. 알칼리도는 디지털 적정기(Hach Co., USA)를 이용하여 pH 4.5가 될 때까지 0.16 N 황산(H2SO4)을 적정하였으며, 적정된 황산의 양을 통해 알칼리도를 계산하였다. 측정된 알칼리도는 mg L-1 as CaCO3 값으로 환산하였다.
음이온(NO3-와 NO2-)은 이온 크로마토그래피(Thermo Fisher Scientific, USA)를 이용하여 분석하였으며 CHRO- MELEON 소프트웨어를 이용하여 시각화하였다. Dionex AS14 Eluent(Thermo Fisher Scientific, USA)와 Dionex Seven Anion Standard II(Thermo Fisher Scientific, USA)를 이용하였다. 질산염과 아질산염 농도에 대한 검정곡선의 결정계수(R2)는 모두 0.99 이상이었다. 질산염과 아질산염의 방법검출한계(method detection limit; MDL)는 각각 0.03 mg L-1와 0.02 mg L-1이었다. 암모니아성 질소는 인도페놀법에 따라 자외선-가시광선 분광광도계(PG instruments, UK)를 이용하여 흡광도를 측정 후 농도 값으로 환산하였다(Rice et al., 2012). 암모니아성 질소의 농도에 대한 검정곡선의 결정계수(R2)는 0.99 이상이었다. 암모니아성 질소의 방법검출한계는 0.04 mg L-1, 정량한계(limit of quantification; LOQ)는 0.13 mg L-1, 정밀도는 12.6%, 정확도는 101.0%이었다. 정밀도가 ± 25% 이내이며, 정확도가 75%에서 125% 사이의 값으로 나타나 분석을 신뢰할 수 있는 것으로 판단된다(ME, 2017).
암모니아 제거에 관여하는 박테리아 동정을 위해 1차 배치실험의 토양만으로 박테리아 분석을 수행하였으며, 분석에는 실험 후 각각 12시간과 96시간이 경과한 토양 시료를 사용하였다. ChunLab(Seoul, Korea)에서 16S rRNA gene의 pyrosequencing 분석을 통해 박테리아를 분석하였고, 데이터 시각화를 위해 CLcommunity 소프트웨어를 사용하여 주어진 박테리아 군집 내에서 종을 식별하고 정량화하였다. 질산화 과정에 의한 암모니아의 제거를 다룬 이전 연구에서 문(phylum) 단위를 주로 평가하였기에 이번 연구에서도 교토 유전자 및 게놈 백과사전(KEGG; https://www.genome.jp/kegg-bin/show_pathway?map00910 +M00804)을 기반으로 문 단위를 위주로 질산화 박테리아를 분류하였다.
3.1. 지화학 인자 변화
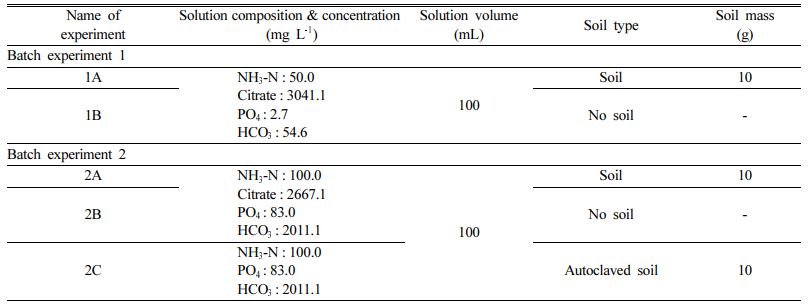
Fig. 1은 두 배치실험에서 시간에 따른 pH 변화를 나타낸다. 두 배치실험에서 모두 pH가 시간에 따라 중성의 범위 내에서 유지되었다. 1차 배치실험에서 pH는 최소 6.9에서 최대 8.2까지의 범위를 보여주며(Fig. 1a), 2차 배치실험에서는 최소 8.1에서 최대 8.7 사이에서 pH가 변화하였다(Fig. 1b). 결과 범위 내에서 pH의 값이 일정한 것은 실험 용액 내 중탄산염의 완충능력 때문인 것으로 판단된다. 일반적으로 박테리아의 성장에 있어 최적의 pH는 6.5에서 7.5 사이이며 pH 5 이하 또는 pH 9 이상에서는 박테리아가 성장하기 어렵다(Amna et al., 2007). 모든 시료의 pH가 6.9에서 8.9 사이의 범위에서 일정한 것으로 보아, 이는 질산화 박테리아가 원활하게 활동하기 적합한 환경이 조성되었음을 시사한다.
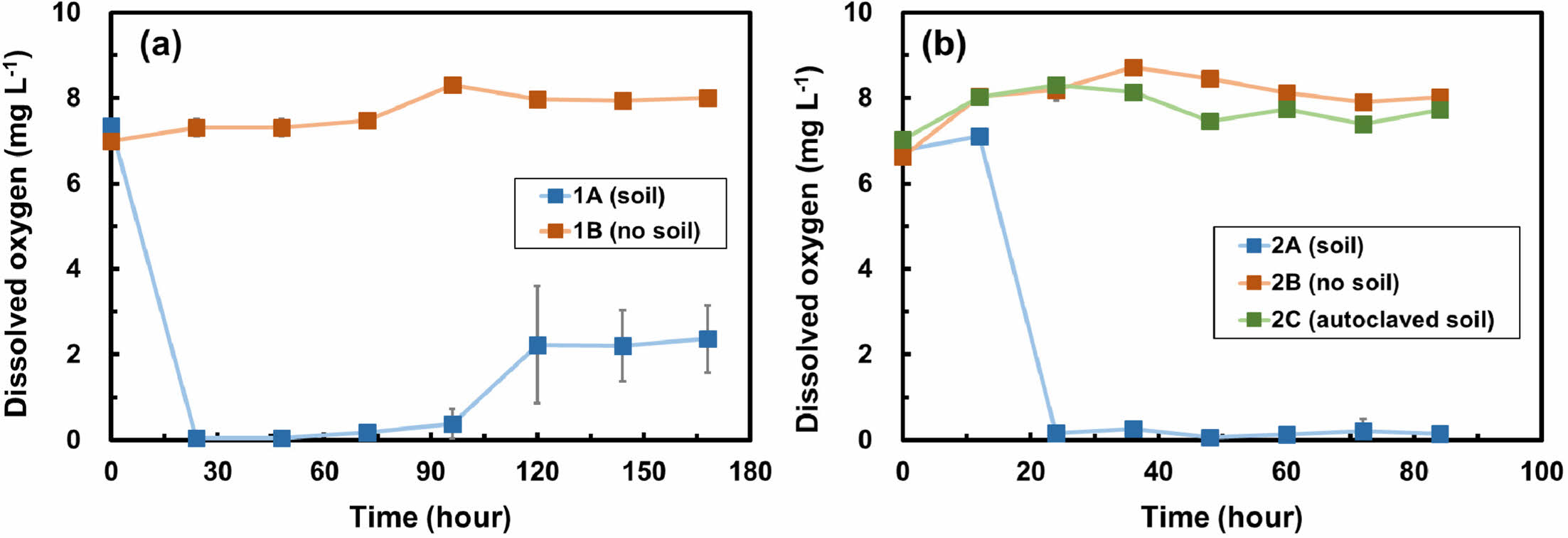
Fig. 2는 두 배치실험에서 시간에 따른 용존산소 변화량을 보여준다. 1차 배치실험에서는 질산화 박테리아가 포함된 토양의 유무에 따라 용존산소의 변화양상이 뚜렷한 차이를 보였으며, 토양이 포함된 실험군(1A)에서는 용존산소가 24시간 이내에 초기 7.3 mg L-1에서 0.1 mg L-1의 값으로 감소하였다(Fig 2a). 반면, 토양이 포함되지 않은 대조군(1B)에서는 용존산소가 최소 7.0 mg L-1에서 최대 8.3 mg L-1 범위에서 유지되었다. 박테리아가 포함되지 않은 대조군에서는 용존산소가 유지되었고 박테리아가 포함되어 있는 실험군(1A)에서는 24시간 동안 용존산소가 감소되었다는 사실은 질산화 박테리아가 산소를 소모하여 암모니아를 분해했음을 지시한다. 1차 배치실험에서처럼 공기와 완전히 차단된 환경이 아닌 산소를 지속적으로 공급해줄 수 있는 환경을 만들어주었다면 암모니아의 분해가 지속적으로 일어날 수 있었을 것으로 판단되었다. 한편, 96시간 경과 후 토양이 포함된 실험군(1A)에서 용존산소가 증가하였는데 이는 측정과정 중 산소와의 접촉으로 인한 인위적 환경 조성 때문인 것으로 판단된다.
2차 배치실험에서는 토양이 포함된 실험군(2A)에서 용존산소가 24시간 이내에 7.1 mg L-1에서 0.2 mg L-1까지 감소하였다(Fig. 2b). 이는 산소가 질산화 박테리아에 의해 소모되었기 때문인 것으로 판단된다. 토양이 포함되지 않은 대조군(2B)과 멸균 토양이 포함된 실험군(2C)의 용존산소는 최소 6.6 mg L-1에서 최대 8.7 mg L-1 사이의 범위에서 유지되었다(Fig. 2b). 멸균 토양이 포함된 실험군(2C)에서는 질산화 박테리아가 사용하는 탄소원인 구연산염도 포함되어 있지 않았기 때문에 박테리아의 활동이 거의 억제된 것으로 보인다. 한편, 2차 배치실험에서는 1차 배치실험과 다르게 실험 용액 내 지속적인 산소공급을 위해 뚜껑을 12시간마다 5분씩 개방하였다. 하지만 24시간 이후에도 여전이 낮은 용존산소의 농도를 보여주는데, 이는 실험 조건에서 대기 중의 산소가 실험 용액에 공급되기까지 시간이 충분하지 않았기 때문인 것으로 보인다.
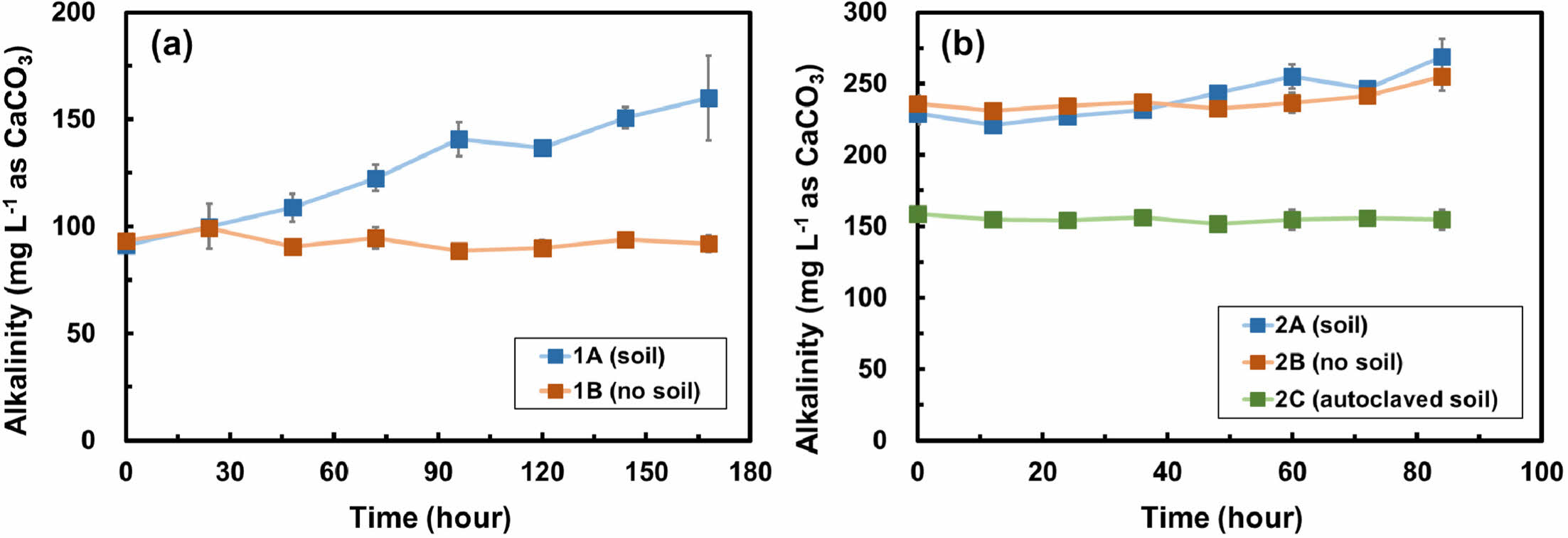
Fig. 3은 두 배치실험에서 시간에 따른 알칼리도의 변화를 보여준다. 1차 배치실험에서 알칼리도는 토양 유무에 따라 다른 양상을 보여주는데, 토양이 포함된 실험군(1A)에서는 168시간 동안 알칼리도가 91.3 mg L-1 as CaCO3에서 160.0 mg L-1 as CaCO3까지 지속적으로 증가하였다(Fig. 3a). 반면, 토양이 포함되지 않은 대조군(1B)에서는 알칼리도가 최소 88.7 mg L-1 as CaCO3에서 최대 99.3 mg L-1 as CaCO3의 범위 내에서 유지되었다. 구연산염의 생분해 과정은 식 (3)과 같이 표현되며 이 과정에서 중탄산염이 생성된다(Szecsody et al., 2007):
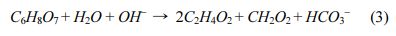
토양이 포함된 실험군(1A)에서 알칼리도가 증가하는 것으로 보아, 질산화 박테리아에 의한 구연산염의 생분해 과정에서 중탄산염이 형성되었을 것으로 유추된다.
2차 배치실험에서는 박테리아 활동을 억제하기 위한 멸균 토양이 추가되었으며, 박테리아의 활동 유무에 따라 알칼리도의 양상이 변화하는 것을 볼 수 있다. 질산화 박테리아가 존재하는 토양이 포함된 실험군(2A)의 알칼리도는 221.1 mg L-1 as CaCO3에서 268.8 mg L-1 as CaCO3까지 증가하였으며, 이는 토양 내 질산화 박테리아에 의한 구연산염 생분해에 따른 결과인 것으로 판단된다. 반면, 박테리아 활동이 없는 대조군(2B)과 멸균 토양이 포함된 실험군(2C)의 알칼리도는 각각 최소 230.8 mg L-1as CaCO3에서 최대 254.9 mg L-1 as CaCO3의 범위와 최소 151.8 mg L-1 as CaCO3에서 158.9 mg L-1 as CaCO3의 범위에서 유지되었으며, 이는 멸균 토양의 박테리아 활동이 억제되었음을 보여준다.
3.2. 암모니아 제거
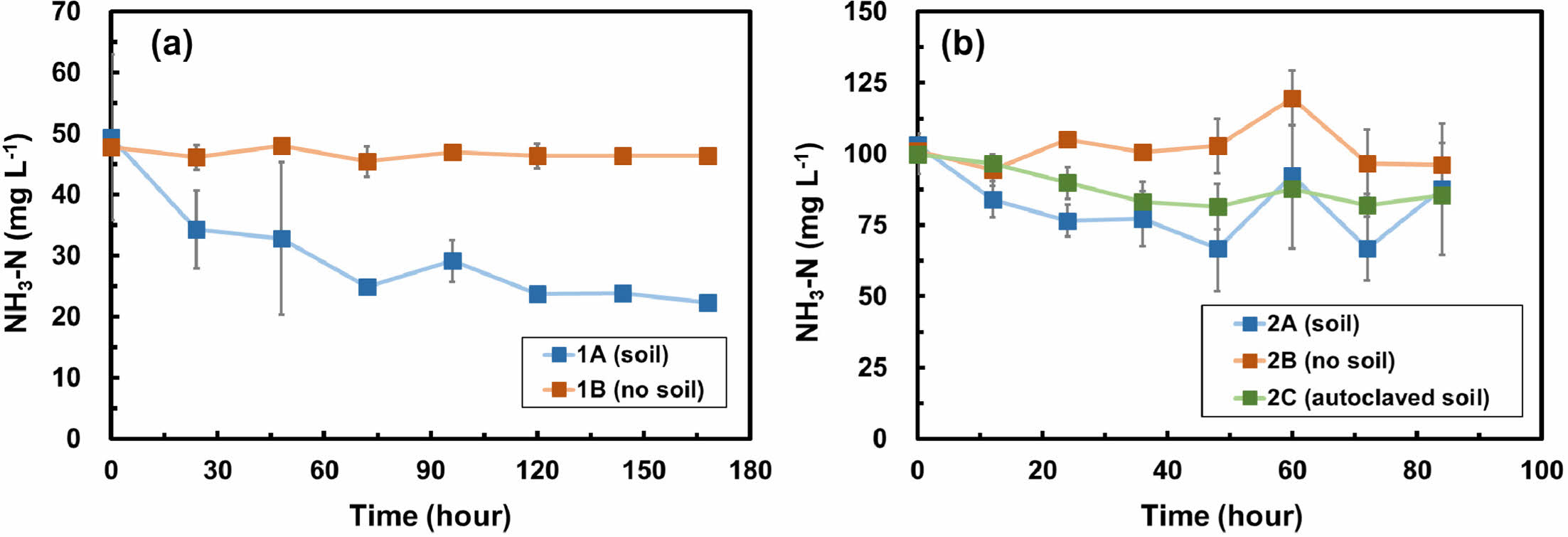
Fig. 4는 두 배치실험에서 시간에 따른 암모니아성 질소의 농도변화를 보여준다. 1차 배치실험에서 토양이 포함된 실험군(1A)에서는 72시간 동안 암모니아성 질소가 49.5 mg L-1에서 24.9 mg L-1까지 감소하였으며, 암모니아의 제거율은 0.3 mg L-1 hr-1이었다(Fig. 4a). 반면, 토양이 포함되지 않은 대조군(1B)의 암모니아성 질소는 최소 45.4 mg L-1에서 최대 48.0 mg L-1의 범위 내에서 유지되었으며, 이는 공기 중으로의 암모니아 휘발이 일어나지 않았음을 나타낸다. 2차 배치실험에서 질산화 박테리아가 활동하는 토양이 포함된 실험군(2A)에서 48시간 동안 암모니아성 질소는 103.2 mg L-1에서 66.9 mg L-1까지 감소하였으며, 암모니아의 제거율은 0.8 mg L-1 hr-1이었다(Fig. 4b). 반면, 토양이 포함되지 않은 대조군(2B)의 암모니아성 질소는 각각 최소 94.4 mg L-1에서 최대 119.8 mg L-1의 범위에 있었다. 토양이 포함되지 않은 대조군(2B)에 비해 토양이 포함된 실험군(2A)에서 암모니아가 제거되는 것으로 보아, 지속적인 산소 공급이 가능하다면 자연 토양에 의한 암모니아의 저감양은 보다 늘어날 것으로 판단된다. 한편, 멸균 토양이 포함된 실험군(2C)의 암모니아성 질소 농도는 초기 100.0 mg L-1에서 최소 81.5 mg L-1까지 감소하였으며, 48시간 동안 암모니아의 감소율은 0.4 mg L-1 hr-1이었다. 실험군(2C)에서 박테리아 활동을 억제하기 위해 고온/고압 상태로 토양을 멸균하였지만 토양에는 내성포자를 가진 미생물들이 많아서 멸균이 제대로 이루어지지 않았을 가능성이 있다. 따라서 실험군(2A)에서는 주로 박테리아의 활동에 의해 암모니아가 제거된 반면, 실험군(2C)에서는 주로 흡착에 의해 제거되었을 것으로 생각되나 박테리아의 활동을 배제할 수는 없을 것으로 판단된다.
암모니아의 질산화 과정은 대체로 0차(zero-order) 또는 1차 반응 속도식(first-order reaction rate equation)을 따른다. 이번 연구에서는 암모니아의 제거에 대한 반응속도 상수를 0차와 1차 반응속도식에 따라 계산하였고, 1차 반응식의 R2 값이 >0.84으로 0차 반응식의 R2 값 >0.79보다 상대적으로 높게 나온 것으로 나타나 1차 반응식을 채택하였다. 1차 배치실험에서는 72시간 동안, 2차 배치실험에서는 48시간 동안의 반응속도 상수를 계산하였다. 1차 반응식은 식 (4)와 같다:

여기서 Ct는 시간 t일 때의 암모니아성 질소의 농도(mg L-1)이고, C0는 초기 암모니아성 질소의 농도(mg L-1)이다. k는 1차 반응식에서의 반응속도 상수(hr-1)이고, t는 시간(hr)이다.
이번 연구에서 계산된 암모니아 제거에 대한 반응속도 상수는 1차 및 2차 배치실험에서 모두 0.01 hr-1 (R2는 각각 0.91과 0.84)이었고, 이는 박테리아의 활동과 토양으로의 흡착을 모두 고려하여 계산된 값이다. Wang et al. (2012)은 박테리아와 지렁이를 이용하여 합성폐수 내 암모니아를 생물학적으로 처리하였고, 계산된 반응속도 상수는 0.03에서 0.24 hr-1이었다. 한편, 활성슬러지에 존재하는 박테리아를 이용하여 합성폐수 내 암모니아를 제거한 Kargi and Pamukoglu(2003)에서 제시된 반응속도 상수는 0.04 hr-1이었다. Zhao et al.(2007)는 사암으로부터 기원된 토양을 이용하여 암모니아를 질산화 과정을 통해 제거하였고, Chiu et al.(2007)에서는 질산화 및 탈질화가 동시에 일어나는 박테리아 생물막 공정을 이용하여 합성폐수 내 암모니아를 호기적으로 질소 가스로 변환하였다. 두 선행연구에서 계산된 반응속도 상수는 모두 0.01 hr-1이었다. 따라서 이번 연구에서의 반응속도 상수는 비슷한 선행연구의 값들과 대체로 비슷한 수준이라고 평가할 수 있다. 하지만 선행연구에서는 질산화에 특화된 박테리아를 집중적으로 접종시켜주었지만 이번 연구에서는 토양에 자연적으로 존재하는 박테리아를 이용하여 암모니아를 제거하였다. 또한, 선행연구에서 사용된 암모니아성 질소(NH3-N)의 농도는 60 mg L-1 이하인 반면, 이번 연구에서의 암모니아성 질소의 농도는 100 mg L-1로 보다 고농도의 암모니아를 제거할 수 있음을 보여주었다. 따라서 이번 연구에서의 암모니아의 제거 수준은 암모니아가 고농도로 포함된 축산폐수 등을 자연적 기작으로도 저감할 수 있음을 보여준다.
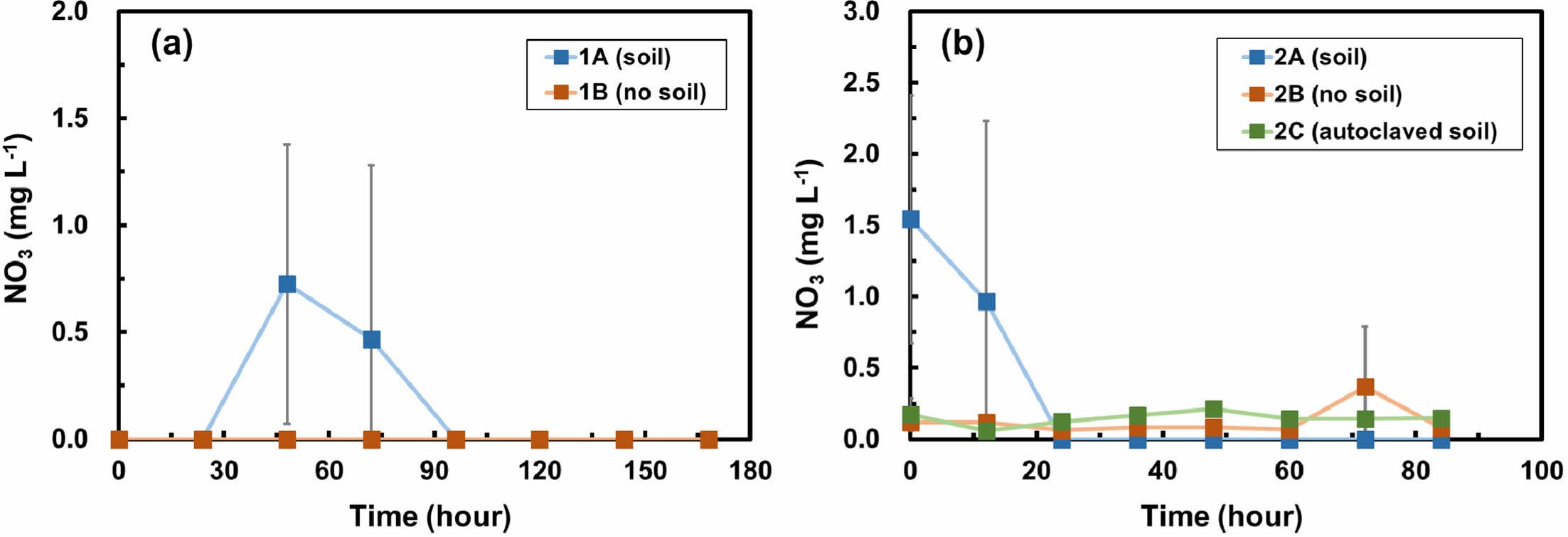
Fig. 5는 각각 두 배치실험에서의 질산염 농도의 시간에 따른 변화를 보여준다. 1차 배치실험에서 토양이 포함된 실험군(1A)의 질산염의 농도는 48시간 동안 0.7 mg L-1까지 증가하였고 이후 감소하였다(Fig. 5a). 질산염의 검출은 암모니아가 분해되어 중간산물인 아질산염을 거쳐 최종산물인 질산염이 되는 질산화 과정을 지시한다. 동일한 시료에서 아질산염은 검출한계 이하로 분석되었으며, 빠른 질산화 과정으로 인해 아질산염을 검출되지 못한 것으로 생각된다. 24시간 이후에는 용존산소가 고갈된 혐기성 환경이 조성되어 질산염이 탈질 과정에 의해 질소가스로 변환된 것으로 보인다. 한편, 토양이 포함되지 않은 대조군(1B)에서는 질산염과 아질산염이 모두 검출한계 이하로 분석되었다.
2차 배치실험에서 토양이 포함되지 않은 대조군(2B)과 멸균 토양이 포함된 실험군(2C)의 질산염 농도는 각각 0.4 mg L-1과 0.2 mg L-1 이하로 검출되었고(Fig. 5b), 아질산염은 검출되지 않았다. 한편, 토양이 포함된 실험군(2A)의 질산염 농도는 초기 1.5 mg L-1에서 검출한계 이하까지 감소하였고(Fig. 5b), 아질산염은 검출한계 이하로 분석되었다. 실험군(2A)의 초기에 검출된 질산염은 토양에 있던 질산염이 용출된 것으로 보인다. 2차 배치실험에서는 1차 배치실험과 다르게 일정 시간 간격으로 뚜껑을 개방하여 산소를 지속적으로 제공하였다. 하지만 산소 공급량이 질산화 박테리아의 산소 소비량에 비해 부족하였기 때문에 용존산소가 고갈되었고, 혐기성 환경이 조성되어 질산염이 탈질과정에 의해 감소된 것으로 보인다. 제거된 암모니아의 양만큼 질산염과 아질산염이 생성되지 않았다는 사실은 암모니아의 일부는 단순히 토양에 의한 흡착으로 제거가 되었으며, 또한 탈질과정의 속도가 질산화에 따른 질산염의 생성속도보다 빠름을 지시한다.
3.3. 박테리아 동정
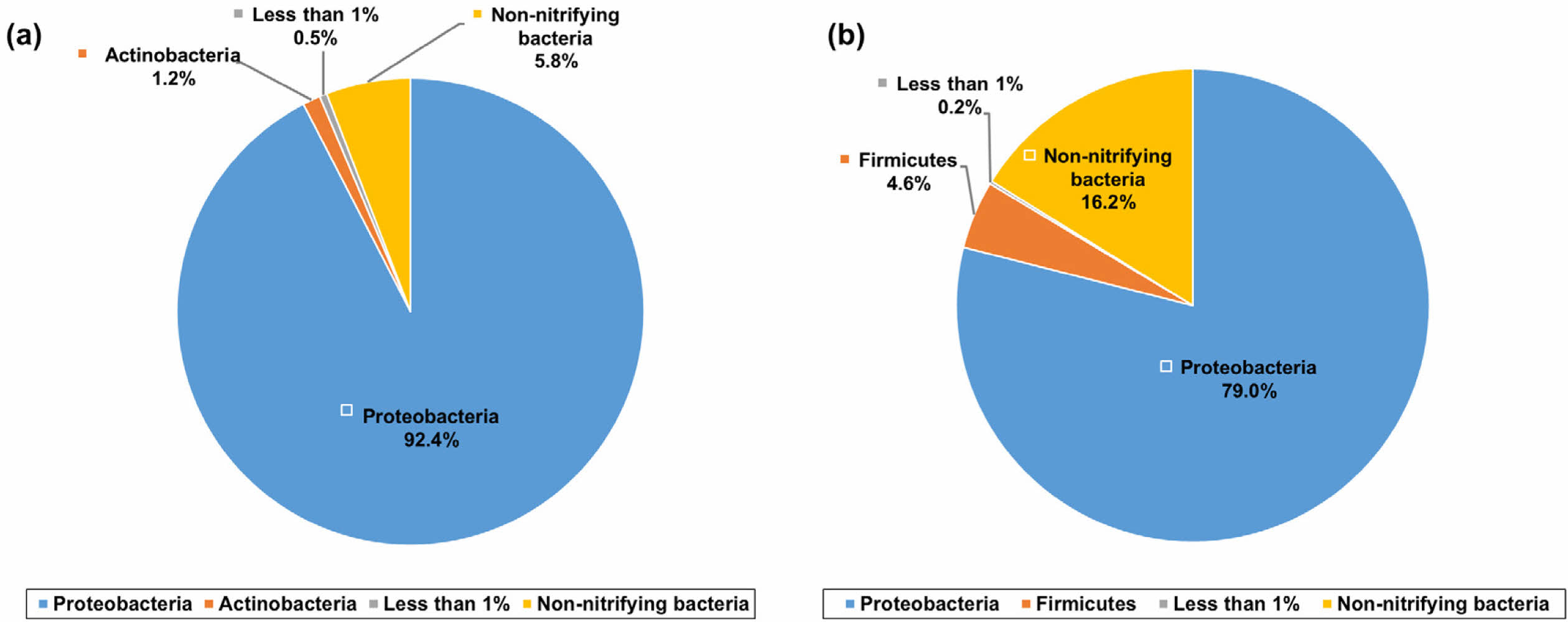
Fig. 6은 배치실험에 사용된 토양 내 문(phylum) 단위에서의 박테리아 함량을 보여준다. 박테리아의 질산화 활동이 가장 활발하다고 판단된 12시간 경과 후 토양 내 풍부한 박테리아는 Proteobacteria 문과 Actinobacteria 문이었고, 그 함량은 각각 92.4%와 1.2%이었다(Fig. 6a). 한편, 토양 내 질산화 박테리아가 아닌 박테리아의 함량은 약 5.8%이었다. 이후 96시간이 경과한 토양 내 가장 풍부한 질산화 박테리아는 Proteobacteria 문(79.0%)과 Firmicutes 문(4.6%)이었고, 질산화 과정에 관여하지 않은 박테리아의 함량은 약 16.2%이었다(Fig. 6b).
질산화 과정은 암모니아에서 아질산염을 거쳐 최종적으로 질산염으로 산화되는 두 단계의 과정이며, 각각의 단계에 참여하는 박테리아는 다르다. 토양에서 우세한 박테리아 중 Proteobacteria 문은 두 단계 모두 참여하는 박테리아인 반면, 12시간이 경과된 토양에서 풍부하게 발견된 Actinobacteria 문은 암모니아에서 아질산염으로 산화되는 과정에 참여하는 박테리아로 알려져 있다(Chain et al., 2003). Proteobacteria 문, Actinobacteria 문, 그리고 Firmicutes 문은 질산화 및 탈질 과정에 모두 관여하는 박테리아로 알려져 있으며(Yang et al., 2020), 특히 Firmicutes 문은 주로 탈질화 과정을 담당한다고 알려져 있다(Zhao et al., 2021). 생물 반응기 내 질산화와 탈질화 과정을 박테리아 군집 변화를 통해 연구한 Zhuang et al.(2020)에서 Proteobacteria 문은 줄어든 반면 탈질화가 진행되면서 Firmicutes 문이 증가하였는데, 이는 이번 연구의 박테리아 군집 변화와 유사하였다. 이는 질산화 과정에 의해 암모니아가 분해되고 탈질 과정에 의해 질산염이 변환되었음을 지시한다. 질산화 과정에 관여하지 않는 박테리아의 함량이 12시간 경과 후 5.8%였고 이후 96시간에 16.2%로 증가하였다. 이는 산소가 고갈됨에 따라 혐기성 환경이 조성되어 탈질화 과정이 활성 되었음을 나타낸다.
한편 반응 24시간 경과 후 시료 내 용존산소가 고갈되었음에도 불구하고 암모니아는 제거되었는데(Fig. 2 and Fig. 4), 이는 혐기성 암모늄 산화(anaerobic ammonium oxi- dation, Anammox) 과정의 가능성을 시사한다. Anammox 과정에 참여하는 대표적인 박테리아는 Planctomycetota 문이며(Wiegand et al., 2018), 실험에서 사용된 토양 내 Planctomycetota 문의 함량은 0.07%이었다. 하지만 토양 내 박테리아를 분석한 1차 배치실험에서 24시간 동안의 암모니아 감소율은 0.6 mg L-1 hr-1이었으며, 이후 144시간 동안의 암모니아 감소율은 0.1 mg L-1 hr-1이었다. 이는 질산화 박테리아에 의한 암모니아의 제거 효율이 더 높으며 가장 주요한 암모니아 제거 기작이라는 것을 지시한다.
|
Fig. 1 pH changes over time in (a) batch experiment 1 and (b) batch experiment 2. Error bars represent the standard deviations of triplicate samples. Most data symbols are larger than the error bars. |
|
Fig. 2 Dissolved oxygen (DO) changes over time in (a) batch experiment 1 and (b) batch experiment 2. Error bars represent the standard deviations of triplicate samples. Most data symbols are larger than the error bars. |
|
Fig. 3 Alkalinity changes over time in (a) batch experiment 1 and (b) batch experiment 2. Error bars represent the standard deviations of triplicate samples. Most data symbols are larger than the error bars. Note that the scales for two figures are different. |
|
Fig. 4 Ammonia-nitrogen (NH3-N) concentration over time in (a) batch experiment 1 and (b) batch experiment 2. Error bars represent the standard deviations of triplicate samples. Most data symbols are larger than the error bars. Note that the scales for two figures are different. |
|
Fig. 5 Nitrate (NO3) concentration over time in (a) batch experiment 1 and (b) batch experiment 2. Error bars represent the standard deviations of triplicate samples. Most data symbols are larger than the error bars. Note that the scales for two figures are different. |
|
Fig. 6 The percentages of bacterial phylum in the soil after (a) 12 hour and (b) 96 hour |
이번 연구에서는 실내 배치실험을 통해 자연 토양 내 박테리아를 이용하여 암모니아 제거 기작을 이해하고 제거 효율을 평가하고자 하였다. 배치실험 결과, 토양 내 질산화 박테리아에 의해 암모니아가 제거되었고, 토양이 포함되지 않은 대조군에서는 암모니아의 농도가 변화하지 않았다. 암모니아는 질산화 과정에 의해 제거되었으며, 이 후 혐기성 환경이 조성되어 질산화 과정에서 형성된 질산염 역시 탈질 과정으로 제거되었다. 혐기성 암모니아의 산화 과정에 의하여 암모니아가 제거되었을 가능성도 있지만, 질산화 과정에 의한 제거에 비하면 그 양은 미미한 것으로 판단된다. 또한 토양으로의 흡착에 의해서도 암모니아가 일부 제거되었음을 보여주었다. 이번 연구에서는 질산화 과정에 필요한 산소가 지속적으로 공급되지 않았음에도 불구하고 암모니아가 제거되었으며, 지속적인 산소공급이 이루어지는 상황에서는 암모니아의 제거 능력이 더욱 향상될 가능성이 있음을 보여준다. 이번 연구에서 평가된 암모니아 제거에 대한 반응속도와 고농도 암모니아의 제거 효율은 이 실험 조건과 비슷한 실제 환경(즉, 고농도 암모니아가 함유된 축산폐수 등)에서의 적용 가능성을 시사한다. 따라서 연구결과는 자연토양을 활용한 축산폐수 내 암모니아의 저감 기법 개발에 기여할 수 있을 것으로 생각된다.
이 연구는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행되었습니다(NRF-2019R1A2C 1086667).
- 1. Amna, Q., Ambrina, Q., Hina, Q., and Ayyaz A.K., 2007, Blood glucose level, salivary pH and oral bacterial count in type 1 diabetic children, Infect. Dis. J. Pakistan, 16(2), 45-48.
- 2. Cai, Y., Tang, R., Tian, L., and Chang, S.X., 2021, Environmental impacts of livestock excreta under increasing livestock production and management considerations: Implications for developing countries, Curr. Opin. Environ. Sci. Health, 24, 100300.
-

- 3. Chain, P., Lamerdin, J., Larimer, F., Regala, W., Lao, V., Land, M., Hauser, L., Hooper, A., Klotz, M., Norton, J., Sayavedra-Soto, L., Arciero, D., Hommes, N., Whittaker, M., and Arp, D., 2003, Complete genome sequence of the ammonia-oxidizing bacterium and obligate chemolithoautotroph Nitrosomonas europaea, J. Bacteriol., 185(9), 2759-2773.
-

- 4. Cheung, K.C., Poon, B.H.T., Lan, C.Y., and Wong, M.H., 2003, Assessment of metal and nutrient concentrations in river water and sediment collected from the cities in the Pearl River Delta, South China, Chemosphere, 52(9), 1431-1440.
-

- 5. Chiu, Y.C., Lee, L.L., Chang, C.N., and Chao, A.C., 2007, Control of carbon and ammonium ratio for simultaneous nitrification and denitrification in a sequencing batch bioreactor, Int. Biodeterior. Biodegradation, 59(1), 1-7.
-

- 6. Chu, H., Fujii, T., Morimoto, S., Lin, X., and Yagi, K., 2008, Population size and specific nitrification potential of soil ammonia-oxidizing bacteria under long-term fertilizer management, Soil Biol. Biochem., 40(7), 1960-1963.
-

- 7. Duan, S., Zhang, Y., and Zheng, S., 2022, Heterotrophic nitrifying bacteria in wastewater biological nitrogen removal systems: A review, Crit. Rev. Environ. Sci. Technol., 52(13), 2302-2338.
-

- 8. Glibert, P.M., 2017, Eutrophication, harmful algae and biodiversity-Challenging paradigms in a world of complex nutrient changes, Mar. Pollut. Bull., 124(2), 591-606.
-

- 9. Hasanoğlu, A., Romero, J., Pérez, B., and Plaza, A., 2010, Ammonia removal from wastewater streams through membrane contactors: Experimental and theoretical analysis of operation parameters and configuration, Chem. Eng. J., 160(2), 530-537.
-

- 10. Howarth, R.W., Sharpley, A., and Walker, D., 2002, Sources of nutrient pollution to coastal waters in the United States: Implications for achieving coastal water quality goals, Estuaries, 25(4), 656-676.
-

- 11. Islam, A., Chen, D., and White, R.E., 2007, Heterotrophic and autotrophic nitrification in two acid pasture soils, Soil Biol. Biochem., 39(4), 972-975.
-

- 12. Kang, J. and Jeen, S.-W., 2021, Simultaneous removal of nitrate and phosphate in groundwater using Ca-citrate complex, Environ. Sci. Pollut. Res., 28, 35738-35750.
-

- 13. Kargi, F. and Pamukoglu, M.Y., 2003, Aerobic biological treatment of pre-treated landfill leachate by fed-batch operation, Enzyme Microb. Technol., 33(5), 588-595.
-

- 14. Kim, H.R., Yu, S., Oh, J., Kim, K.H., Lee, J.H., Moniruzzaman, M., Kim, H.K., and Yun, S.T., 2019, Nitrate contamination and subsequent hydrogeochemical processes of shallow groundwater in agro-livestock farming districts in South Korea, Agric. Ecosyst. Environ., 273, 50-61.
-

- 15. Lee, C.-K., 2007, Basic study and patent analysis of electrochemical denitrification from industrial wastewater, Resour. Recy., 16(6), 52-60.
- 16. Lee, J.-H., Kim, B.-J., Kim, Y.-H., Yi, G.-B., Lim, J.-H., Cheon, J.-K., and Suh, K.-H., 2002, Advanced Wastewater Treatment of Low Concentration Ammonia Using the Immobilized Nitrifier Consortium, Korean Chem. Eng. Res., 40(6), 763-768.
- 17. Li, Z., Zeng, Z., Tian, D., Wang, J., Fu, Z., Zhang, F., Zhang, R., Chen, W., Luo, Y., and Niu, S., 2020, Global patterns and controlling factors of soil nitrification rate, Glob. Chang. Biol., 26(7), 4147-4157.
-

- 18. Lim, J.H., Cha, J.S., Kong, B.J., and Baek, S.H., 2018, Characterization of odorous gases at landfill site and in surrounding areas, J. Environl. Manage., 206, 291-303.
-

- 19. Lovarelli, D., Conti, C., Finzi, A., Bacenetti, J., and Guarino, M., 2020, Describing the trend of ammonia, particulate matter and nitrogen oxides: The role of livestock activities in northern Italy during Covid-19 quarantine, Environ. Res., 191, 110048.
-

- 20. Ministry of Environment(ME), 2017, Ministry of Environment Notification No. 2017-57 (2017.12.22), Republic of Korea.
- 21. Qin, H., Yuan, H., Zhang, H., Zhu, Y., Yin, C., Tan, Z., Wu, J., and Wei, W., 2013, Ammonia-oxidizing archaea are more important than ammonia-oxidizing bacteria in nitrification and NO3−-N loss in acidic soil of sloped land, Biol. Fertil. Soils, 49(6), 767-776.
-

- 22. Rice, E.W., Baird, R.B., Eaton, A.D., and Clesceri, L.S., 2012, Standard Methods for the Examination of Water and Wastewater, 22nd edition, American Public Health Association (APHA), American Water Works Association (AWWA), Water Environment Federation (WEF), U.S.
- 23. Spalding, R.F. and Exner, M.E., 1993, Occurrence of nitrate in groundwater-A review, J. Environ. Qual., 22(3), 392-402.
-

- 24. Sprynskyy, M., Lebedynets, M., Zbytniewski, R., Namieśnik, J., and Buszewski, B., 2005, Ammonium removal from aqueous solution by natural zeolite, Transcarpathian mordenite, kinetics, equilibrium and column tests, Sep. Purif. Technol., 46(3), 155-160.
-

- 25. Szecsody, J., Burns, C., Moore, R., Fruchter, J., Vermeul, V., Williams, M., Girvin, D., McKinley, J., Truex, M., and Phillips, J., 2007, Hanford 100-N area apatite emplacement: laboratory results of Ca-Citrate-PO4 solution injection and Sr-90 immobilization in 100-n sediments, Pacific Northwest National Lab. (PNNL), Richland, Wash.
-

- 26. Van Hulle, S.W., Vandeweyer, H.J., Meesschaert, B.D., Vanrolleghem, P.A., Dejans, P., and Dumoulin, A., 2010, Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams, Chem. Eng. J., 162(1), 1-20.
-

- 27. Wang, L., Luo, X., Zhang, Y., Chao, J., Gao, Y., Zhang, J., and Zheng, Z., 2013, Community analysis of ammonia-oxidizing Betaproteobacteria at different seasons in microbial-earthworm ecofilters, Ecol. Eng., 51, 1-9.
-

- 28. Whitnall, T. and Pitts, N., 2019, Global trends in meat consumption, Agric. Commod. 9(1), 96-99.
-

- 29. Wiegand, S., Jogler, M., and Jogler, C., 2018, On the maverick Planctomycetes, FEMS Microbiol. Rev., 42(6), 739-760.
-

- 30. Yang, R., Li, J., Wei-Xie, L., and Shao, L., 2020, Oligotrophic Nitrification and Denitrification Bacterial Communities in a Constructed Sewage Treatment Ecosystem and Nitrogen Removal of NF4, Pol. J. Microbiol., 69(1), 99-108.
-

- 31. Zhang, J., Mueller, C., and Cai, Z., 2015, Heterotrophic nitrification of organic N and its contribution to nitrous oxide emissions in soils, Soil Biol. Biochem., 84, 199-209.
-

- 32. Zhao, L., Su, C., Wang, A., Fan, C., Huang, X., Li, F., and Li, R., 2021, Comparative study of aerobic granular sludge with different carbon sources: Effluent nitrogen forms and microbial community, J. Water Process. Eng., 43, 102211.
-

- 33. Zhao, W., Cai, Z.C., and Xu, Z.H., 2007, Does ammonium-based N addition influence nitrification and acidification in humid subtropical soils of China?, Plant Soil, 297(1), 213-221.
-

- 34. Zhuang, H., Wu, Z., Xu, L., Leu, S.Y., and Lee, P.H., 2020, Energy-efficient single-stage nitrite shunt denitrification with saline sewage through concise dissolved oxygen (DO) supply: process performance and microbial communities, Microorganisms, 8(6), 919.
-

 This Article
This Article
-
2022; 27(6): 37-46
Published on Dec 31, 2022
- 10.7857/JSGE.2022.27.6.037
- Received on Nov 21, 2022
- Revised on Dec 13, 2022
- Accepted on Dec 20, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sung-Wook Jeen
-
1Department of Environment and Energy, Jeonbuk National University
2Department of Earth and Environmental Sciences & The Earth and Environmental Science - E-mail: sjeen@jbnu.ac.kr