- Hydrogeochemical Characteristics and Microbial Community Structures of Freshwater in Ulleung Island
Dong-Hun Kim1, Byong Wook Cho1, Byeong Dae Lee1*, Jung-Yun Lee1,2, Yong Hwa Oh3
1Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources, Daejeon, 34132, Republic of Korea
2Department of Biosystems Science, Chungbuk National University, Cheongju 28644, Republic of Korea
3Department of Convergence Study on the Ocean Science and Technology, Korea Maritime & Ocean University, Busan 49112, Republic of Korea- 울릉도 담수의 수리지화학적 특성 및 미생물 군집 구조
김동훈1, 조병욱1, 이병대1*, 이정윤1,2, 오용화3
1한국지질자원연구원 기후변화대응연구본부 지하수환경연구센터
2충북대학교 자연과학대학 생명시스템학과
3국립한국해양대학교 해양과학기술전문대학원 해양과학기술융합학과This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study investigated the hydrogeochemical and microbiological characteristics of freshwater on Ulleung Island, a volcanic island in the Ulleung Basin on the East Coast of Korea. The shallow groundwater (CSW, NRGW) and the surface water (SISW) samples are classified as Na-HCO3 type, reflecting an alkaline rock type and an oxidizing environment due to the influence of a highly permeable pyroclastic rock layer. In contrast, the deep groundwater sample (DMW) is classified as Ca-HCO3 type, suggesting the influence of deep-sourced carbon dioxide and reducing conditions. Microbial communities in the water samples are generally dominated by Proteobacteria, with the relative abundance of major genera varying depending on water quality and environmental conditions. Network analysis reveals the ecological characteristics of microbial communities adapted to specific environments. The presence of pathogenic genera in the shallow groundwater suggests potential groundwater contamination, necessitating appropriate management to ensure its use as drinking water or domestic water. The findings of this study provide valuable insights into the ecological characteristics of Ulleung Island’s groundwater resources and can inform future groundwater management strategies.
Keywords: Ulleung Island, Groundwater, Microbial community, Hydrogeochemistry,
지하수는 물 순환에서 담수를 저장하는 중요한 저장소로 생활용수, 공업 및 산업용수 등을 공급하는 중요한 수자원 역할을 하지만, 매우 제한된 자원이며 인간 활동으로 인한 오염에도 취약하다(Urish, 2012). 또한, 기후변화로 인한 연안 대수층의 해수침투 가속화, 해수면 상승, 농업 생산성 향상과 산업화에 따른 담수 수요 증가는 기후 변화에 취약한 전 세계 많은 섬들의 담수 수요 충족이라는 과제에 큰 부담을 가하고 있다(Fabbrocino et al., 2022; Sharan et al., 2021). 특히, 전 세계에 분포하는 크고 작은 화산섬들은 수문 순환을 통해 담수를 공급받으며 지하수 의존도가 매우 높을 뿐만 아니라 이들의 수문 체계와 수자원의 평가 및 관리는 다른 지역과 구별되는 독특한 특징을 갖는다(Fernandes et al., 2020; Sharan et al., 2021; Urish, 2012).
한반도 동쪽에 위치한 화산섬인 울릉도는 최고봉인 성인봉을 포함한 주요 섬 하나와 여러 작은 섬으로 구성되어 있다. 울릉도는 난류와 한류의 영향으로 인해 해양성 기후를 띄며, 최근 10년간 연평균 강수량이 1,541 mm에 달하는 국내 최다 강수 지역 중 하나이다(KMA, 2023). 울릉도는 지형적 특성상 강우의 대부분이 지표로 직접 유출이 되지만, 투수성이 높은 화산암지대에서는 상당량이 지하수로 함양되기 때문에 풍부한 수량을 유지할 수 있다(Lee et al., 2018a).
울릉도의 지형과 지질학적 특성에 관한 연구는 비교적 많이 보고되었으나(Im and Choo, 2015; Im et al., 2012; Kim and Lee, 2008; Okuno et al., 2010; Song et al., 2006), 지하수의 수질 특성, 대수층 형태, 지하수 유동과 같은 수리지질학적 연구는 미미한 실정이다. 최근 울릉도의 주요 수자원인 추산용천수에 대한 수리지질학적 연구 결과, 성인봉 하류 칼데라의 조면암질 부석응회암층을 통해 함양된 지하수가 조면암과 나리응회암 경계부근인 추산용출소로 20,000-40,000 m3day-1 내외의 많은 수량이 용출되고 있으며 알칼리계열 화산쇄설암류의 세립질 화쇄류 입자와의 반응으로 수질이 형성된다고 보고되었다(Cho and Lee, 2018; Lee et al., 2024; Lee et al., 2018a). 또한, 울릉도 방문 관광객수가 연 40만명 이상으로 급격한 증가세를 보이고 있으며, 이에 따른 물 수요량의 급격히 증가와 오염 발생 위험성이 예상되므로 지하수 자원의 체계적인 관리가 필수적이다.
울릉도는 육지와 격리되어 있다는 지리적 요인으로 인해 외부로부터의 생물 유입이 제한되어 다양한 물리화학적 요인에 의해 형성된 독특한 환경 특징을 보존하고 있다(Kim et al., 2013; Yun et al., 2022). 지하수 생태 연구는 대수층의 생지화학적 순환, 지하수 수질 결정 과정, 오염된 대수층의 수질 회복에 대한 정보를 제공할 수 있는 매우 중요한 연구 분야이다(Griebler et al., 2014; Kirs et al., 2020; Ma et al., 2022). 특히 미생물 군집에 대한 연구는 지하수 생태계를 구성하는 기반에 대한 심층적인 이해를 제공할 수 있다. 최근 울릉도 하천을 대상으로 미생물 군집과 미세 조류 군집의 변화에 관한 연구를 통해 하천의 흐름에 따른 미생물 군집의 변화를 확인함으로써 환경 요인이 담수 생태계를 조절하고 우점종을 변화시키는 것을 확인하였다(Yun et al., 2019; Yun et al., 2022). 그러나, 지하수를 주요 수자원으로 활용함에도 불구하고 지하수 생태에 대한 연구는 전무한 실정이다.
울릉도와 같은 화산섬에서 지하수는 식수, 농업, 산업용 수원으로서 의존도가 매우 높다. 이러한 지하수는 공중위생과도 밀접하게 연결되어 있으므로 지속 가능한 활용을 위한 적절한 관리 방안이 반드시 필요하다. 따라서, 이러한 관점에서 본 연구는 중요 수자원인 울릉도 지하수의 현재 상태를 특성화하기 위한 수리지질학적 특성과 미생물 생태학적 특성 분석을 수행하였다.
2.1. 연구지역
울릉도는 한반도 동쪽의 울릉 분지 북측에 위치하며 수심 약 2,200 m의 해저면에서 콘 모양으로 형성된 화산섬으로 여러 번의 화산활동이 중첩된 복성화산체를 이루고 있다(Hwang, 2014; Lee et al., 2018a). 울릉도는 중앙 섬과 가파른 비탈을 가진 여러 작은 섬으로 구성되어 있으며 중앙 북부의 해발 350-400m 지점에서 직경 약 2 km인 나리 분지가 발달하였고, 칼데라와 외륜산인 성인봉을 비롯한 준봉들이 급경사를 이루면서 이를 둘러싸고 있는 형태이다(Lee et al., 2018a). 울릉도의 지질은 지표 또는 해저에서의 분출 혹은 폭발로 인한 화산활동에 의한 결과물들로 대부분 현무암과 현무암질 각력암, 유리쇄설암, 응회암, 조면암 그리고 조면안산암으로 이루어져 있고 바다의 영향을 받은 지형과 침식과 풍화에 의한 지형으로 구분된다.
최근 10년간 연평균 강수량은 1,541 mm로 우리나라 연평균 강수량 1,278 mm에 비해 많지만 2000년대 이후 지속적으로 감소하는 추세이며, 연평균 기온은 12-14oC로 온난류와 한랭류의 영향을 받는 해양성 기후가 지배한다(KMA, 2023). 울릉도의 수계는 성인봉을 중심으로 방사상 수계를 이루고 있으며 북측 사면에서의 하천 발달이 상대적으로 미약한 특징을 보인다. 대부분 다공성 매질인 현무암질 집괴암과 응회암으로 이루어져 하천은 폭이 좁고 유량도 많지 않는 반면, 지하수의 양은 풍부하다.
2.2. 시료 채취
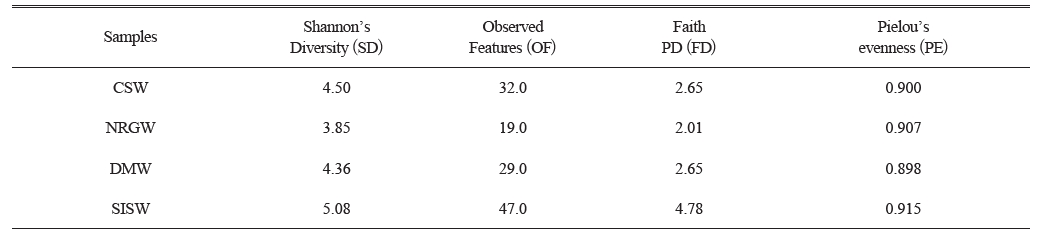
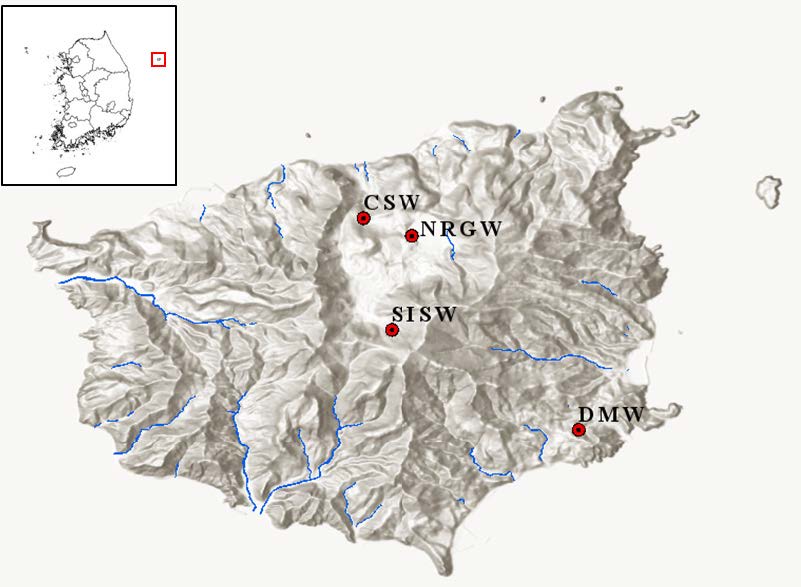
본 연구를 위한 시료채취는 2019년 5월 울릉도에 위치한 추산용출수(CSW), 나리 분지 지하수(NRGW), 도동약수(DMW) 및 성인봉 사면의 지표수(SISW)를 대상으로 수행하였다(Fig. 1). 시료 채취 전 울릉도에는 15일 이상 강우일이 없었고 3일 전 5 mmday-1 강우량을 보였으나 시료에는 큰 영향을 주지 않는 것으로 판단하였다(KMA). CSW 시료와 DMW 시료는 용출 지점에서 외부 교란을 최소화하며 채취하였고, SISW 시료는 성인봉 사면의 계곡수를, NRGW 시료는 관정에 설치된 펌프에서 양수 된 지하수 시료를 바로 채취하였다. 현장 수질(수온, 전기전도도(Electrical Conductivity; EC), pH, 용존 산소, 산화환원전위)은 휴대용 수질측정장비(Multi 3620 IDS, WTW, Germany)를 이용하여 시료 채취 직전에 측정하였다. 지하수 시료는 현장 수질이 안정될 때까지 purging 한 뒤 무균 채수병에 4 L를 채취하였으며 지표수는 1 L를 채취하였다. 미생물 군집 분석에 필요한 미생물량을 확보하기 위하여 채취한 시료 전체를 0.22 μm Sterivex-GP filter (Merck, USA)를 사용해 현장에서 여과하였고, 여과된 시료는 주요 용존 양이온(Ca2+, Mg2+, Na+, SiO2 (aq), K+)과 용존 음이온(Cl-, SO42-, NO3-, HCO3-) 분석을 위하여 각각 30 mL를 폴리에틸렌 용기에 채취하였다. 용존 양이온 시료의 경우, 용기 벽면 흡착과 침전을 방지하기 위해 현장에서 질산(HNO3)을 첨가하여 pH를 2 이하로 유지하였다. HCO3- 시료는 125 mL 폴리에틸렌 용기를 이용하여 시료를 채취하였다. 여과한 필터는 미생물 군집 분석을 위해 무균상태의 50 mL conical tube에 보관하여 냉장 상태(4°C)를 유지하며 실험실로 운반하였다.
2.3. 주요 용존 이온 분석
시료의 주요 용존 양이온과 용존 음이온 농도는 각각 유도결합 플라즈마 분광 광도계(ICP-OES; Optima 7300 DV; Perkin Elmer, USA)와 이온크로마토그래피(IC; ICS-1500; Dionex, USA)를 이용하여 측정하였다. HCO3 (total alkalinity) 농도는 총 알칼리도 측정 시약(TNT 870 kit, Hach, USA)을 첨가하여 나타나는 발색반응을 분광 광도계(DR-1500, Hach, USA)를 이용하여 측정하였다. Ca2+, Mg2+, Na+, SiO2 (aq), K+, Cl-, SO42-, NO3- 농도의 검출한계는 각각 0.02, 0.1, 0.1, 0.06, 0.01, 0.01, 0.05, 0.04 mgL-1이다.
2.4. DNA 추출 및 염기서열 분석
염기서열 분석을 위하여 여과한 필터는 -20°C에 보관한 뒤 DNA 추출에 사용하였다. 미생물의 genomic DNA (gDNA)는 여과된 필터로부터 DNeasy PowerWater Kit (Qiagen, USA)를 이용하여 제조사의 방법에 따라 추출하였다. 차세대염기서열분석(next-generation sequencing, NGS)은 Macrogen Inc. (Korea)의 Miseq (Illumina, Inc.) 장비를 이용하여 미생물의 16S ribosomal RNA (16S rRNA) 유전자의 V4 영역을 대상으로 제조사의 방법에 따라 수행하였다.
NGS 결과로 얻어진 염기서열들은 QIIME 2 (version 2022.02)를 사용하여 전처리 및 통계학적 분석을 수행하였다 (Bolyen et al., 2019). 염기서열은 demultiplexing 과정을 거쳐 DADA2를 통해 오류를 보정하고 노이즈를 제거하여 amplicon sequence variants (ASV) (Callahan et al., 2016)를 구성하였다. ASV는 Silva 16S ribosomal RNA database (release 138)를 참고하여 분류학적으로 구분하였다. 또한 미생물 군집의 종 다양성과 균등도, 샘플 간 유사도 등의 다양성 분석을 QIIME 2 pipeline (https://qiime2.org)을 이용하여 수행하였다. 군집 내 미생물 간 상관관계를 기반으로 영향력을 분석하기 위한 네트워크 분석은 Pearson 상관을 추정하는 sparse correlations for compositional data (SparCC) (Shaffer et al., 2023)를 사용하여 QIIME 2에서 수행하였고 Cytoscape (v 3.9.1)를 사용하여 시각화 하였다.
|
Fig. 1 Sampling locations of the study area. |
3.1. 현장 수질 특성
연구지역에서 채취한 시료의 기본적인 수질 특성을 파악하기 위해 시료의 현장 수질을 측정하였다(Table 1). 지하수와 지표수 수온은 10.9-13.7oC 범위로 평균 12.0±1.2oC를 나타냈으며 시료간 큰 차이는 없었다. pH의 경우, 5.6–7.8(평균 7.0±1.0) 범위를 보였으며, 대부분의 시료는 중성을 나타내고 있으나 DMW 시료는 약산성(pH 5.6)의 특징을 보였다. EC는 169-677 μScm-1 (평균 407±209 μScm-1) 범위의 값을 보였으며 DMW 시료가 가장 높은 EC 값을 나타냈다. 일반적으로 EC 값은 지하수의 유동속도, 지질특성, 오염 여부 등과 관련성을 보이는데 해당 지역의 경우 농경 활동에 의한 오염 가능성이 없기 때문에 지질특성에 의한 영향으로 판단된다. 실제 DMW 시료의 경우, 다른 시료에 비해 용존 이온의 농도가 높게 측정되었다. 용존 산소와 산화환원전위의 경우, 각각 0.8-11 mgL-1와 65-214 mV의 범위를 보였다. DMW시료를 제외한 모든 시료에서 높은 용존 산소 농도와 산화환원전위 값을 보였는데, CSW와 NRGW 시료의 경우 다공질인 천부 대수층을 통과하면서 산소와의 반응에 의한 것으로 판단된다(Lee et al., 2018a). 또한, 전반적으로 CSW와 NRGW, SISW 시료가 유사한 현장수질 특성을 보이는데 이는 나리 분지 일대의 지하수 유동과 연관된 것으로 판단된다.
3.2. 수리화학적 특성
연구지역 시료의 주요 용존 양이온 농도의 경우 CSW와 NRGW, SISW시료에서는 Na+ > K+ > Ca2+ > Mg2+ 순으로 나타난 반면 DMW 시료에서는 Ca2+ > Na+ > Mg2+ > k+ 순으로 나타났다. 울릉도는 지질학적으로 신생대 3기 말에서 제4기 말까지 활발한 화산활동으로 형성된 화산섬으로 주요 암질은 현무암, 조면암, 포놀라이트, 화산각력암, 응회암, 부석 등으로 구성된다(Lee et al., 2018a). 특히 나리 분지의 응회암층 위에 두껍게 퇴적된 조면암질 및 현무암질 쇄설물들은 분지내로 유입된 지표수를 흡수하고 저장하는 역할을 한다(Cho and Lee, 2018). 따라서 이러한 알칼리성 조면암(trachyte)를 구성하는 알칼리 장석의 용해에 의해 Na+이온과 K+이온이 시료에 높게 나타난 것으로 판단된다. 또한, 울릉도 남동부 지역에 분포하는 도동현무암층을 구성하는 사장석과 휘석 및 감람석과 지하수와의 반응을 통해 Fe 이온을 포함한 용존 이온의 농도가 높게 나타난 것으로 판단된다(Bae et al., 2012; Choi, 2021; Hwang et al., 2017). 용존 음이온의 경우도 HCO3- > Cl- > SO42- > NO3-의 순으로 나타나 지하수와 암석 반응을 지시하였으며 NRGW 시료에서는 NO3-의 농도가 상대적으로 높은 특징을 보였다. NRGW 시료의 경우 농업 및 생활 활동이 활발한 나리 분지 내에 위치하고, 지층이 투수성이 높은 화산쇄설물층으로 이루어져 지하수로의 오염물질 유입 영향 때문이라 판단된다. DMW 시료의 경우 다른 시료에 비해 Ca2+ 이온과 HCO3- 이온의 농도가 높게 나타났는데, 이는 천부 환경의 지하수가 심부 기원 이산화탄소의 공급을 받아 형성된 것으로 판단된다(Kim et al., 2000). 지표수인 SISW 시료는 다른 시료에 비해 용존 이온의 농도가 낮게 나타났다.
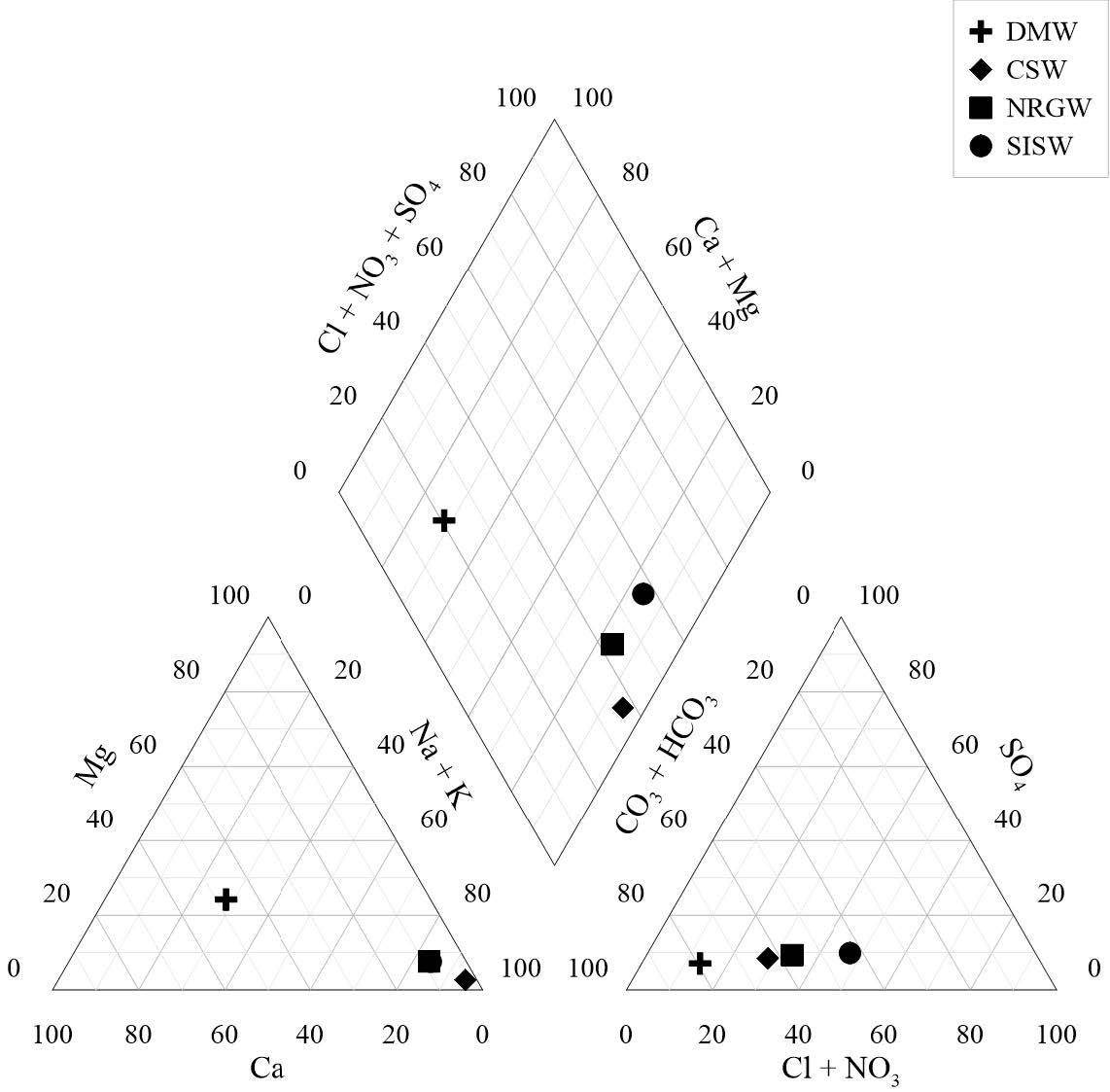
연구지역 시료에 대한 수질 특성을 파악하기 위하여 분석된 수질 자료를 이용하여 Piper diagram (Piper, 1944)에 도시하였다(Fig. 2). CSW와 NRGW 시료는 울릉도 알칼리 암류의 영향으로 Na-HCO3 유형에 도시되었고, SISW 시료는 Na-Cl 유형으로 분류되었다. SISW의 경우 Na+와 Cl-의 함량은 해수 기원 강우의 영향으로 판단된다. DMW 시료는 Ca-HCO3 유형으로 수질의 특성이 잘 반영되었다고 볼 수 있다.
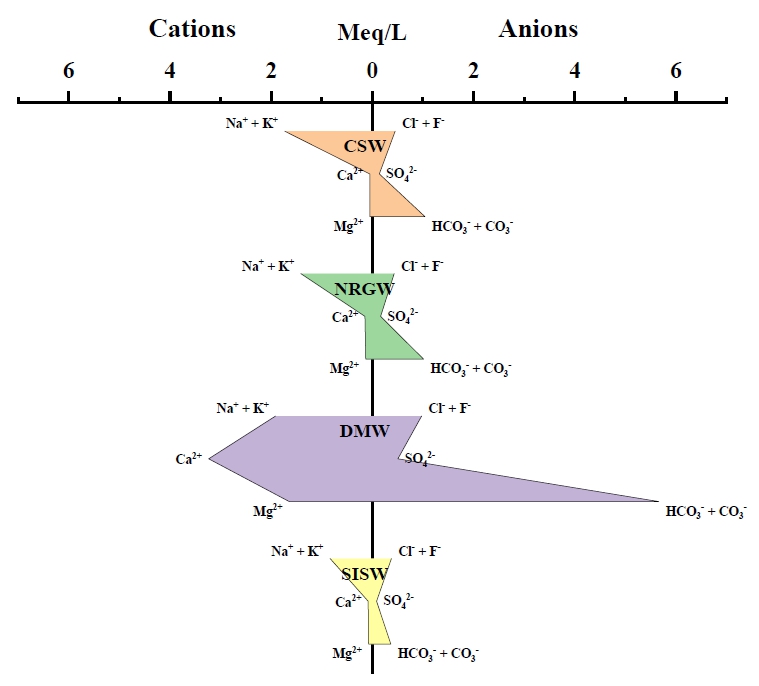
각 시료의 주요 용존 이온성분을 stiff diagram (Stiff, 1951)으로 도시한 결과(Fig. 3), CSW 시료와 NRGW 시료는 Na+ + K+와 HCO3-가 가장 우세하여 Na-HCO3 유형으로 잘 구분되었다. DMW 시료의 경우 전체적으로 다른 시료에 비해 고농도의 양이온이 존재하고 있으며 Ca2+와 HCO3-가 매우 우세한 특성을 보였다. 지표수인 SISW 시료는 지하수 시료에 비해 용존 이온의 농도가 낮았지만 Na+ + K+가 우세하였고 Cl-와 HCO3-가 유사하게 존재하고 있기 때문에 Piper diagram에서 Na-Cl과 Na-HCO3 유형의 경계에 위치하고 있다.
3.3. 미생물 군집 특성
울릉도 담수 시료의 미생물 군집 다양성 분석을 위하여 염기서열 분석을 수행하였다. 분석 결과 4개의 시료로부터 저품질 서열, 모호한 서열과 키메라 서열을 제외하고 53,920개의 염기서열을 얻었으며 각 시료당 4,733개의 염기서열을 동일하게 추출하여 분석을 수행하여 105개의 ASV가 생성되었다. 시료 내 미생물 군집의 다양성(diversity)을 평가하기 위하여 Shannon’s diversity index (SD), Observed Features (OF), Faith’s phylogenetic diversity (FD), Pielou’s evenness (PE) 지수를 분석하였다(Table 2). 지표수인 SISW 시료에서 종 풍족도 지수인 SD와 OF가 가장 높게 나타나는 특징을 보인 반면, CSW와 DMW 시료에서는 유사한 값을 보였고 NRGW 시료에서 가장 낮은 값을 보였다. 염기서열 간 계통발생학적 관계를 반영한 FD 지수도 SISW 시료에서 가장 높은 값을 보여 지표수에서 종 풍부도가 높지만 지하수 시료와 차이가 있음을 보여주었다. 종의 균등성을 나타내는 PE 측면에서도 SISW 시료에서 약간 높게 나타났지만 전체적으로 시료 내 미생물 종들이 균등하게 분포하고 있는 것으로 나타났다.
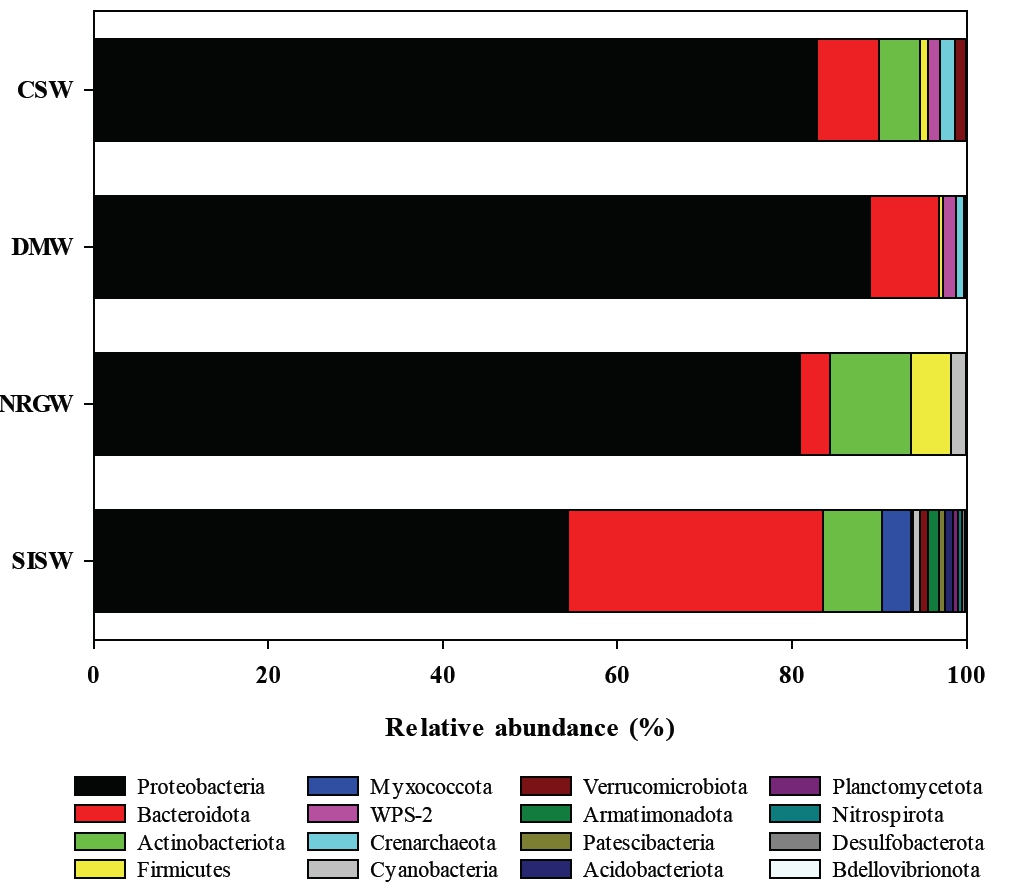
염기서열 기반 미생물 군집 분석 결과, 총 16개의 문(phylum) 으로 구성되어 있고 이중 Proteobacteria가 가장 우점하고 있었으며 Bacteroidota, Actinobacteriota, Firmicutes 순으로 존재하였다(Fig. 4). Proteobacteria는 대부분의 지하수에서 가장 많이 발견되는 문으로(Griebler and Lueders, 2009; Lee et al., 2018b; Zeng et al., 2017; Zhang et al., 2016) 전체 시료에서 평균 76.7%를 차지하고 있으며 지하수 시료에서는 평균 84.2%를 차지하는 반면 지표수 시료에서는 54.4%를 차지하고 있었다. Bacteroidota는 다양한 수생 서식지에서 발견되는 문으로 유기 탄소 순환에 관여하는 것으로 알려져 있으며(O’Sullivan et al., 2006; Sang et al., 2018; Thomas et al., 2011)는 지하수 시료에는 평균 6.2% 차지하는 반면 지표수 시료에서는 29.1%를 차지하는 특징을 보였다. 이는 지표수의 특성상 낙엽과 표토의 유기물이 지표수에 함유되어 나타나는 현상으로 판단된다. Actinobacteria는 다양환 환경에 폭넓게 존재하며 유기물의 분해와 질소 순환에 관여하는 것으로 알려져 있으며(Zhang et al., 2019), 퇴적물에 부착되기보다는 유체에 부유하여 존재하며 심부보다 천부 지하수 시료에서 흔히 발견되는 미생물로(Griebler and Lueders, 2009; Korbel et al., 2017; Oh et al., 2020) 평균 5.2%로 존재하고 있으나 DMW 시료에서는 발견되지 않았다. 이는 DMW 시료가 심부 기원 이산화탄소의 영향을 크게 받는 지하수이고, 유기물 또는 질소 농도가 다른 시료에 비해 낮기 때문이라 판단된다. 극한 조건에 저항하기 위해 포자를 생성할 수 있는 Firmicutes (Fimlaid and Shen, 2015; Sang et al., 2018)는 지하수 시료에서만 발견되는 특징을 보였다. 나머지 문들은 평균 1% 이하를 차지하고 있으며 시료마다 다양한 비율로 존재하고 있었다.
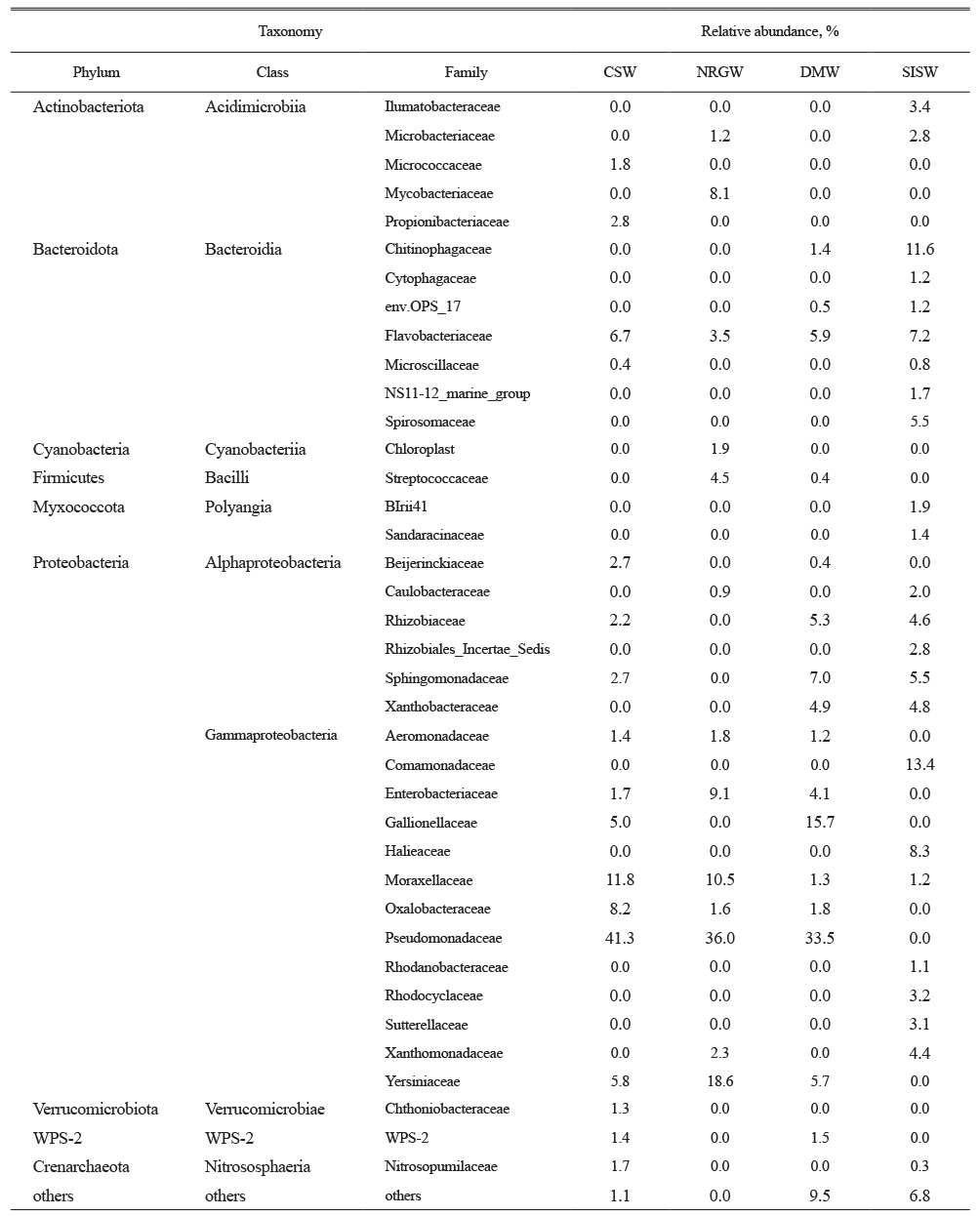
각 시료에서 나타나는 미생물 군집을 과(Family)수준에서 분석해 보면 gamma-proteobacteria에 속하는 Pseudomona-daceae가 지하수 시료에 가장 우세하게 존재하고 있지만 지표수 시료에서는 발견되지 않았다(Table 3). 지하수 시료 중 CSW 시료에서는 질소 순환 기능을 갖는 Propionibacteriaceae와 Oxalobacteraceae가 다른 시료에 비해 풍부하였으며, DMW 시료에서는 Gallionellaceae가 우세한 특징을 보였다. Gallionellaceae은 미호기성 환경에서 이가철 이온(ferrous ion)을 불용성 침전물인 수산화철(ferric hydroxide)로 산화 시키는 철 산화능을 가지고 있으며(Hallbeck and Pedersen, 1991), 이는 DMW 시료의 높은 Fe 이온 농도와 연관이 있는 것으로 보인다. NRGW 시료의 경우 투수성이 높은 나리 분지 지역에 위치하며 병원성균을 포함하는 Yersiniaceae, Enterobacteriaceae, Streptococcaceae가 높은 비율로 존재하고 있기 때문에 지속적인 관리가 필요해 보인다(Novak Babič et al., 2020; Rock and Donnenberg, 2014; Schaffter and Parriaux, 2002). 지표수인 SISW 시료에서는 지하수 시료에서는 발견되지 않는 다양한 미생물이 존재하고 있으며 이는 외부에 노출된 환경 영향으로 생존을 위한 다양한 대사 기작이 요구되기 때문으로 판단된다.
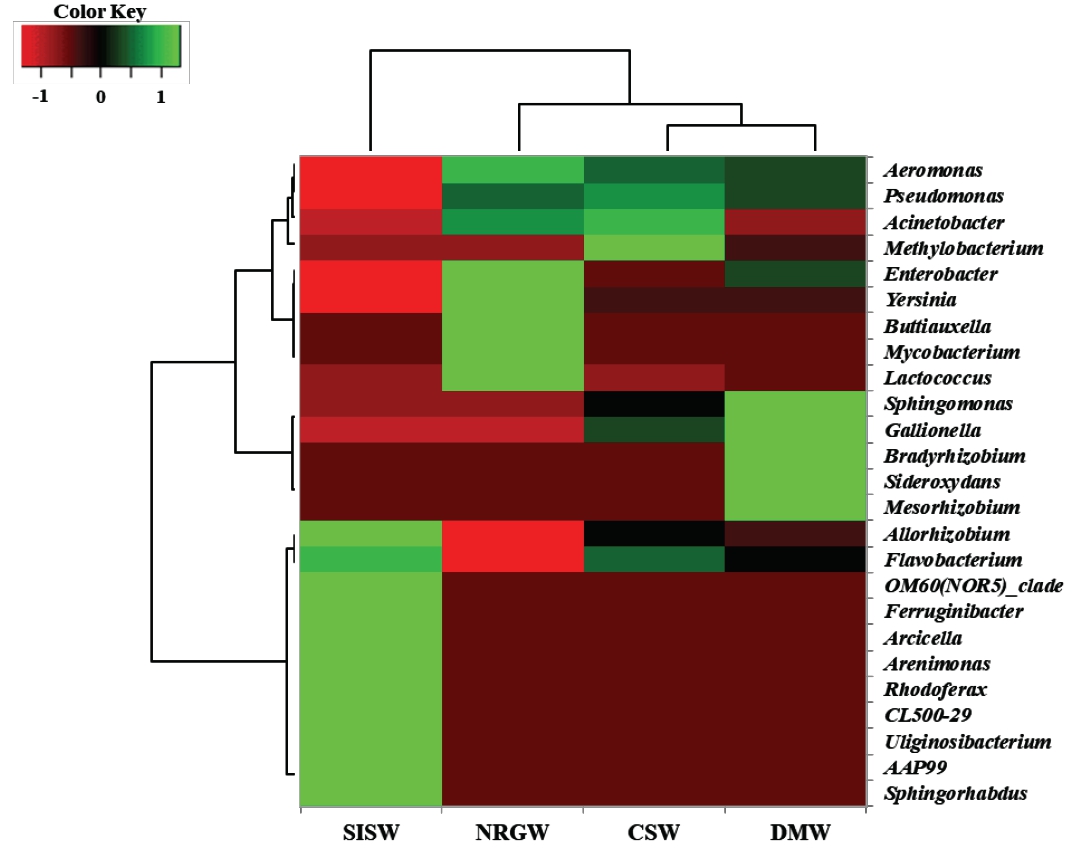
각 시료에 존재하는 미생물 군집의 특성을 확인하기 위하여 속(genus) 수준에서 발현빈도가 3% 이상인 25개 속을 대상으로 heatmap 분석을 수행하였다(Fig. 5). 시료마다 우점하는 속이 다르게 분포하고 있어 뚜렷하게 구분되었으며 크게 지하수 시료와 지표수 시료로 분리되었다. 지표수 시료(SISW)는 지하수 시료에서 발견되지 않는 Ferruginibacter (10.3%), OM60(NOR5)_clade (8.3%), Arcicella (5.5%), Arenimonas (4.4%), Rhodoferax (4.4%), Uliginosibacterium (3.2%), Sphingrhabdus (31%)등이 우점하고 있다. 이들 속 대부분은 질소 순환과 유기물 분해능이 있으며 빈영양 환경에서 광합성을 통해 에너지를 얻는 속들이 포함되어 있다(Chen et al., 2013; Hiraishi et al., 1991; Jogler et al., 2013; Kang et al., 2015; Kang et al., 2017; Kwon et al., 2007; Yan et al., 2009). 지하수 시료의 경우에도 각 시료들마다 우점하는 속이 다르게 분포하였는데 Aeromonas와 Pseudomonas속은 모든 지하수 시료에 비슷한 비율로 존재하고 있었으며, Acinetobacter속은 CSW와 NRGW 시료에 비교적 우점하고 있었다. 특히 CSW 시료에서는 다양한 탄소 화합물을 이용할 수 있어 탄소 순환에 중요한 역할을 하는 Methylobacterium속이 존재하는 특징을 갖는다(Peyraud et al., 2011). NRGW 시료에는 병원성균을 포함하는 Enterobacter, Yersinia, Buttiauxella, Mycobacterium, Lacococcus속이 평균 7.7% 이상 존재하고 있기 때문에 생활용으로 사용할 경우 지속적인 관리가 필요해 보인다(Alegbeleye and Sant’Ana, 2020; Pandey et al., 2014; Patel et al., 2016). DMW 시료에는 미호기성 환경에서 철 산화능을 갖는 Gallinella속과 Sideroxydans속이 존재하는데 이들은 산성 조건에서도 성장을 위한 에너지를 이가철 산화를 통해 얻고 수산화철 침전을 촉진시키는 기능을 갖는다(Fabisch et al., 2013; Zhou et al., 2022). 따라서 DMW 시료 내 높은 철이온 함량과 낮은 산소 조건은 철산화 미생물인 Gallionella속이 우점하는 데 영향을 미쳤다고 판단된다(Jones et al., 2015; Méndez-García et al., 2015).
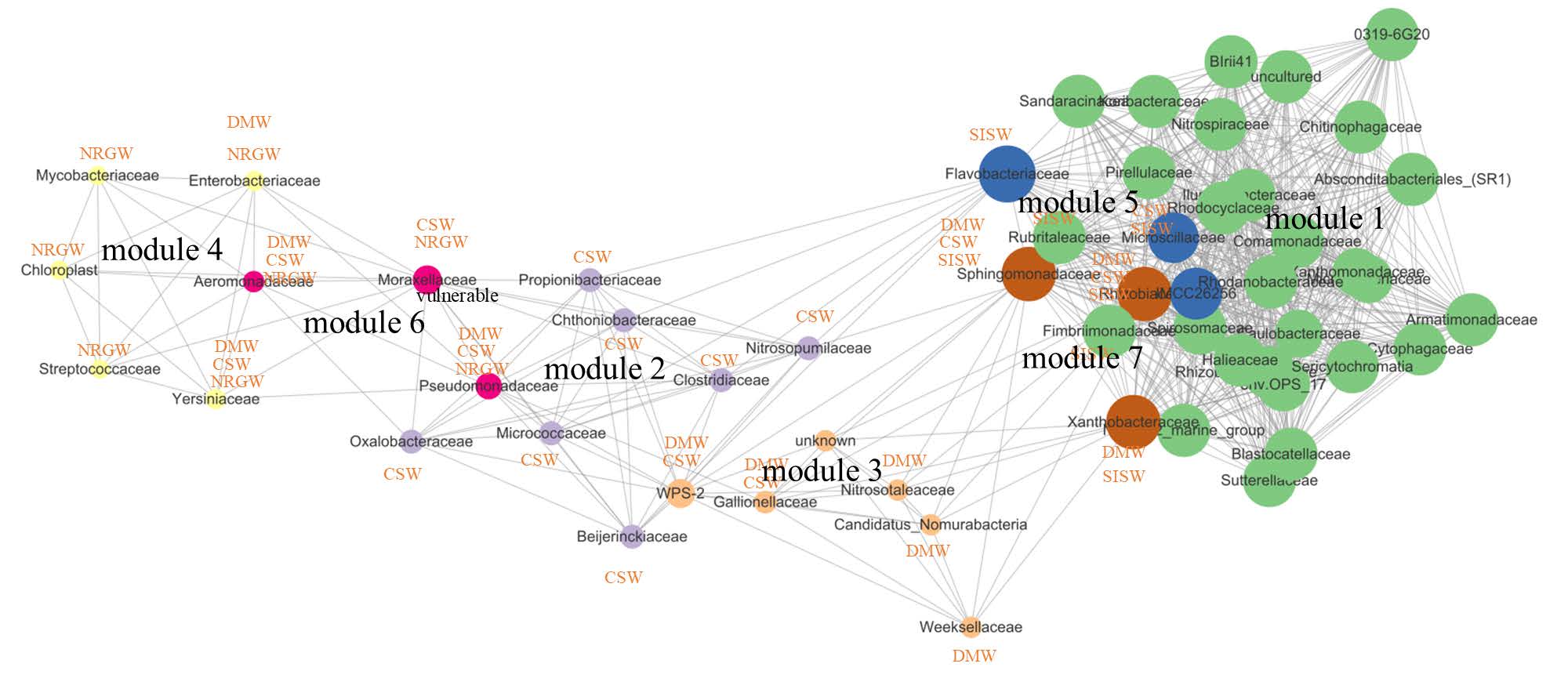
시료의 co-occurrence 네트워크 분석을 통해 시료간 연결성과 시료 내 구조의 안전성을 과(family) 수준에서 평가하였다(Fig. 6). 네트워크 분석은 기능적으로 관련된 미생물 집단 간의 상호작용과 환경 변화에 대한 반응을 이해하는 효과적인 방법이다(Abiriga et al., 2022). 총 55개의 node (family taxa)가 652개의 edge를 형성하여 7개의 module로 구성되었다. Module 1은 가장 많은 node (28)를 포함하고 있으며 module 2와 3이 각각 7개와 6개의 node로 구성되고 나머지 module은 5개 이내의 node로 구성되었다. 각각의 모듈은 시료에 따라 구분되었으며 module 1은 SISW 시료에서 주로 구성되었으며 module 2와 3은 각각 CSW 시료와 DMW 시료에서 주로 발견되는 미생물을 포함하였다. Module 4는 NRGW 시료와 상관성이 높았으며 나머지 module들은 시료간 공동으로 나타나는 과들을 포함하여 각 module을 연결하고 있었다. 전체적으로 영양소가 상대적으로 풍부한 지역에서 미생물 군집 내 상호작용이 다양하여 네트워크 구성이 조밀하였고, 특정 서식지 환경에서의 경우 이용 가능한 에너지원의 한계로 단순한 패턴을 나타내고 있었다.
|
Fig. 2 Piper diagram for the groundwater and surface water samples collected from study area |
|
Fig. 3 Stiff diagrams showing average chemical composition of samples. |
|
Fig. 4 Stacked bar plots of Phylum level bacterial taxa. Each color in the bar plot represents a bacterial taxa assigned according to the legend. |
|
Fig. 5 Heat-map showing relative frequency of bacterial communities at genus level. Genera presents for top twenty five genus those whose showed higher than 3% sequence abundance across the samples. Dendrograms on the vertical and horizontal axes are based on the Bray_Curtis dissimilarity matrix. |
|
Fig. 6 Co-occurrence network analysis. Node colors represent the co-occurring family taxa (modules) and edge represent significant positive Spearman's correlation coefficient > 0.7 and ajusted p-value < 0.001. The node sizes are proportional to the degree of between centrality. |
|
Table 1 Field parameters and concentrations of major ions measured in this study |
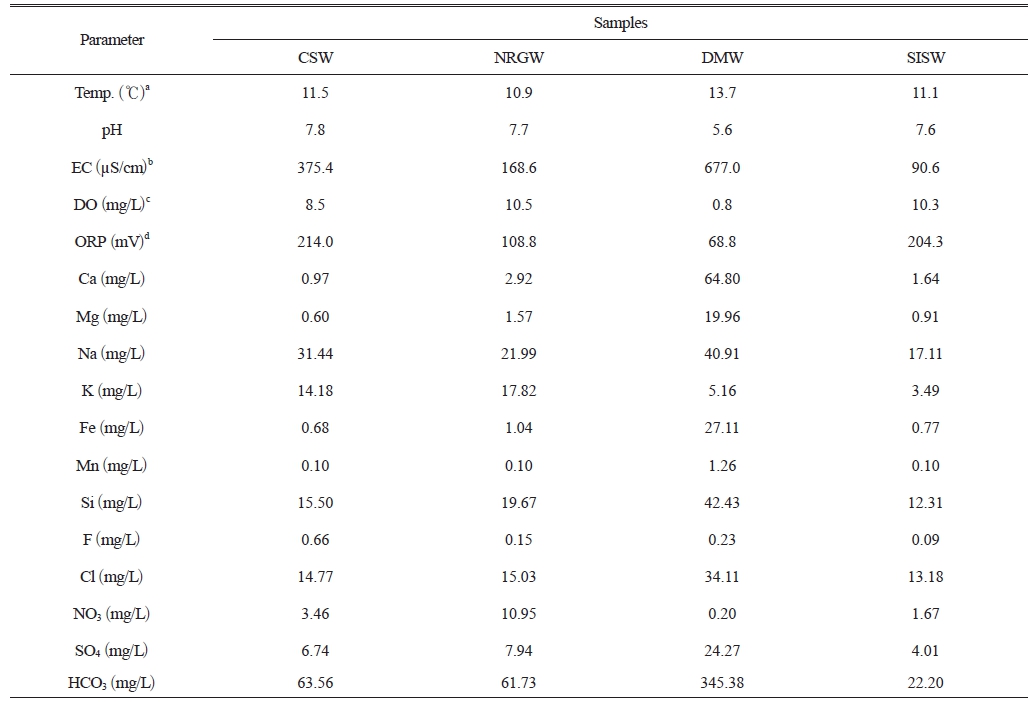
a Temperature |
|
Table 3 Relative abundance of microbial families in the CSW, NRGW, DMW, and SISW samples |
본 연구는 동해안 울릉 분지에 위치한 화산섬인 울릉도의 지하수와 지표수를 대상으로 수질 및 미생물학적 특성을 분석하였다. 지표수(SISW)를 포함한 나리 분지 일대 시료(CSW와 NRGW)는 투수성이 높은 화산쇄설물층의 영향으로 산화환경을 보이며 알칼리 암류의 특징인 Na-HCO3 유형으로 분류되었다. 반면, 심부기원 이산화탄소의 영향을 받는 DMW 시료는 상대적으로 환원환경을 보였으며 Ca-HCO3 유형에 속하였다. 미생물 군집의 경우 모든 시료에서 Proteobacteria가 우점하였으나 시료의 수질 및 환경 조건에 따라 군집을 구성하는 주요 속의 비율에서 차이를 보였다. 또한, 시료 내 존재하는 미생물 집단간의 연결성과 구조의 안정성을 분석하여 특정 환경에 적응하여 생존하는 생태특성을 파악할 수 있었다. 특히 NRGW 시료에서는 병원성균을 포함하는 속이 다수 발견되는 특징을 보였는데, 나리 분지 일대가 투수성이 높은 부석층으로 구성되어 있기 때문에 상부로부터의 오염물질 유입에 의한 가능성이 높으므로 음용수나 생활용수로 지속적인 사용을 위해서는 관리 방안이 반드시 필요할 것으로 보인다.
본 연구에서는 지하수 및 지표수 수질과 미생물 군집 분석을 통해 울릉도 담수의 생태 특성을 평가하였고 이러한 결과는 향후 울릉도 지하수자원의 관리를 위한 기초 자료로 활용될 수 있을 것으로 판단된다.
본 연구는 과학기술정보통신부에서 지원한 한국지질자원연구원 기본사업(GP2020-012)의 도움으로 수행되었습니다.
- 1. Abiriga, D., Jenkins, A., Klempe, H., 2022, Microbial Assembly and Co-Occurrence Network in an Aquifer under Press Perturbation, Ann. Microbiol., 72(1), 41.
-

- 2. Alegbeleye, O.O., Sant’Ana, A.S., 2020, Manure-Borne Pathogens as an Important Source of Water Contamination: An Update on the Dynamics of Pathogen Survival/Transport as Well as Practical Risk Mitigation Strategies, Int. J. Hyg. Environ. Health, 227, 113524.
-

- 3. Bae, S.-G., Choo, C.-O., Jang, Y.-D., 2012, Mineralogical Characteristics of Tachylite Occurring in Basic Dike, Basaltic Agglomerate Formation, Ulleung Island and Its Implications of Volcanic Activity, J. Mineral. Soc. Korea, 25(2), 63-76.
-

- 4. Bolyen, E., Rideout, J.R., Dillon, M.R., Bokulich, N.A., Abnet, C.C., Al-Ghalith, G.A., Alexander, H., Alm, E.J., Arumugam, M., Asnicar, F., Bai, Y., Bisanz, J.E., Bittinger, K., Brejnrod, A., Brislawn, C.J., Brown, C.T., Callahan, B.J., Caraballo-Rodríguez, A.M., Chase, J., Cope, E.K., Da Silva, R., Diener, C., Dorrestein, P.C., Douglas, G.M., Durall, D.M., Duvallet, C., Edwardson, C.F., Ernst, M., Estaki, M., Fouquier, J., Gauglitz, J.M., Gibbons, S.M., Gibson, D.L., Gonzalez, A., Gorlick, K., Guo, J., Hillmann, B., Holmes, S., Holste, H., Huttenhower, C., Huttley, G.A., Janssen, S., Jarmusch, A.K., Jiang, L., Kaehler, B.D., Kang, K.B., Keefe, C.R., Keim, P., Kelley, S.T., Knights, D., Koester, I., Kosciolek, T., Kreps, J., Langille, M.G.I., Lee, J., Ley, R., Liu, Y.-X., Loftfield, E., Lozupone, C., Maher, M., Marotz, C., Martin, B.D., McDonald, D., McIver, L.J., Melnik, A.V., Metcalf, J.L., Morgan, S.C., Morton, J.T., Naimey, A.T., Navas-Molina, J.A., Nothias, L.F., Orchanian, S.B., Pearson, T., Peoples, S.L., Petras, D., Preuss, M.L., Pruesse, E., Rasmussen, L.B., Rivers, A., Robeson, M.S., Rosenthal, P., Segata, N., Shaffer, M., Shiffer, A., Sinha, R., Song, S.J., Spear, J.R., Swafford, A.D., Thompson, L.R., Torres, P.J., Trinh, P., Tripathi, A., Turnbaugh, P.J., Ul-Hasan, S., van der Hooft, J.J.J., Vargas, F., Vázquez-Baeza, Y., Vogtmann, E., von Hippel, M., Walters, W., Wan, Y., Wang, M., Warren, J., Weber, K.C., Williamson, C.H.D., Willis, A.D., Xu, Z.Z., Zaneveld, J.R., Zhang, Y., Zhu, Q., Knight, R., Caporaso, J.G., 2019, Reproducible, Interactive, Scalable and Extensible Microbiome Data Science Using Qiime 2, Nat. Biotechnol., 37(8), 852-857.
-

- 5. Callahan, B.J., McMurdie, P.J., Rosen, M.J., Han, A.W., Johnson, A.J.A., Holmes, S.P., 2016, Dada2: High-Resolution Sample Inference from Illumina Amplicon Data, Nat. Methods, 13(7), 581-583.
-

- 6. Chen, W.M., Yang, S.H., Young, C.C., Sheu, S.Y., 2013, Arcicella Rigui sp. nov., Isolated from Water of a Wetland, and Emended Descriptions of the Genus Arcicella, Arcicella Aquatica, Arcicella Rosea and Arcicella Aurantiaca, Int. J. Syst. Evol. Microbiol., 63(Pt 1), 134-140.
-

- 7. Cho, B.-W., Lee, B.-D., 2018, Discharge Characteristics of the Chusan Spring, Ulleung Island, J. Soil Groundwater Environ., 23(6), 37-45.
-

- 8. Choi, S.H., 2021, Geochemistry and Petrogenesis of Quaternary Volcanic Rocks from Ulleung Island, South Korea, Lithos, 380, 105874.
-

- 9. Fabbrocino, S., Bellucci Sessa, E., de Vita, S., Di Vito, M.A., Avino, R., Marotta, E., 2022, A Gis-Based Hydrogeological Approach to the Assessment of the Groundwater Circulation in the Ischia Volcanic Island (Italy), Front. Earth Sci., 10.
-

- 10. Fabisch, M., Beulig, F., Akob, D., Küsel, K., 2013, Surprising Abundance of Gallionella-Related Iron Oxidizers in Creek Sediments at pH 4.4 or at High Heavy Metal Concentrations, Front. Microbiol., 4.
-

- 11. Fernandes, A.L., Cruz, J.V., Figueira, C., Prada, S., 2020, Groundwater Chemistry in Madeira Island (Portugal): Main Processes and Contribution to the Hydrogeological Conceptual Model, Environ. Earth Sci., 79(18), 413.
-

- 12. Fimlaid, K.A., Shen, A., 2015, Diverse Mechanisms Regulate Sporulation Sigma Factor Activity in the Firmicutes, Curr. Opin. Microbiol., 24, 88-95.
-

- 13. Griebler, C., Lueders, T., 2009, Microbial Biodiversity in Groundwater Ecosystems, Freshw. Biol., 54(4), 649-677.
-

- 14. Griebler, C., Malard, F., Lefébure, T., 2014, Current Developments in Groundwater Ecology—from Biodiversity to Ecosystem Function and Services, Curr. Opin. Biotechnol., 27, 159-167.
-

- 15. Hallbeck, L., Pedersen, K., 1991, Autotrophic and Mixotrophic Growth of Gallionella Ferruginea, Microbiol., 137(11), 2657-2661.
-

- 16. Hiraishi, A., Hoshino, Y., Satoh, T., 1991, Rhodoferax Fermentans gen. nov., sp. nov., a Phototrophic Purple Nonsulfur Bacterium Previously Referred to as the “Rhodocyclus Gelatinosus-Like” Group, Arch. Microbiol., 155(4), 330-336.
-

- 17. Hwang, S.K., 2014, Rock Series and Petrochemical Classification of the Volcanic Rocks in Ulleung Island, J. Geol. Soc. Korea, 50(1), 61-70.
-

- 18. Hwang, S.K., Ho, K.J., Yundeuk, J., 2017, Volcanism and Petrogenesis of Dodong Basaltic Rocks in the Ulleung Island, East Sea, J. Petrol. Soc. Korea, 26(4), 361-371.
- 19. Im, J.H., Choo, C.O., 2015, A Study on Tree-Ring Dating and Speciation of Charcoal Found in Pumiceous Deposit of the Quaternary Nari Caldera, Ulleung Island, Korea, Econ. Environ. Geol., 48(6), 501-508.
-

- 20. Im, J.H., Shim, S.H., Choo, C.O., Jang, Y.D., Lee, J.S., 2012, Volcanological and Paleoenvironmental Implications of Charcoals of the Nari Formation in Nari Caldera, Ulleung Island, Korea, Geosci. J., 16(2), 105-114.
-

- 21. Jogler, M., Chen, H., Simon, J., Rohde, M., Busse, H.J., Klenk, H.P., Tindall, B.J., Overmann, J., 2013, Description of Sphingorhabdus Planktonica gen. nov., sp. nov. and Reclassification of Three Related Members of the Genus Sphingopyxis in the Genus Sphingorhabdus gen. nov, Int. J. Syst. Evol. Microbiol., 63(Pt 4), 1342-1349.
-

- 22. Jones, D.S., Kohl, C., Grettenberger, C., Larson, L.N., Burgos, W.D., Macalady, J.L., 2015, Geochemical Niches of Iron-Oxidizing Acidophiles in Acidic Coal Mine Drainage, Appl. Environ. Microbiol., 81(4), 1242-1250.
-

- 23. Kang, H., Kim, H., Joung, Y., Jang, T.Y., Joh, K., 2015, Ferruginibacter Paludis sp. nov., Isolated from Wetland Freshwater, and Emended Descriptions of Ferruginibacter Lapsinanis and Ferruginibacter Alkalilentus, Int. J. Syst. Evol. Microbiol., 65(Pt_8), 2635-2639.
-

- 24. Kang, J.Y., Chun, J., Jahng, K.Y., 2017, Uliginosibacterium Flavum sp. nov. Isolated from an Artificial Lake, J. Microbiol., 55(8), 595-599.
-

- 25. Kim, C.-S., Lee, J., Koh, Y.-K., Bae, D.-S., Park, M.-E., 2000, Isotopic and Geochemical Characteristics of Carbonated Water in the Ulleungdo Region. Korean Society of Soil and Groundwater Environment, pp. 158-158.
-

- 26. Kim, C.H., Park, J.W., Lee, M.H., Park, C.H., 2013, Detailed Bathymetry and Submarine Terraces in the Coastal Area of the Dokdo Volcano in the Ulleung Basin, the East Sea (Sea of Japan), J. Coast. Res., 65(sp1), 523-528, 526.
-

- 27. Kim, K.B., Lee, G.D., 2008, A Study on Volcanic Stratigraphy and Fault of Ulleung-Do, Korea, J. Eng. Geol., 18(3), 321-330.
- 28. Kirs, M., Kisand, V., Nelson, C.E., Dudoit, T., Moravcik, P.S., 2020, Distinct Bacterial Communities in Tropical Island Aquifers, PLoS One, 15(4).
-

- 29. Korbel, K., Chariton, A., Stephenson, S., Greenfield, P., Hose, G.C., 2017, Wells Provide a Distorted View of Life in the Aquifer: Implications for Sampling, Monitoring and Assessment of Groundwater Ecosystems, Sci. Rep., 7(1), 40702.
-

- 30. Kwon, S.W., Kim, B.Y., Weon, H.Y., Baek, Y.K., Go, S.J., 2007, Arenimonas Donghaensis gen. nov., sp. nov., Isolated from Seashore Sand, Int. J. Syst. Evol. Microbiol., 57(Pt 5), 954-958.
-

- 31. Lee, B., Han, M., Ryoo, C.-r., Cho, B.-w., 2024, Hydrogeological Controls on the Discharge Rate of Choosan Spring in the Nari Basin of Ulleung Island, South Korea, J. Eng. Geol., 34(1), 13-24.
-

- 32. Lee, B.D., Cho, B.W., Choo, C.O., 2018a, The Hydrochemistry of Chusanyongchulso Spring, Cheonbu-Ri, Buk-Myeon, Northern Ulleung Island, J. Eng. Geol., 28(4), 565-582.
-

- 33. Lee, J.-H., Lee, B.-J., Unno, T., 2018b, Bacterial Communities in Ground-and Surface Water Mixing Zone Induced by Seasonal Heavy Extraction of Groundwater, Geomicrobiol. J., 35(9), 768-774.
-

- 34. Ma, Z., Gao, L., Sun, M., Liao, Y., Bai, S., Wu, Z., Li, J., 2022, Microbial Diversity in Groundwater and Its Response to Seawater Intrusion in Beihai City, Southern China, Front. Microbiol., 13.
-

- 35. Méndez-García, C., Peláez, A.I., Mesa, V., Sánchez, J., Golyshina, O.V., Ferrer, M., 2015, Microbial Diversity and Metabolic Networks in Acid Mine Drainage Habitats, Front. Microbiol., 6, 475.
-

- 36. Novak Babič, M., Gostinčar, C., Gunde-Cimerman, N., 2020, Microorganisms Populating the Water-Related Indoor Biome, Appl. Microbiol. Biotechnol., 104(15), 6443-6462.
-

- 37. O’Sullivan, L.A., Rinna, J., Humphreys, G., Weightman, A.J., Fry, J.C., 2006, Culturable Phylogenetic Diversity of the Phylum ‘Bacteroidetes’ from River Epilithon and Coastal Water and Description of Novel Members of the Family Flavobacteriaceae: Epilithonimonas Tenax gen. nov., sp. nov. and Persicivirga Xylanidelens gen. nov., sp. nov, Int. J. Syst. Evol. Microbiol., 56(1), 169-180.
-

- 38. Oh, Y., Kim, D.-H., Lee, S.-H., Sun, M.H., Cho, S.Y., 2020, Determining Characteristics of Groundwater Inflow to the Stream in an Urban Area Using Hydrogeochemical Tracers (222Rn and Major Dissolved Ions) and Microbial Community Analysis, J. Soil Groundwater Environ., 25(2), 16-23.
-

- 39. Okuno, M., Shiihara, M., Torii, M., Nakamura, T., Kim, K.H., Domitsu, H., Moriwaki, H., Oda, M., 2010, AMS Radiocarbon Dating of Holocene Tephra Layers on Ulleung Island, South Korea, Radiocarbon, 52(3), 1465-1470.
-

- 40. Pandey, P.K., Kass, P.H., Soupir, M.L., Biswas, S., Singh, V.P., 2014, Contamination of Water Resources by Pathogenic Bacteria, AMB Express, 4, 51.
-

- 41. Patel, C.B., Shanker, R., Gupta, V.K., Upadhyay, R.S., 2016, Q-PCR Based Culture-Independent Enumeration and Detection of Enterobacter: An Emerging Environmental Human Pathogen in Riverine Systems and Potable Water, Front. Microbiol., 7.
-

- 42. Peyraud, R., Schneider, K., Kiefer, P., Massou, S., Vorholt, J.A., Portais, J.-C., 2011, Genome-Scale Reconstruction and System Level Investigation of the Metabolic Network of Methylobacterium Extorquens AM1, BMC Syst. Biol., 5(1), 189.
-

- 43. Piper, A.M., 1944, A Graphic Procedure in the Geochemical Interpretation of Water-Analyses, Eos, Trans. Am. Geophys. Union, 25(6), 914-928.
-

- 44. Rock, C., Donnenberg, M.S., 2014. Human Pathogenic Enterobacteriaceae, Reference Module in Biomedical Sciences. Elsevier.
-

- 45. Sang, S., Zhang, X., Dai, H., Hu, B.X., Ou, H., Sun, L., 2018, Diversity and Predictive Metabolic Pathways of the Prokaryotic Microbial Community Along a Groundwater Salinity Gradient of the Pearl River Delta, China, Sci. Rep., 8(1), 17317.
-

- 46. Schaffter, N., Parriaux, A., 2002, Pathogenic-Bacterial Water Contamination in Mountainous Catchments, Water Res., 36(1), 131-139.
-

- 47. Shaffer, M., Thurimella, K., Sterrett, J.D., Lozupone, C.A., 2023, SCNIC: Sparse Correlation Network Investigation for Compositional Data, Mol. Ecol. Resour., 23(1), 312-325.
-

- 48. Sharan, A., Lal, A., Datta, B., 2021, A Review of Groundwater Sustainability Crisis in the Pacific Island Countries: Challenges and Solutions, J. Hydrol., 603, 127165.
-

- 49. Song, Y.-S., Park, M.-E., Park, K.-H., 2006, Ages and Evolutions of the Volcanic Rocks from Ulleung-Do and Dok-Do, J. Pet. Soc.Korea, 15(2), 72-80.
- 50. Stiff, H.A., Jr., 1951, The Interpretation of Chemical Water Analysis by Means of Patterns, J. Pet. Technol., 3(10), 15-13.
-

- 51. Thomas, F., Hehemann, J.-H., Rebuffet, E., Czjzek, M., Michel, G., 2011, Environmental and Gut Bacteroidetes: The Food Connection, Front. Microbiol., 2, 93-93.
-

- 52. Urish, D.W., 2012. Island Groundwater: A Limited and Vulnerable Resource, World Environ. Water Resour. Congr., 2010, pp. 795-805.
-

- 53. Yan, S., Fuchs, B.M., Lenk, S., Harder, J., Wulf, J., Jiao, N.Z., Amann, R., 2009, Biogeography and Phylogeny of the Nor5/Om60 Clade of Gammaproteobacteria, Syst. Appl. Microbiol., 32(2), 124-139.
-

- 54. Yun, H.S., Kim, Y.S., Yoon, H.S., 2019, Illumina Miseq Analysis and Comparison of Freshwater Microalgal Communities on Ulleungdo and Dokdo Islands, Pol. J. Microbiol., 68(4), 527-539.
-

- 55. Yun, H.S., Lee, J.H., Choo, Y.S., Pak, J.H., Kim, H.S., Kim, Y.S., Yoon, H.S., 2022, Environmental Factors Associated with the Eukaryotic Microbial Diversity of Ulleungdo Volcanic Island in South Korea, Microbiol., 91(6), 801-817.
-

- 56. Zeng, X., Hosono, T., Matsunaga, M., Ohta, H., Niidome, T., Shimada, J., Morimura, S., 2017, Spatial Distribution of Microbial Communities in the Alluvial Aquifer Along the Oyodo River, Miyakonojo Basin, Japan, J. Water Environ. Technol., 15(4), 152-162.
-

- 57. Zhang, B., Wu, X., Tai, X., Sun, L., Wu, M., Zhang, W., Chen, X., Zhang, G., Chen, T., Liu, G., Dyson, P., 2019, Variation in Actinobacterial Community Composition and Potential Function in Different Soil Ecosystems Belonging to the Arid Heihe River Basin of Northwest China, Front. Microbiol., 10.
-

- 58. Zhang, Q., Wu, J., Yang, F., Lei, Y., Zhang, Q., Cheng, X., 2016, Alterations in Soil Microbial Community Composition and Biomass Following Agricultural Land Use Change, Sci. Rep., 6(1), 36587.
-

- 59. Zhou, N., Keffer, J.L., Polson, S.W., Chan, C.S., 2022, Unraveling Fe(II)-Oxidizing Mechanisms in a Facultative Fe(II) Oxidizer, Sideroxydans Lithotrophicus Strain ES-1, via Culturing, Transcriptomics, and Reverse Transcription-Quantitative PCR, Appl. Environ. Microbiol., 88(2), e01595-01521.
-

 This Article
This Article
-
2024; 29(3): 1-13
Published on Jun 30, 2024
- 10.7857/JSGE.2024.29.3.001
- Received on May 20, 2024
- Revised on Jun 2, 2024
- Accepted on Jun 24, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Byeong Dae Lee
-
Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources, Daejeon, 34132, Republic of Korea
- E-mail: donghun@kigam.re.kr