- Effects of Soil Amendment on Reclaimed Soil Health Enhancement assessed by Soil Enzyme Activities and Germination/Seedling Growth of Lentil (Lens culinaris)
Hyesun ParkㆍBumhan Bae*
Department of Civil & Environmental Engineering, Gachon University
- 토양효소활성과 렌틸 발아/생장으로 평가한 토양첨가제의 정화 처리토 건강성 증진 효과
박혜선ㆍ배범한*
가천대학교 토목환경공학과
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
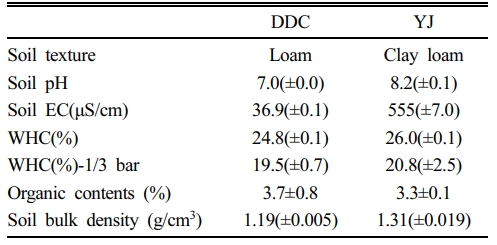
Soil amendments are often used to improve the soil health of recalimed soil that has lost its value and is only used for road backfill of landfill cover. In total, 10 soil amendments were tested on two types of soil, that is, landfarming-treated DDC soil and thermally treated YJ soil. The 10 amendments were vermicompost (VC), peat moss (PM), chicken manure (CM), EM product (EM), chlorella (CCR), biochar (BC), compound fertilizer (CF), zeolite (ZL), dolomite lime (DL), and gypsum (GS). After 10 weeks of incubation with 5% (W/W) of the amendment, 7 soil enzyme activities along with germination and seedling growth of lentil were compared to the control. The results showed that the organic amendments CM and CR significantly enhanced the soil enzyme activities in both the DDC and YJ soils. However, the VC amendment in both types of soils best enhanced the germination and growth of lentils. Furthermore, even after 10 weeks of incubation with the amendment, plant stress and soil infertility, as indicated by the specific root length (SRL), still persisted despite the addition of soil amendment materials. These results suggest that a longer duration than 10 weeks is necessary for amendments to take effect on soil health enhancement.
Keywords: Amendment, Lentil, Reclaimed soil, Soil enzyme, Soil health
토양건강성은 생물과 미생물의 생명을 유지하고, 영양물질을 순환하며, 생명의 기본 필요재료인 식량, 사료, 섬유, 연료 및 거주지를 공급함과 동시에 수질 및 대기질을 보전하는 토양의 동적인 생명유지 상태를 일컫는다(Karlen et al., 2019). 건강한 토양을 유지하기 위해서는 생산자인 식물과 분해자인 토양미생물에 의한 유기물과 영양물질의 축적과 순환이 활발하여 높은 생산성을 유지하고, 인간과 육상 및 수생태계 생물의 생명유지에 필요한 에너지원인 식량과 사료가 공급되어야 할 것이다. 따라서 토양 유실 및 오염을 방지하고, 오염된 토양을 정화하여 원토양으로 되돌리는 작업은 건강한 자연환경과 생태서비스를 유지하는 데 필수적이다.
그러나 오염처리토양은 처리 공정과정에 영향을 받아 원토양의 물리화학적 및 생물학적 특질이 변화하여(Lee et al., 2020), 처리 후에도 원토양으로 환원되지 않고 대부분 복토재 혹은 성토재로 사용되고 있다(Han et al., 2020). 토양을 열처리하면 고온 소성으로 인해 미생물은 사멸하며, 토양유기물 분해에서 생성된 알칼리 양이온과 이온성 물질 증가로 인하여 pH와 EC가 처리온도에 비례하여 증가한다(O'Brien et al., 2018). 생물학적 처리법인 토양경작법에서도 미생물 활성은 증가하지만, 분해과정에서 유기물 및 질소를 사용하여 영양물질의 손실이 발생할 뿐 아니라(Besalatpour et al., 2011) 미생물군의 천이로 인해 처리토의 원토양과는 다른 미생물군이 생성된다(Bergsveinson et al., 2019). 건강성이 손상되면 유식물 생장및 작물 생산성 감소로 수확이 줄어들어 환경적으로 유해하며, 사회경제적 손실이 유발된다(Pape et al., 2015). 예를 들어 토양건강성 악화는 도시 농업에서 상추(Lactuca sativa) 수확감소로 이어졌고(Knight et al., 2013), 토양생태기능 악화를 야기하여 토양 독성물질 저감 지연, 토양수분 보유량 감소, 병원균 억제 및 토양관리비용 증가 등과 같이 지속가능성이 훼손되었다(Doran and Zeiss, 2000).
농업에서는 작물 생산성을 높이기 위해 토양에 각종 유기 및 무기 첨가제를 투입하며, 정화 과정에서 유출되거나 변질된 토양 질의 개선에도 첨가제가 사용되었다. 첨가제는 유실된 토양성분을 보충하고 훼손된 건강성을 회복하는 직접적이고 신속한 방법이다. 대표적인 물질로는 화학물질 및 비료이외에도 각종 퇴비(Dissanayake and Hoy, 1999), 계분(Riegel and Noe, 2000), 하수 슬러지(Garcia-Gil et al., 2004)등이 있고, 근래에는 바이오차(Garbuz et al., 2021; Zhao and Naeth, 2022), 휴믹질(Deng et al., 2021; Zhao and Naeth, 2022) 및 굴폐각(Huang et al., 2022)등을 사용하였다. Lee et al.(2022)는 TPH 오염을 처리한 토양에 10종의 첨가제를 농도별로 첨가하고 숙성한 다음 토양효소 및 토양의 물리화학적 특성변화를 통계적으로 분석한 결과, 첨가제량이 증가할수록 처리토양의 제반 특성이 향상되지만, 2.5~5%만 첨가해도 토양 특성 향상에 충분하다고 보고하였다.
토양 건강성을 판단하는 지표로 토성, 입단성, 보수력, 공극율, 용적밀도, 양이온 교환능, 총인 및 총질소, 영양물질, 유기물 함량 등이 있으나 외부 입력값에 대한 변화가 매우 느린 단점이 있다. 반면 토양식생체량, 토양효소활성 및 토양호흡율 등은 짧은 시간에 변화하고 신속하게 측정할 수 있는 유용한 지표이다(Cardoso et al., 2013). 토양효소활성은 토양미생물에 의한 물질 순환을 측정하는 지표로, 외부에서 투입된 기질 및 영양물질에 대한 토양미생물군의 반응과 구조를 신속하게 관측할 수 있는 지표이다(Reinersmann et al., 2023). 또한 식물의 발아 및 생장은 토양 건강성을 판단하는 데 매우 중요한 지표로, 발아율, 지상부 및 지하수 생체량으로 토양유효독성을 산정하고 있다(OECD, 2003). 식물생장을 실험하기 위해서 다량의 토양과 많은 공간 및 식물체 분석에 인력이 소요되었으나, 렌틸(Lens culinaris) 재배 및 사진에 의한 근권 분석을 이용하면 다량의 시료를 짧은 시간 내에 분석할 수 있다(Park et al., 2021).
이에 본 연구에서는 2종의 처리토에 10종의 첨가제를 각각 투입하고 일정한 조건에서 후숙한 다음, 토양의 물리화학적 특성과 토양효소활성 변화를 측정하고, 후숙토양에서의 렌틸 유식물의 발아 및 생장을 대조군과 비교하여 첨가제가 처리토의 건강성 향상에 미치는 영향을 분석하였다.
2.1. 토양 제조
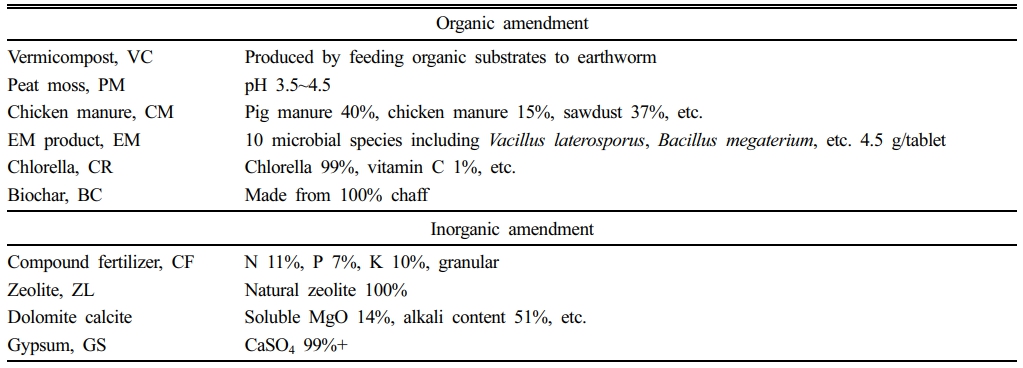
실험에 사용한 2종 토양은 TPH 오염토양을 토양경작법으로 처리한 토양(DDC soil)과 열탈착 처리한 토양(YJ soil)으로, 그 특성은 Table 1과 같이 DDC 토양은 양토이고, YJ토양은 식양토이었다. 토양에 첨가한 첨가제는 분변토(vermicompost, VC), 피트모스(peat moss, PM), 계분퇴비(chicken manure, CM), EM 제제(EM product, EM), 클로렐라(chlorella, CR), 바이오차(biochar, BC)의 유기성 첨가제 6종과 복합비료(compound fertilizer, CF), 제올라이트(zeolite, ZL), 석회고토(dolomite lime, DL), 석고(gypsum, GS)의 무기성 첨가제 4종이었다(Table 2).
플라스틱 화분을 2겹으로 한 다음, 2종 토양을 각각 720 ± 5 g씩 2배수로 담고 10종의 첨가제를 각각 건조중량비로 5%씩 투입하였다. 단, EM제제는 물에 희석하여 주입하는 미생물농축제제로 중량이 아닌 활성도가 중요하므로 1정(4.5 g)만 투입하였다. 이와 동시에 무첨가군(Control)도 동일하게 실험하였다. 첨가제를 주입한 토양에 증류수를 주입하여 수분함량을 25%로 조절하고 충분히 혼합한 다음, 입구를 닫지 않은 상태로 식물생장상에서 10주간 배양하였다. 배양 조건은 온도 25°C, 습도 60%, 낮 18시간/밤 6시간이며, 배양을 종료할 때까지 7일 간격으로 증류수를 첨가하고 혼합하여 수분함량이 일정하게 유지되도록 하였다.
2.2. 화분 실험
2.2.1. 종자 선별 및 전처리
대상 식물로는 직근을 가진 쌍떡잎 대표식물로 렌틸을 선정하였는데, 렌틸은 널리 재배될 뿐 아니라(Wani et al., 2008) 종자의 발아율이 높고, 1차뿌리(primary root)가 굵고 뿌리털이 거의 없어 온전한 상태로 수확할 수 있기 때문이다. 냉장고(4oC)에서 보관한 렌틸 종자(해들원)는 모양과 색이 일정하고 손상되지 않은 것을 골라 비중선별한 다음, 발아를 일정하게 하기 위해 멸균 증류수에 1일간 침지한 다음 파종하였다.
2.3. 렌틸 화분 준비 및 파종
숙성이 종료된 토양은 건조되면서 판상으로 굳는 현상이 관측되어 굳어있는 부분은 스테인리스 막자와 사발로 분쇄한 다음 실험에 사용하였다. 렌틸 재배의 대조군으로는 원예상토(농우바이오)를 사용하였다. 화분은 50 mL Falcon vial 하단에 2개의 직경 3 mm 배수 구멍을 뚫은 다음, 자중으로 다짐하면서 토양을 넣었다. 최종 토량은 대조군, 첨가제 투입 토양이 각각 18 ± 2 g, 70 ± 5 g 이었으나, 첨가제 투입 토양 중에서 YJ-BC토양은 60 ± 5 g, DDC-PM 및 DDC-BC토양은 65 ± 5 g이었다. 각 화분은 8배수로 준비하고 화분걸이에 고정한 다음, 배수 구멍으로 물이 빠질 때까지 증류수를 부어주었다. 토양에 수분이 충분히 스며들면 화분 중앙부에 1.0 cm 깊이로 종자를 심고 주변 흙으로 종자를 덮은 후, 식물생장상에서 배양하였다. 배양 조건은 토양 숙성과 동일하게 온도 25°C, 습도 60%, 낮 18시간/밤 6시간으로 하였고, Apogee Quantum Flux Meter MQ-200로 토양 표면에서 측정한 PAR (Photosynthetically Active Radiation)은 130~140 μmol/m2-s 이다. 배양을 종료할 때까지 2일 간격으로 증류수를 충분히 부어주며 생장을 관찰하였다.
2.4. 분석방법
2.3.1.식물체 수확 및 관측
배양 8일차에 실험을 종료하고 식물을 수확하였다. 뿌리를 분리할 때 뿌리의 손상을 최소화하기 위해 물을 채운 수조에 화분을 한 시간 이상 넣어서 배수 구멍을 통해 물이 스며들 수 있도록 하였다. 포트에서 흙을 분리하여 체에 올리고 살수하여 뿌리에서 작은 흙 입자까지 깨끗이 세척하였다. 뿌리가 마르지 않게 물을 담은 페트리디시(square dish 245 mm × 245 mm × 28 mm)에 식물체를 두고 일정 높이에 연직으로 고정한 카메라(Canon G7 × Mark II)로 촬영하였고, 이미지 해상도는 5472 × 3648 DPI(Dots per Inch)이었다. 수확한 식물체는 생체량 측정을 위해 총중량 측정 후, 절단하여 뿌리와 지상부를 나누어 뿌리 무게를 측정하였다. 이때 뿌리의 기준을 렌틸 종자의 아래 부분으로 하였고, 지상부는 생체량 측정 후 Chl.-a와 carotenoid를 측정하는 데에 사용하고, 뿌리는 70°C에서 48시간 동안 건조한 후 건조 중량을 측정하였다.
2.3.2.클로로필 a 및 Carotenoid 측정
지상부는 갈색 유리병에 담고, 80% 아세톤 20 mL를 넣은 다음, PTFE 라이너가 있는 캡으로 밀봉하여 1일간 냉장(4oC) 보관하였다. 이후 갈색 유리병에 담긴 렌틸 지상부와 아세톤을 50 mL conical tube에 옮기고, 80% 아세톤 10 mL로 갈색병을 세척하여 남김없이 conical tube로 옮긴 다음, 균질기(Polytron PT 2500E)로 분쇄하였다. 분쇄기에 남은 잔여물을 80% 아세톤과 핀셋을 이용하여 50 mL conical vial에 넣고, 80% 아세톤을 첨가하여 최종부피를 50 mL로 하였다. 분쇄 시 용액의 온도가 상승하지 않도록, 얼음욕조에 conical tube를 넣어 분쇄하였다. 추출한 지상부 Chl.-a와 carotenoid는 다음과 같이 측정하였다. 아세톤 추출 시료를 0.2 μm PTFE 필터(Whatman)로 여과하여 석영 큐벳에 넣고, 470, 647 및 663 nm에서의 흡광도를 측정하고 계산식 (1)~(4)에 의해 각각의 농도를 산정하였다(Lichtenthaler, 1987).
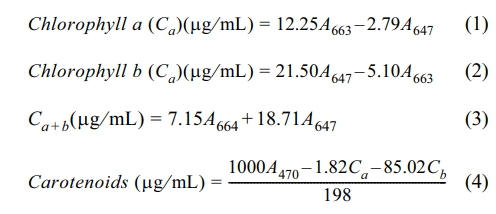
2.3.3.뿌리 길이 및 부피 측정
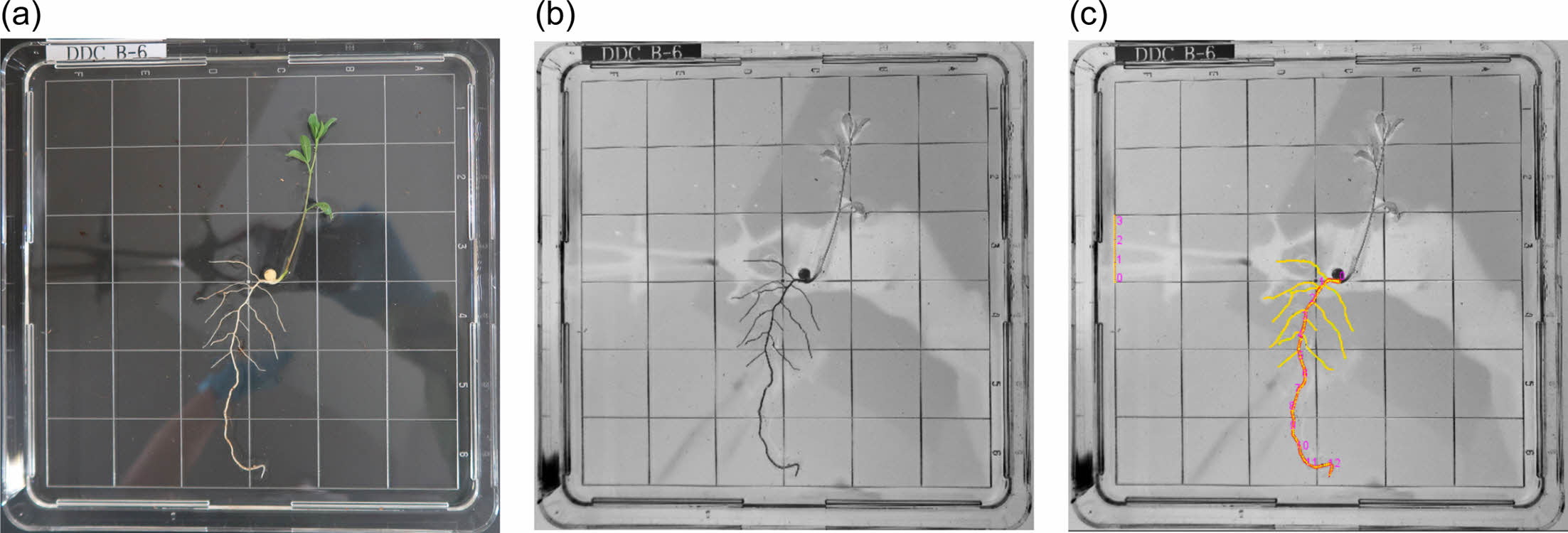
뿌리 길이와 부피 측정법은 다음과 같다. 사진 포맷을 Image J(Schneider et al., 2012) 프로그램으로 8 비트 RGB로 변환하고, SmartRoot 프로그램(Lobet et al., 2011)으로 변환된 이미지를 읽었다. 축척에 해당하는 픽셀수와 1차근 및 측근(lateral root) 뿌리의 시작점을 지정하면, 프로그램이 음영을 기준으로 픽셀단위로 식물 뿌리를 인식하고, 뿌리 길이, 두께 및 부피를 계산하였다. 이 자료를 바탕으로 SRL(Specific Root Length)를 산정하였는데, 이는 단위중량당 뿌리 길이로 식물생체 건강성 및 스트레스, 토양 비용도를 간접측정 지표이다(Eissenstat, 1991; Kramer-Walter et al., 2016).
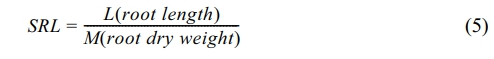
2.3.4.토양의 물리화학적 특성 및 토양효소 측정
용적밀도, 토양수분함량(보수력), 유기물함량을 NIFS(2014) 방법에 의거하여 2배수로 측정하였다. 토양 pH 및 EC는 토양:증류수(1:5) 방법으로 측정하였고 토성은 피펫법, 유기물함량은 강열감량법으로 측정하였다.
토양효소활성은 모두 7종을 측정하였다. 탄소순환에 관여하는 β-glucosidase(BG), 탄소 및 질소순환에 연관된 N-acetyl-D-glucosaminidase(NAG), 인 순환 관련 acid 및 alkaline phosphatase(Pase_a 및 Pase_alk)과 황 순환에 영향을 주는 Arylsulfatase(AS)는 Stott(2019)이 추천하는 방법을 사용하였다. 상기 방법은 모두 효소반응산물인 PNP(para-nitrophenol) 측정으로 활성도를 평가한다. DHA(dehydrogenase activity)는 Pepper and Gerba(2004)방법으로 측정하였고, 토양 Urease는 Kandeler and Gerber(1988)의 방법으로 측정하였는데, 습윤 토양으로 실험하고, 동시에 측정한 함수량으로 보정하였다.
3.1.물리화학적 특성 변화
식물생장상에서 10주 숙성한 경우, 첨가물을 넣지 않은 대조군(Control)에서는 DDC 토양 pH가 6.23으로 감소하였으나, 용적밀도는 변화하지 않았다. 용적밀도가 낮은 물질인 PM 및 BC 처리구에서 2종의 토양 모두에서 약 0.2 g/cm3 정도의 용적밀도가 감소하였다. YJ 토양의 CM 및 CR 처리구에서는 0.1 g/cm3 정도가 감소하였다. 이를 제외하고 DDC 토양에서는 전반적으로 용적밀도가 증가하였고, YJ 처리구에서는 소폭 감소하는 경향을 보였다(Table 3). 토양 pH에서도 첨가제 및 토양에 따라 큰 차이가 있었다. DDC 토양에서는 CR과 CM 처리구에서는 pH가 각각 8.98 및 8.23으로 증가했으나, 산성물질인 PM과 VC 처리구에서는 pH가 6.0이하로 감소했고, 무처리구에서도 토양 pH가 6.35로 감소하였다. 반면, YJ 토양에서는 산성물질인 PM 처리구를 포함하여 모든 처리구에서 pH가 증가하였다. 따라서 열탈착 처리토의 토양건강성 회복을 위해서는 사전에 pH 중화를 위한 약품 투입이 필요할 것으로 판단된다. 토양 pH 완충능은 유기물 산성기 배출, 탄산염 용해, 점토의 이온교환 등 다양한 요인에 영향을 받는다(Nelson and Su, 2010). 토양경작법 처리에 중성 pH 유지를 위해 종종 석회처리가 필요한 것과 같이(US EPA, 2017), DDC 토양은 경작 과정에서 완충능 감소 및 숙성 과정에서 산성 유기산 생성 등으로 인해 pH가 첨가제 투입에 민감하게 반응한 것이라 판단된다. 반면, YJ 토양은 염기성 양이온 및 이온농도가 높아 pH 변화가 없거나 증가한 것으로 판단된다.
3.2. 토양효소활성 변화
토양효소활성 측정 결과, 토양과 첨가제에 따라 큰 차이를 보였다. DDC 토양에서 DHA는 무처리구에서 4.0 mgTPF/g-soil이었으나, 유기질 및 무기질 처리군에서 각각 2.0~1132 및 80~94 mgTPF/g-soil로 크게 변화하여 첨가제에 의한 영향이 매우 큰 것을 알 수 있다(Table 4). 여기서 CR의 DHA가 매우 큰 값을 보인 것은 성분에 1% 포함되어 있는 vitamin C가 환원제로 작용하여 DHA와 동일한 탈수소 반응을 하였기 때문이다(Borsook and Keighley, 1933). 이 결과는 YJ 토양에서도 동일하였다.
DDC 토양의 PM 첨가구에서는 초기 대비 50%가 감소한 결과를 보였는데, 산성토양에서 활발한 P_a 활성이 증가한 것으로 보아, PM에 의한 pH 감소가 주원인이라 판단된다. 또한, 토양 피트 농도와 DHA 활성이 반비례한다는 다른 보고와도 일치한다(Blonska, 2010). BG는 유기질 처리군에서 22~68 mgPNP/g-soil-hr로 무기질 처리군의 18~38 mgPNP/g-soil-hr보다 높은 경향을 보였다. 동일하게 NAG, P_a 및 P_alk 및 AS에서도 전반적으로 유기질 처리구가 더 높은 경향을 보였다. DDC 토양의 Urease는 CR > BC > DL 다음으로 대조구에서 26.3 mgNH4+ produced/g-soil-hr으로 높은 값을 보였다. YJ 토양에서의 처리구별 토양효소활성 결과는 Table 5와 같다. DHA는 대조군 4.0 mgTPF/g-soil에 비해 처리구에서는 81~2416 mgTPF/g-soil이었으며, vitamin C를 포함하는 CR을 제외하면 약 30배 정도 증가하였다. 그러나 나머지 토양효소활성은 각각의 첨가제별로 큰 차이를 보였다. 전반적으로 CM 및 CR 처리구에서 DHA를 제외한 6종 토양효소활성이 높은 값을 보인 반면, 다른 처리구에서는 토양효소활성이 대조군 대비 동일한 수준을 유지하거나 낮아진 경우도 있었다.
토양효소활성은 pH에 민감하게 반응하고, BG, Urease, P_alk 등은 토양 pH에 정비례하는 것으로 보고되었으나(Acosta-Martinez and Tabatabai, 2000), 본 연구 결과에서는 토양 pH와 효소활성사이의 상관계수(r2 < 0.2)가 매우 낮았다(data not shown). 원인으로는 짧은 숙성기간에 따른 유/무기질 안정화 부족, 식생 부재에 의한 주요 미네랄 정체 등이 있을 것으로 사료된다.
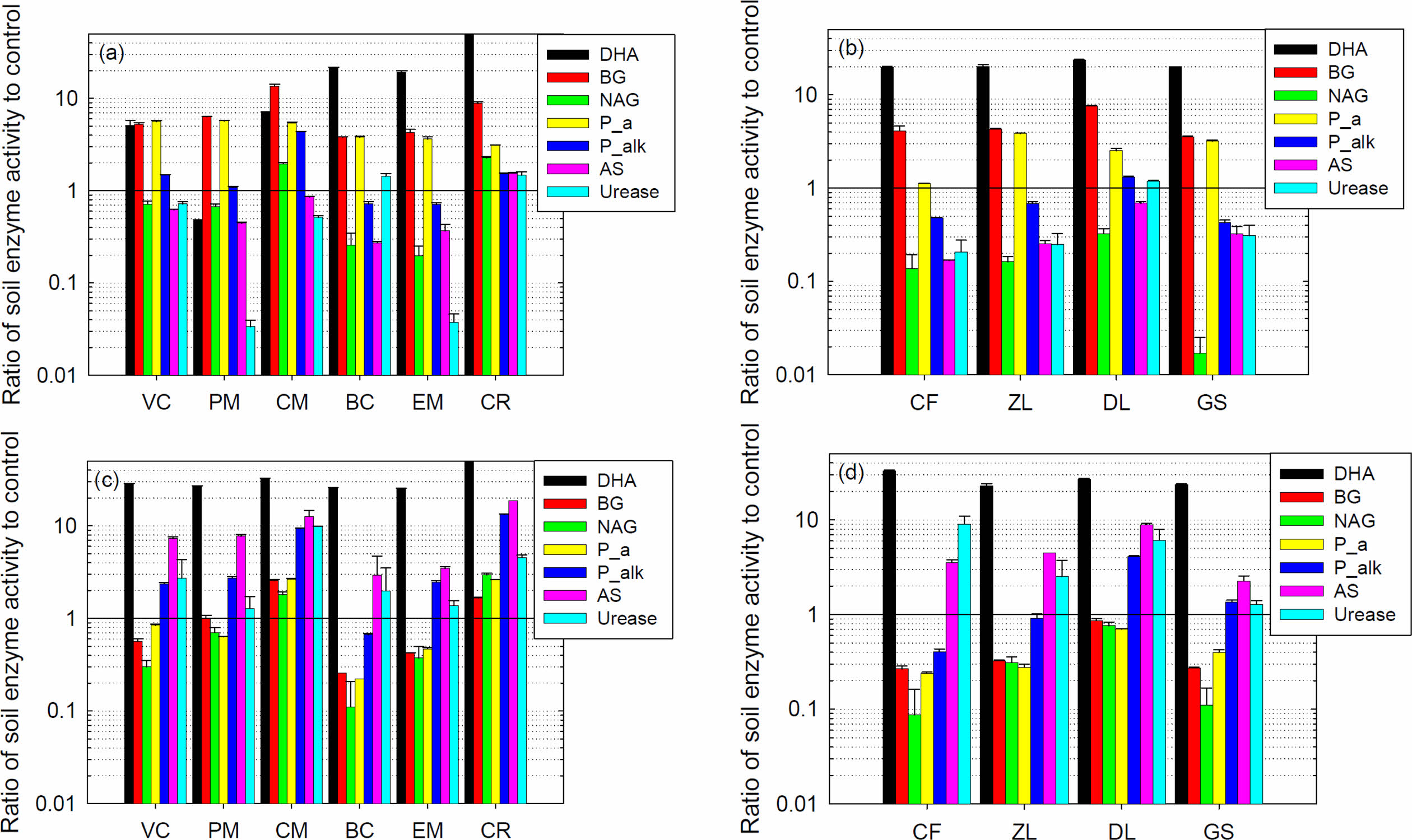
DDC 및 YJ 토양에 대한 첨가제 별 효과를 비교하기 위해 토양효소활성을 대조군의 값으로 나누어 표시하면 Fig. 1과 같다. DDC 토양에서는 유기성 첨가제에서의 BG, P_a 및 P_alk가, 무기성 첨가제 처리구에서는 DHA, BG 및 P_a가 모두 대조구보다 높았다. YJ 토양에서는 모든 첨가제 처리구에서 DHA가 대조군 대비 약 25배 이상으로 균일하게 증가하였고, 유기성 첨가제 처리구에서는 P_alk, AS 및 Urease 증가가 현저하였다. YJ 토양의 모든 무기성 첨가제 처리구에서는 AS 및 Urease 활성이 대조구보다 높았다. 토양효소활성은 각 토양 고유의 물리적, 화학적, 생물학적 및 미생물학적 특성에 의해 결정되며, 토양의 유기물량, 조성, 생물체의 활성 및 생물공정의 강도 등에 영향을 받는다(Das and Varma, 2011). 따라서 각 첨가제의 정확한 조성, 특히 유기성 첨가제 및 첨가제 내의 생물활성에 대한 정보가 없는 상태에서 토양효소활성의 변화를 예측하거나 설명하기는 매우 어렵다. 다만 전반적 추세에 의하면 유기성 첨가제는 토양의 C 및 P 순환을 증진하는 효과가 확인되었고, 무기성 첨가제에서는 Urease 및 AS의 활성증가가 관측되었다.
측정한 7종의 토양효소 중에서 BG는 토양에서 공통적으로 발견되며 지배적인 효소로 식물 잔재물에 있는 β-glucosides를 분해할 뿐 아니라, 식물 및 미생물에 널리 분포하고 있다. 또한 과거의 생물학적 활동을 반영하고, 토양유기물 안정화의 용량을 나타내며, 토양관리의 효과를 관측하는데 유용하므로 토양질의 지표로 사용되고 있다(Utobo and Tewari, 2015). 북미 평원 지역의 다양한 62지점 토양에 대한 물리화학적, 생물학적 및 생화학적 특성과 작물 수확량을 PCA(Principal Component Analysis)분석한 결과, BG가 토양의 제반 특성을 가장 잘 표현하는 주성분이고, 그 다음이 NAG이었다(Sainju et al., 2022). 이에 BG를 주로 하여 첨가물의 건강성 회복을 판단하면 DDC 토양에서는 CM > CR > DL > PM > VC > ZL = EM > CF > BC > GS의 순이고, YJ 토양에서는 CM > CR > PM > DL > VC > EM > ZL > CF = GS > BC의 순이었다. 두 토양 모두 CM과 CR에 의한 BG 증진이 가장 높았다. Fig. 2
3.3. 렌틸 발아 및 유식물 생장
본 연구에서 대조군(Control)인 원예상토에 파종한 렌틸 종자는 8개 중에서 7개가 발아하였다. DDC 토양에 각각 8개씩 파종한 렌틸 종자는 처리구 별로 PM 6, VC 3, CM 2, EM 2, ZL 1 및 DL 1개가 발아하였다. YJ 토양에 파종한 렌틸은 처리구 별로 CM 4, BC 4, PM 2 및 CF 2개가 발아하여, DDC 토양보다 더욱 낮았다. 식물종자의 발아율은 토양건강성을 판단하는 유용한 매개변수로 건강성이 양호할수록 발아율이 높다(Khati et al., 2007; Premalatha et al., 2021). 따라서 발아율이 낮은 토양은 첨가제를 투입하고 후숙하였음에도 불구하고, 토양건강성이 개선되지 않았음을 의미한다.
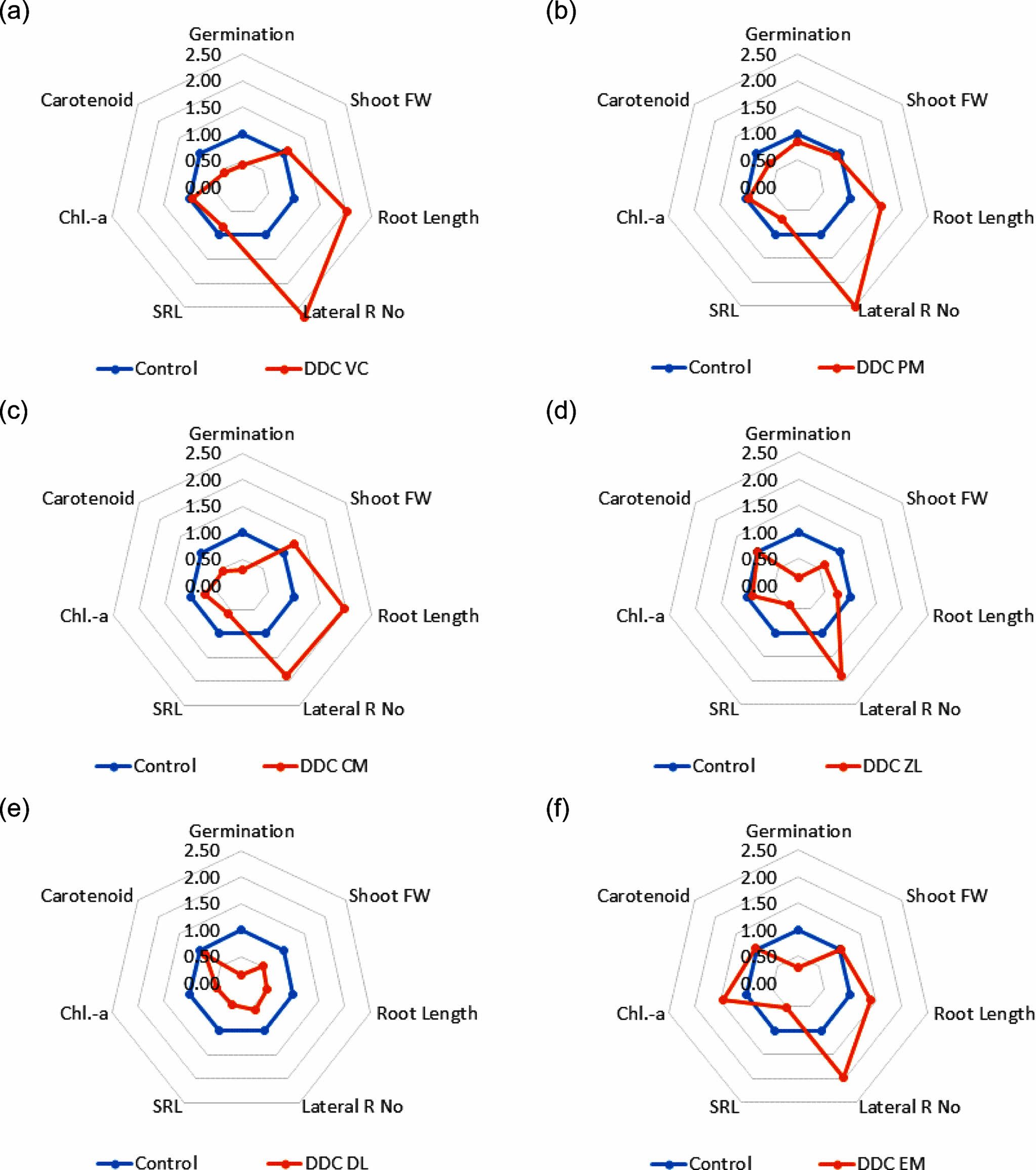
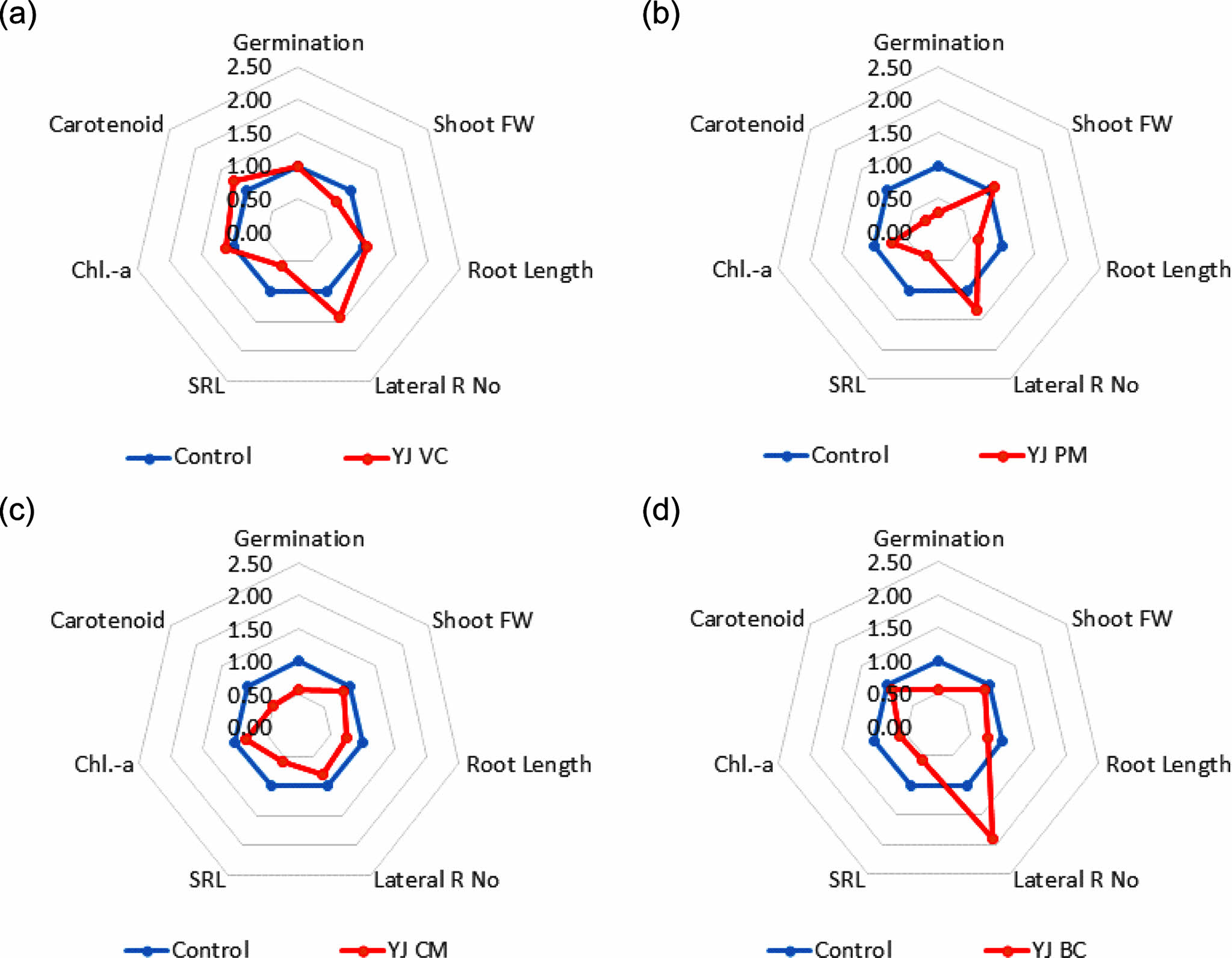
발아한 렌틸을 8일 후 수확하고, 발아율, 지상부 생체량, 뿌리 길이, 측근의 수, SRL, Chl.-a 및 cartenoid 등 총 7개 지표를 대조군의 측정값에 대비하여 비교하였다(Fig. 3 & 4). 첨가제에 의한 렌틸 발아 및 생장 효과는 토양효소활성 측정값과는 차이가 있었다. DDC 토양에서는 유기성 첨가제인 VC, PM, CM 및 EM을 투입한 경우, 렌틸 뿌리 생장이 활발하고, 측근이 발달하였다. 반면 무기성 첨가제인 DL과 ZL 첨가구에서의 뿌리 생장은 대조군 대비 각각 50 및 75% 이하로 미미하였다. YJ 토양에서는 렌틸 발아가 50% 이하이었으며, 생장도 활발하지 않았다. 측근의 발달은 BC처리구에서 대조군 대비 약 189% 증가하였고, 유기성 첨가제인 VC와 PM 처리구에서는 각각 142 및 132%가 증가하였다. VC 처리구에서는 지상부 Chl.-a 농도가 대조군 대비 112%로 높았고, 나머지는 모두 낮았다. 식물스트레스와 토양 비옥도의 지표인 SRL을 기준으로 하면, 렌틸이 발아한 2종의 모든 처리구에서 대조군 대비 1.0 이하이었다. 즉 처리토에 첨가물을 투입하여도 식물스트레스는 여전히 존재하며, 보다 긴 시간의 첨가물 안정화 및 회복기간이 필요하다는 것을 간접적으로 의미한다.
대조군의 측정값을 1.0으로 하여 각 지표의 비율를 계산하고, 7개 지표의 총합을 기준으로 나열하면, DDC 토양에서는 VC 1.21, PM 1.18, EM 1.10, CM 1.02, ZL 0.82 및 DL 0.50으로 VC 처리구가 가장 렌틸 생장이 높았다. YJ 토양에서는 VC 1.02, BC 0.89, CM 0.71 및 PM 0.67의 순으로 역시 VC 처리구에서 렌틸 생장이 가장 활발하였다. 이상의 결과와 같이 유기성 첨가물이 무기성 첨가물에 비해 렌틸 생장을 증진하였다는 점에서는 토양효소활성과 유사한 결과이지만, 토양효소활성이 CM과 CR 처리구에서 가장 높았던 점과는 차이가 있었다. 윤작 토양에 유기성 및 무기성 첨가제를 투입한 결과, 유기성 첨가제가 토양효소활성 증진 및 토양유기물 함량 증가에 효과적이었으나, 식물의 생장 단계에 따라 토양효소활성 변화가 관측되었다(Kandeler et al., 1999). 바이오차를 투입한 논토양에서의 질소고정균도 처리 3년 이후에 유의적으로 증가하였다(Wang et al., 2023). 그러므로 첨가제가 안정화되고, 그 효과가 발현되기 까지 충분한 시간이 필요할 가능성도 있을 것으로 사료된다.
|
Fig. 1 Comparing the soil enzymes activity in each amendment treatment to the control. (a) DDC soil with organic amendments, (b) DDC soil with inorganic amendments, (c) YJ soil with organic amendments, (d) YJ soil with inorganic amendments. Vitamin B was the cause of the unusually high DHA, 1,132 gTPF/g-soil in DDH soil, and 2416 1,132 gTPF/g-soil in YJ soil, in the CR (chlorella) treatment; precise values were not shown in the figures (a) and (c). |
|
Fig. 2 Steps of image processing for estimation of root length and volume. (a) original digital image, (b) conversion to an 8-bit RGB image by ImageJ, (c) root identification and estimation of length/volume by the SmartRoot program, which shows the main root in red and the secondary root in yellow. |
|
Fig. 3 Radar graph showing comparison of seven indices of lentil germination and growth on reclaimed DDC soils with amendment relative to nursery soil. Each value of plant growth index on nursery soil was set to 1.0. (a) amended with vermicompost, (b) amended with peat moss, (c) amended with chicken manure, (d) amended with zeolite, (e) amended with dolomite lime, (f) amended with EM product. |
|
Fig. 4 Radar graph showing comparison of eight indices of lentil germination and growth on reclaimed YJ soils with amendment relative to nursery soil. Each value of plant growth index on nursery soil was set to 1.0. (a) amended with vermicompost, (b) amended with peat moss, (c) amended with chicken manure, (d) amended with biochar. |
|
Table 3 Soil bulk density and pH after 10 weeks of incubation under controlled environment |
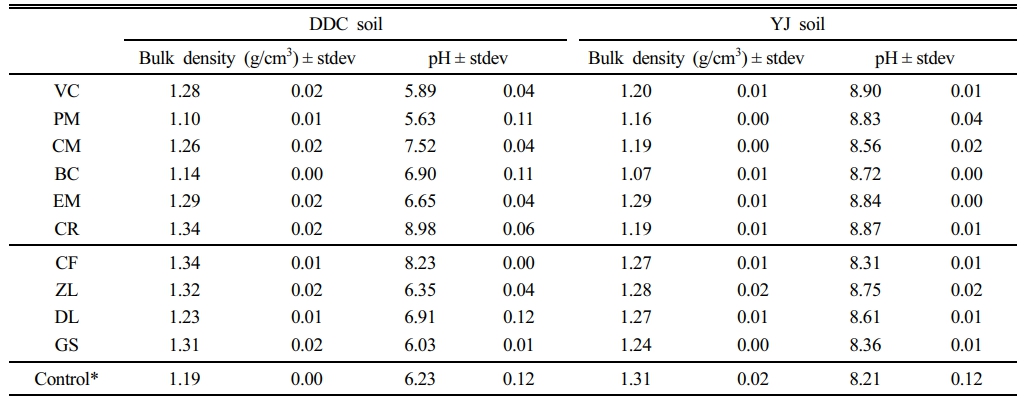
*without amendment |
|
Table 4 Enzyme activities of DDC soil after 10 weeks of incubation with 5% (W/W) amendment |
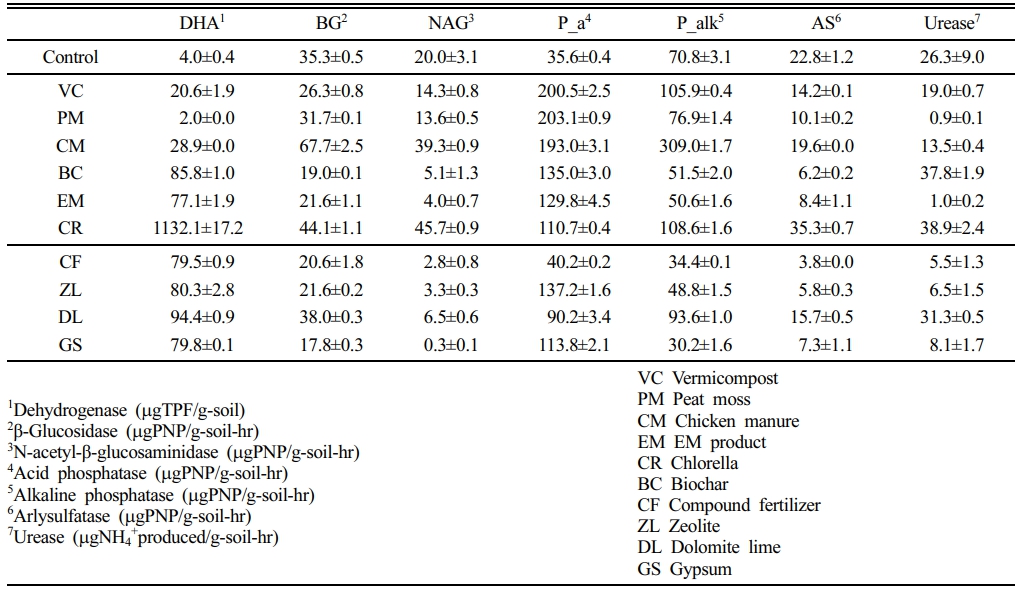
|
Table 5 Enzyme activities of YJ soil after 10 weeks of incubation with 5% (W/W) amendment |
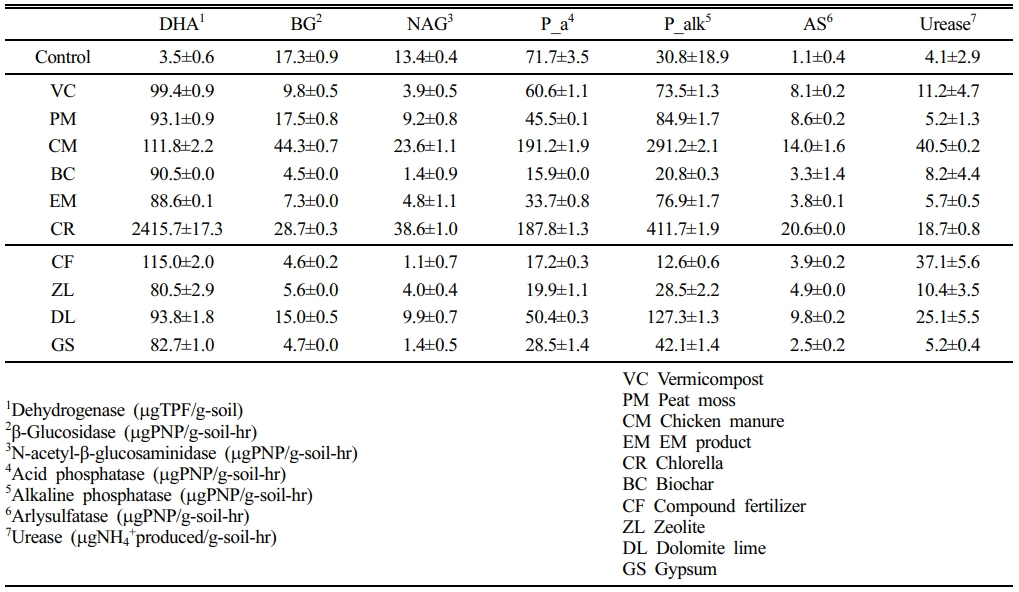
TPH로 오염토양을 토양경작법 처리한 DDC 토양과 열탈착으로 처리한 YJ 토양에 첨가제 10종을 각각 5%(W/W) 첨가하고 10주간 후숙한 토양의 건강성 변화를 확인하기 위해 7종의 토양효소활성을 측정하였다. 실험에 사용한 첨가제는 분변토(VC), 피트모스(PM), 계분퇴비(CM), EM 제제(EM), 클로렐라(CR) 및 바이오차(BC)의 유기성 첨가제 6종과, 복합비료(CF), 제올라이트(ZL), 석회고토(DL), 석고(GS)의 무기성 첨가제 4종이었다. 또한 후숙한 각 토양에 렌틸을 8배수로 재배하고 발아율 및 유식물 생장을 원예상토에 재배한 렌틸과 비교하였다.
실험 결과 전반적인 토양효소활성 증진 효과는 유기성 첨가제에서 우수하였으며, BG를 기준으로 할 경우 DDC 토양에서는 CM > CR > DL > PM > VC > ZL = EM > CF > BC > GS의 순이고, YJ 토양에서는 CM > CR > PM > DL > VC > EM > ZL > CF = GS > BC의 순이었다. 실험에 사용한 2종의 클로렐라와 계분퇴비에서 토양효소활성 증진 효과가 가장 높았다.
첨가제의 효과를 렌틸 종자 발아율, 지상부 생체량, 근권 길이, 측근의 수, SRL(specific root length), Chl.-a, carotenoid의 7개 지표를 대조군에 평균화하여 비교하면, DDC 토양에서는 VC와 PM 처리구에서, YJ 토양에서는 VC와 BC 처리구에서 렌틸 발아 및 생장효과가 높았다. 다만 SRL을 기준으로 할 경우, 모두 대조군보다 낮은 값이 관측되어, 처리토에서 발생하는 식물스트레스 및 토양비옥도 문제가 여전히 존재하고 있는 것이 확인되었다. 첨가제에 의한 토양건강성 회복을 판단하기 위해서는 토양효소활성 이외의 다른 평가지표 도입이 필요하고, 첨가제를 투여한다고 해도 단기간에 토양건강성이 회복되지 않는다는 점이 확인되었다.
본 연구는 한국환경산업기술원의 연구비지원(2020002480002)으로 수행되었습니다. 10종의 첨가물을 공급해주신 경상대학교 이상우 박사님께 감사드립니다.
- 1. Acosta-Martinez, V. and Tabatabai, M.A., 2000, Enzyme activities in a limed agricultural soil, Biol. Fertil. Soils, 31, 85-91.
-

- 2. Besalatpour, A., Hajabbasi, M.A., Khoshgoftarmanesh, A.H., and Dorostkar, 2011, Landfarming process effects on biochemical properties of petroleum-contaminated soils, Soil Sediment Contam., 20(2), 234-248.
-

- 3. Bergsveinson et al., 2019, Spatial analysis of a hydrocarbon waste-remediating landfarm demonstrates influence of management practices on bacterial and fungal community structure, Microb. Biotechnol., 12(6), 1199-1209.
-

- 4. Blonska, E., 2010, Enzyme activity in forest peat soils. Folia Forestalia Polonica. Series A. Forestry, 52(1), 20-25.
- 5. Borsook, H. and Keighley, G. 1933, Oxidation-reduction potential of ascorbic acid (vitamin C), PNAS, 19(9), 875-878.
-

- 6. Cardoso, E.J.B.N., Vasconcellos, R.L.F., Bini, D., Miyauchi, M.Y.H., Santos, C.A.D., Alves, P.R.L., Paula, A.M.D., Nakatani, A.S., Pereira, J.D.M., and Nogueira, M.A., 2013, Soil health: looking for suitable indicators. What should be considered to assess the effects of use and management on soil health?, Sci. Agric., 70, 274-289.
-

- 7. Das, S.K. and Varma, A., 2011, Role of enzymes in maintaining soil health, Soil Enzymology, 22, 25-42.
-

- 8. Deng, A., Wu, X., Su, C., Zhao, M., Wu, B., and Luo, J., 2021, Enhancement of soil microstructural stability and alleviation of aluminium toxicity in acidic latosols via alkaline humic acid fertiliser amendment, Chem. Geol., 583, 120473.
-

- 9. Dissanayake, N. and Hoy, J.W., 1999, Organic material soil amendment effects on root rot and sugarcane growth and characterization of the materials, Plant Dis., 83(11), 1039-1046.
-

- 10. Doran, J.W. and Zeiss, M.R., 2000, Soil health and sustainability: managing the biotic component of soil quality, Appl. Soil Ecol., 15(1), 3-11.
-

- 11. Eissenstat, D.M., 1991, On the relationship between specific root length and the rate of root proliferation: A field study using citrus rootstocks, New Phytol., 118, 63-68.
-

- 12. Garbuz, S., Mackay, A., Camps-Arbestain, M., DeVantier, B., and Minor, M., 2021, Biochar amendment improves soil physico-chemical properties and alters root biomass and the soil food web in grazed pastures, Agric. Ecosyst. Environ., 319, 107517.
-

- 13. Garcia-Gil, J.C., Plaza, C., Senesi, N., Brunetti, G., and Polo, A.A., 2004, Effects of sewage sludge amendment on humic acids and microbiological properties of a semiarid Mediterranean soil, Biol. Fertil. Soils, 39, 320-328.
-

- 14. Han, S.H., Jung, M.C., Kim, J.W., Jeon, S.W., Nguyen, Q.T., Yoon, K.W., and Min, S.K., 2020, The occurrence and treatment status of off-site contaminated soils in Korea, J. Soil Groundw. Environ., 25(4), 1-6.
-

- 15. Huang, H., Liu, H., Zhang, R., Chen, Y., Lei, L., Qiu, C., and Xu, H., 2022, Effect of slow-released biomass alkaline amendments oyster shell on microecology in acidic heavy metal contaminated paddy soils, J. Environ. Manage., 319, 115683.
-

- 16. Kandeler, E., Tscherko, D., and Spiegel, H., 1999, Long-term monitoring of microbial biomass, N mineralization and enzyme activities of a chernozem under different tillage management, Biol. Fertil. Soils, 28, 343-351.
-

- 17. Knight, A., Cheng, Z., Grewal, S.S., Islam, K.R., Kleinhenz, M.D., and Grewal, P.S., 2013, Soil health as a predictor of lettuce productivity and quality: a case study of urban vacant lots, Urban Ecosys., 16, 637-656.
-

- 18. Karlen, D.L., Veum, K.S., Sudduth, K.A., Obrycki, J.F., and Nunes M.R., 2019, Soil health assessment: Past accomplishments, current activities, and future opportunities, Soil Tillage Res., 195, 104365.
-

- 19. Kandeler, E. and Gerber, H., 1988, Short-term assay of soil urease activity using colorimetric determination of ammonium, Biol. Fertil. Soils, 6(1), 68-72.
-

- 20. Khati, P., Chaudhary, P., Gangola, S., Bhatt, P., and Sharma, A., 2017, Nanochitosan supports growth of Zea mays and also maintains soil health following growth, Biotech., 7, 1-9.
-

- 21. Kramer-Walter, K.R., Bellingham, P.J., Millar, T.R., Smissen, R.D., Richardson, S.J., and Laughlin, D.C., 2016, Root traits are multidimensional: specific root length is independent from root tissue density and the plant economic spectrum, J. Ecol., 104, 1299-1310.
-

- 22. Lee, S.H., Lee, J.H., Jung, W.C., Park, M., Kim, M.S., Lee, S.J., and Park, H., 2020, Changes in soil health with remediation of petroleum hydrocarbon contaminated soils using two different remediation technologies, Sustainability, 12, 10078.
-

- 23. Lee, W. C., Lee, J.H., Lee, S.H., Lee, S.W., Jeon, J.H., Lee, S.H., and Kim, S.O., 2022, Revitalization of total petroleum hydrocarbon contaminated soil remediated by landfarming, Toxics, 10(3), 147.
-

- 24. Lichtenthaler, H.K., 1987, Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes, Methods Enzymol., 148, 350-382.
-

- 25. Lobet, G., Pages, L., and Draye, X., 2011, A novel image-analysis toolbox enabling quantitative analysis of root system architecture, Plant Physiol., 157, 29-39.
-

- 26. Nelson, P.N. and Su, N., 2010, Soil pH buffering capacity: a descriptive function and its application to some acidic tropical soils, Soil Res., 48(3), 201-207.
-

- 27. NIFS (National Institute of Forest Science), 2014, Soil and Plant Analytical Method, 11-1400377-000748-01 (in Korean).
- 28. O'Brien, P.L., DeSutter, T.M., Casey, F.X.M., Khan, E., and Wick, A.F., 2018, Thermal remediation alters soil properties - a review, J. Environ. Manage., 206,826-835.
-

- 29. OECD, 2003, OECD Guideline for the Testing of Chemicals, Terrestrial Plant Test, 208: Seedling Emergence and Seedling Growth Test.
-

- 30. Pape, A., Switzer, C., Mccosh, N., and Knapp, C., 2015, Impacts of thermal and smouldering remediation on plant growth and soil ecology, Geoderma, 243, 1-9.
-

- 31. Park, H., Kang, S., and Bae, B., 2021, Quantifying inhibitory effects of reclaimed soils on the shoot and root growth of legume plant lentil (Lens culinaris), J. Soil Groundw. Environ., 26(5), 1-8.
-

- 32. Pepper, I.L. and Gerba, C.P., 2004, Environmental microbiology: A laboratory manual, 2nd Ed., Elsevier Academic Press, MA, USA.
- 33. Premalatha, K., Botlagunta, N., Santhosh, D., Hiremath, C., Verma, R.K., Shanker, K, Sundaresana, V., and Kalra, A., 2021, Enhancement of soil health, germination and crop productivity in Andrographis paniculata (Burm. f.) Nees, an important medicinal crop by using a composite bio inoculant, J. Plant Nutr., 44, 2331-2346.
-

- 34. Reinersmann, T., Herre, M., Marschner, B., and Heinze, S., 2023, Soil enzyme activity response to substrate and nutrient additions on undisturbed forest subsoil samples, Soil Syst., 7(2), 57.
-

- 35. Riegel, C. and Noe, J.P., 2000, Chicken litter soil amendment effects on soilborne microbes and Meloidogyne incognita on cotton, Plant Dis., 84(12), 1275-1281.
-

- 36. Sainju, U.M., Liptzin, D., and Dangi, S.M., 2022, Enzyme activities as soil health indicators in relation to soil characteristics and crop production, Agrosyst. Geosci. Environ., 5(3), e20297.
-

- 37. Schneider, C.A., Rasband, W.S., and Eliceiri, K.W., 2012, NIH Image to ImageJ: 25 years of image analysis, Nat. Methods, 9(7), 671-675.
-

- 38. Stott, D.E., 2019, Recommended soil health indicators and associated laboratory procedures, Soil Health Technical Note No. 450-03. U.S. Department of Agriculture, Natural Resources Conservation Service.
- 39. U.S. EPA, 2017, How to evaluate alternative cleanup technologies for underground storage tank sites, EPA 510-B-17-003.
- 40. Utobo, E.B. and Tewari, L., 2015, Soil enzymes as bioindicators of soil ecosystem status, Appl. Ecol. Rnviron. Res., 13(1), 147-169.
-

- 41. Wang, C., Li, Z., Shen, J., Li, Y., Chen, D., Bolan, N., Li, Y., and Wu, J., 2023, Biochar amendment increases the abundance and alters the community composition of diazotrophs in a double rice cropping system, Biol. Fertil. Soils, 59(8), 873-886.
-

- 42. Wani, P.A., Khan, M.S., and Zaidi, A. 2008, Impact of zinc-tolerant plant growth promoting rhizobacteria on lentil grown in zinc-amended soil, Agron. Sustainable Dev., 28(3), 449-455.
-

- 43. Zhao, Y. and Naeth, M.A., 2022, Lignite derived humic products and cattle manure biochar are effective soil amendments in cadmium contaminated and uncontaminated soils, Environ. Adv., 8, 100186.
-

 This Article
This Article
-
2024; 29(6): 1-11
Published on Dec 31, 2024
- 10.7857/JSGE.2024.29.6.001
- Received on Nov 6, 2024
- Revised on Nov 23, 2024
- Accepted on Nov 29, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumhan Bae
-
Department of Civil & Environmental Engineering, Gachon University
- E-mail: bhbae@gachon.ac.kr