- Optimal Injection Dosage Determination of Calcium polysulfide (CPS) for Remediation of Groundwater Contaminated with Complex Heavy Metals with Various Concentration Ranges
Jiwon Choi1 ㆍJin Chul Joo2*ㆍKyoungphile Nam3 ㆍHyeon Woo Go4 ㆍ Won Seok Park4 ㆍInwon Lee4 ㆍDong Jun Kim1
1Department of Environmental Engineering, Hanbat National University, Daejeon 34158, Korea
2Department of Civil and Environmental Engineering, Hanbat National University, Daejeon 34158, Korea
3Department of Civil and Environmental Engineering, Seoul National University, Seoul 08826, Korea
4Beautiful Environmental Construction Inc., Gyeonggi-do 13207, Korea- 다양한 농도의 복합 중금속으로 오염된 지하수 정화를 위한 Calcium polysulfide (CPS)의 최적 주입량 도출
최지원1 ㆍ주진철2*ㆍ남경필3 ㆍ고현우4 ㆍ박원석4 ㆍ이인원4 ㆍ김동준1
1국립한밭대학교 환경공학과
2국립한밭대학교 건설환경공학과
3서울대학교 건설환경공학부
4아름다운환경건설(주)This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study assessed the optimal injection dosage of calcium polysulfide (CPS) for the remediation of groundwater contaminated with cadmium (Cd) and zinc (Zn) at varying concentrations. CPS, a powerful reducing agent, was applied to groundwater samples from two contaminated sites with high and low heavy metal levels. Increasing CPS dosage resulted in higher pH and lower oxidation-reduction potential (ORP). In the high-concentration sample, a CPS dosage of 0.3% achieved over 99% removal of Cd and Zn, with CPS/heavy metal mass ratios of 2.29 for Cd and 3.13 for Zn. In the low-concentration sample, CPS dosages between 0.03% and 0.06% also achieved 99% removal but required higher mass ratios (15.88 for Cd and 5.33 for Zn). Surface analysis using X-ray photoelectron spectroscopy (XPS) and scanning electron microscopy with energy-dispersive X-ray spectroscopy (SEM-EDS) confirmed the formation of metal sulfides such as CdS and ZnS. The findings suggest that lower metal concentrations necessitate higher CPS-to-metal ratios for effective remediation, underscoring the importance of site-specific optimization of CPS injection for stabilizing heavy metals in groundwater.
Keywords: Calcium polysulfide (CPS, CaSx), Complex heavy metals, Groundwater, Precipitation, Metal suilfides
광산 및 제련소 인근의 지하수는 산업 활동(채광, 선광, 제련 등)에서 배출된 중금속에 의해 오염되며, 이는 주변 토양과 수계에 심각한 환경 문제를 초래한다(Kapusta and Sobczyk, 2015; Kubier et al., 2019; Sankhla et al., 2019). 특히 카드뮴(Cd)과 아연(Zn)은 주요 오염원으로 작용하며, 이러한 중금속의 거동과 결합 형태는 환경 조건에 따라 크게 달라진다. pH, 산화환원 상태, 경쟁 이온, 점토 광물 및 유기물과의 결합 형태는 중금속의 액상 및 고상 평형에 영향을 미치며, 이로 인해 중금속은 생태계에서 장기간 잔류할 수 있다(Zhao et al., 2016; Zhao et al., 2019). 이는 인근 농작물의 생장을 저해하거나, 오염된 지하수를 음용하는 주민들에게 인체 건강상의 위험을 초래할 가능성을 높인다(Jung et al., 2006; Lee et al., 2015; Akiyama et al., 2017).
중금속은 화학적으로 안정적인 구조를 가지는 경우가 많아 자연 상태에서 완전 분해가 어려운 난분해성 물질로 분류된다. 이를 처리하기 위해 일반적으로 양수 후 이온교환, 여과, 역삼투법 등의 물리·화학적 처리 공법이 사용된다. 그러나 지중 매질의 불균질성(heterogeneity)으로 인해 오염의 범위와 농도가 복잡하고 다양하게 나타나는 경우, 양수처리(pump-and-treat) 공법은 처리 효율과 경제성 측면에서 한계가 있다(Choi et al., 2009; Lee, 2010; U.S. FRTR, 2024). 이러한 문제를 해결하기 위해, 최근에는 원위치(in situ) 처리를 통한 중금속의 고정화(stabilization)와 이동성(mobility) 저감 기술이 주목받고 있다. 특히, 화학적 산화·환원 반응을 활용한 침전법(chemical precipitation)을 통해 중금속을 대수층 내에서 고정하고, 생물권으로부터 효과적으로 분리하려는 연구가 활발히 진행되고 있다(U.S. EPA, 1999; Fruchter, 2002; U.S. DOE, 2007; Asmare et al., 2021).
현재까지 연구된 다양한 지중 중금속 처리방법 중 현장 화학 처리법(In Situ chemical treatment)은 생물학적 처리가 어렵고 오염물의 농도가 높거나 비교적 높은 독성을 지녀 미생물의 분해 활성도가 떨어지는 중금속 등의 오염물질을 처리하기 위해 연구되고 있으며, 적용 방법에 따라 약품 주입법(chemical injection), 투과성 반응벽체법(permeable chemical barrier) 및 미생물 정화법(bioremediation) 등으로 구분할 수 있다(Yin, 1999; Ott, 2000). 약품 주입법에 사용하는 환원제는 황(S), 철(Fe) 기반으로 구분 가능하며 Di-(m-Octyl) Phosphinate, FeS, FeSO4, CaSx, NaS2O4 등 여러 환원제에 대한 연구가 진행된 바 있다(Esalah et al., 2000; Chrysochoou et al., 2011; Cheng et al., 2018; Zhang et al., 2020; Asmare et al., 2021; Estay et al., 2021; Hu et al., 2021). 그러나 환원제 간 침전 안정성, 편의성 등의 조건들이 상이하고 제거 효율 또한 유의한 차이가 있어, 중금속을 대상으로 강력한 환원력을 지닌 Calcium polysulfide (CaSx, CPS)가 주로 사용되는 것으로 보고되고 있다(Arantani et al., 1979; Soya et al., 2008; Zhong et al., 2009; Mpouras et al., 2020; Li and Zhang, 2021). CPS는 지하수 내 산소 및 물분자 또는 대기 중 이산화탄소와 반응하여 빠른 속도로 Calcium thiosulfate (CaS2O3) 및 Hydrosulfide (H2S)를 생성한 후, 중금속(Me2+)과 반응하여 금속 황화물(metal sulfide, MeS)을 형성한다. 이는 다른 중금속 침전물 형태(metal hydroxide, metal carbonate)에 비해 용해도곱 상수(Ksp)가 상대적으로 낮아(Fig. 1 참조) 재용출 가능성이 희박하여 중금속의 침전 및 고정화에 매우 유리한 것으로 알려져 있다(Yahikozawa et al. 1978; Dahlawi et al. 2017; Pohl, 2020; Go et al. 2023; Yoon et al., 2024). 자세한 반응식은 Eqs. (1)~(4)에 제시하였다.
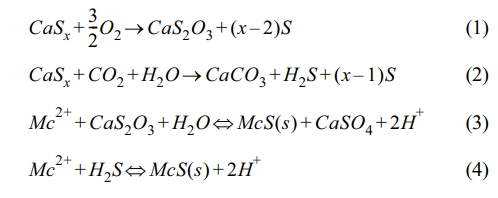
Me2+: represents the heavy metal cations, MeS: represents the precipitated metal sulfides
이전에 진행된 연구에서는 중금속으로 오염된 지역 내 CPS solution을 활용해 Cr6+를 저감하는 등의 연구가 진행되었으나(Chrysochoou et al., 2011; Dalawi et al., 2017; Mpouras et al., 2020; Hu et al., 2021; Li et al., 2021), Cd2+, Zn2+ 등의 2가 양이온(Me2+)으로 오염된 지하수를 정화하기 위한 연구 사례가 미비한 실정이다. 특히 국내에서는 다양한 종류의 복합 중금속으로 오염된 현장 지하수 정화를 위한 연구가 일부 진행된 사례가 있으나(Go, 2023; Yoon et al., 2024), 오염 부지의 현장 특이적(site-specific) 특성과 수질 이화학적 성상 등이 모두 다르므로 다양한 조건의 지하수에 CPS 용액을 적용할 방법을 파악하기 위한 구체적 연구가 필요하다.
따라서, 각기 다른 농도의 중금속 혼합물과 이화학적 성상이 다양한 지하수 내 CPS를 주입하여 중금속 제거량 기반 최적 CPS 주입 농도 및 주입량을 산출하는 것이 본 연구의 주요 목적이다. 구체적인 연구 목표는 (1) 다양한 농도의 복합 중금속으로 오염된 현장 지하수 시료에 CPS를 적용하여 중금속 종류 및 농도별 최적 환원제 주입 조건을 도출하고, (2) CPS 주입 결과 생성된 침전물의 표면 분석을 통해 침전물의 조성 및 결합형태를 확인하는 것이다. 이러한 연구 결과를 통해 다양한 지중 현장에 CPS를 적용하여 중금속 안정화 설계에 필요한 인자 도출이 가능하고 현장 지중 오염 환경을 반영한 최적의 환원제 주입 프로토콜의 도출이 가능할 것으로 예상된다.
|
Fig. 1 Comparisons of solubilities for metal sulfides and metal hydroxides as a function of pH. |
2.1. 실험 재료
실험에 사용한 Calcium polysulfide (CaSx, CPS) 용액은 오염 토양 또는 폐수 내 중금속 정화를 위해 상업적으로 판매되고 있는 CPS 29% 용액 (Lianyungang YoSoo Industrial Technique Co., China)을 구매해 실험에 사용했다. CPS 용액은 pH (pHCPS = 11.2~11.6)가 매우 높고 산화환원전위(ORPCPS = -240~260)가 매우 낮은 것으로 확인되었다. 또한 물보다 밀도(dCPS = 1.23~1.28 g/cm3)가 큰 것으로 알려져 있으며(EFSA 2010; Dahlawi et al. 2017), 관련 선행 연구에서 보고된 물리화학적 특성을 Table 1에 제시하였다. Fig. 2에 나타난 바와 같이 CPS의 pH 범위에서 CPS 내 용존 상태로 존재하는 황 이온(sulfur ion)은 주로 HS-와 일부 S2-로 구성된다. 실제 현장 지하수 내 적용 시 지하수 내 Me2+와 CPS 내 HS- 및 S2-가 반응해 Metal sulfide 침전물 형태를 구성하는 것으로 알려져있다(Migdisov et al., 2002; Lewis, 2010; Prokkola et al., 2020). 자세한 반응식은 Eqs. (5)~(8)에 제시하였다.
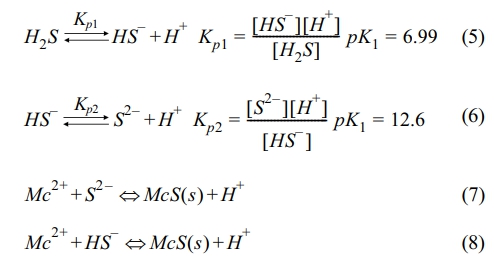
2.2. 지하수 분석 및 회분식 실험
복합 중금속으로 오염된 현장의 서로 다른 두 지점(A 지점 및 B 지점)에서 채수한 오염 지하수 시료를 사용하였다. 연구 대상지는 S-site로, A 지점은 부지 내 제련소 및 슬러지 보관소 등 주요 오염원으로 파악되는 위치를 선정하였으며, B 지점은 인근 산지로부터 강우 시 유입된 우수로 인해 지중 내 중금속 농도가 일부 희석되었을 가능성이 있는 지점으로 선정하였다. 지하수 시료에 대한 수질 이화학적 특성(pH, ORP, DO, EC)은 다양한 다항목 측정기기를 활용하였다. pH와 ORP는 YSI 4110 (YSI Inc., USA)을 활용하였으며, DO는 YSI Pro 1202 (YSI Inc., USA)를, EC는 YSI Pro 30 (YSI Inc., USA)을 사용하여 측정하였다. 지하수 내 존재하는 중금속과 주요 양이온은 유도결합플라즈마 발광분석법(ICP-OES, ICP-MS, iCAP Q/QR, Thermo Fisher Scientific Co., USA)을 이용하였으며, 음이온은 이온크로마토그래피(IC, 940 Professional IC Vario, Metrohm, Switzerland)를 통해 분석하였다.
회분식 실험(Batch test)은 50 mL 코니컬 튜브에서 상온(25oC) 조건으로 진행하였다. 29% CPS 용액을 다양한 비율의 초순수로 희석하여 1 ml를 준비하고, 49 mL의 중금속 오염 지하수에 첨가하여 지하수 내 중금속 저감 농도 및 수질 이화학적 특성의 변화를 관측하였다. CPS 주입량은 이전 문헌(Go, 2023; Yoon et al., 2024)에서 조사된 지하수 내 용존 중금속 제거에 필요한 mass ratio (CPS/Heavy metal, w/w)를 기반으로 주입 CPS의 농도 범위(A 지점 0~1.5%, B 지점 0~0.12%)를 산정했으며, 반응조의 전경은 Fig. 3(a), (b)에 제시하였다.
CPS를 주입한 현장 지하수 시료를 130 rpm 조건에서 24 hr 동안 교반하여 반응시킨 후, 24시간 동안 자연 침전시켜 고액 분리를 진행했다. 이후 상등액은 회수하여 0.45 mm GHP filter로 여과한 뒤, 용액의 수질 이화학적 특성을 파악하고 중금속 농도를 정량하였다.
2.3. 표면분석 실험
고액 분리된 침전물은 45oC 건조로에서 3일 이상 건조시킨 후, X선 광전자 분광법(XPS, Thermo Fisher Scientific Co., USA)을 이용하여 회수된 중금속 침전물의 결합 형태를 정성 분석하였다. 또한, 침전물의 조성 및 형태, 그리고 침전물 내 원소 분포를 확인하기 위해 주사전자현미경/에너지분산형 분광분석법(SEM/EDS, UHR FE-SEM(SU8230), Hitachi Tech., Co., Japan)을 실시하였다.
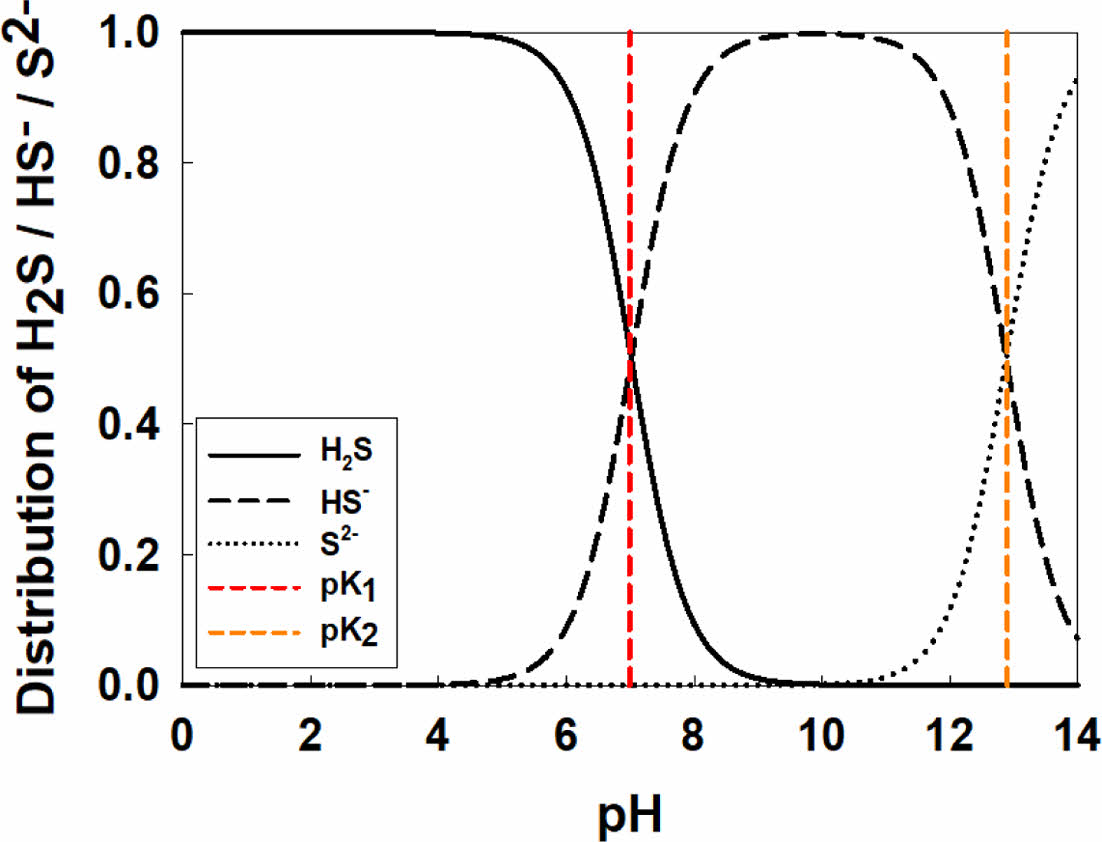
|
Fig. 2 Chemical equilibrium between different sulfide species as a function of pH. |

|
Fig. 3 Pictorial views of batch reactor with CPS injection. |
|
Table 1 Physicochemical properties of calcium polysulfide (CaSx) (EFSA 2010; Dahlawi et al., 2017; Go, 2023; Yoon et al., 2024) |
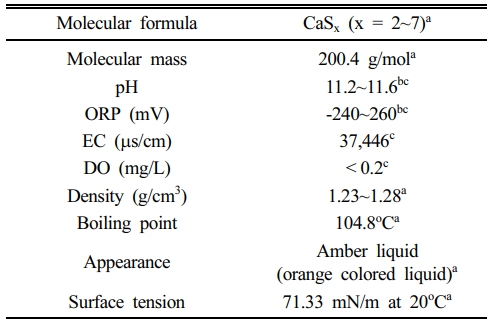
aEFSA 2010; Dahlawi et al., 2017 |
3.1. 오염 지하수의 특성
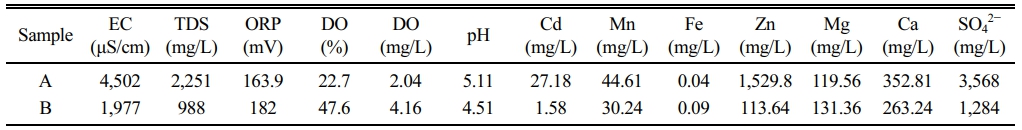
현장 지하수의 수질 이화학적 특성과 중금속 및 황산염 농도를 Table 2에 제시하였다. 지하수 시료의 수질 이화학적 성상은 각 지점마다 상이하였으나, 공통적으로 pH 4.5~5.1 정도의 산성을 띄었으며, ORP (mV)는 163~182 mV 정도의 산화 조건임을 확인하였다. DO (mg/L)는 B 지점에서 다소 높게 나타난 반면, EC (ms/cm)의 경우 A 지점에서 상대적으로 높게 측정되었다. 이러한 DO 및 EC 값의 차이는 두 지점별 지하수 내 중금속 농도의 차이에 기인한 것으로 판단된다. Table 2에 요약된 중금속 농도를 통해 두 지점 간 중금속 농도 차이가 확인되었으며, A 지점에서 Cd가 27.18 mg/L, Zn가 1,529.77 mg/L로 측정되었고, B 지점에서 Cd은 1.58 mg/L, Zn가 113.64 mg/L로 측정되어 두 지점 간 농도 차이가 약 10~15배 이상인 것으로 확인되었다. 따라서 A 지점은 고농도 조건(Sample A), B 지점은 저농도 조건(Sample B)으로 명명하여 실험을 진행하였다.
3.2. CPS 주입에 따른 수질 이화학적 특성 및 중금속 농도 변화
3.2.1. 고농도 중금속 오염 지하수 농도 변화
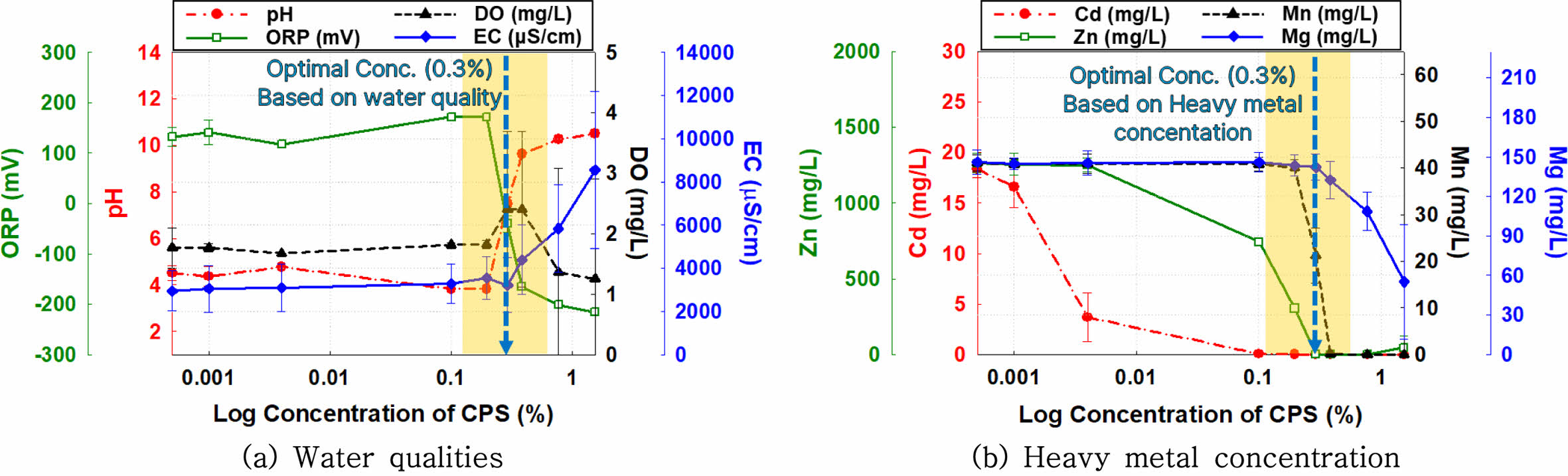
A 지점 지하수 시료에 CPS 용액을 주입한 후 반응조 내 수질 이화학적 특성의 변화를 Fig. 4(a)에 제시하였다. pH 및 ORP의 경우 초기값 대비 CPS 적용 농도가 증가할수록 pH가 점진적으로 감소하고 ORP가 점진적으로 증가하였다. 그러나 반응조 내 CPS 농도가 약 0.1~0.3%를 초과하는 시료부터 pH의 급격한 증가 및 ORP의 급격한 감소를 나타내었다. 또한, 지하수 내 중금속 질량 대부분을 차지하는 Zn의 농도가 초기 농도 대비 99% 이상 저감된 것으로 확인되었다. 이러한 결과는 이전 연구(Yahikozawa et al., 1978; Tu et al., 2018; Go, 2023; Yoon et al., 2024)와 유사하며, 반응조 내 주입된 CPS 용액의 HS- 이온과 황화수소(H2S)가 지하수 시료 내 용존 중금속과 반응하여 침전물(CdS, ZnS 등)과 수소이온(H+)을 생성함으로써 pH가 점진적으로 감소한 것으로 판단된다(Eq. 7, 8 참조). 이후 반응조 내 CPS 농도가 0.3%를 초과하는 시료에서는 용존 중금속 대비 초과 주입된 CPS의 용해로 인해 반응조 내 pH의 증가 및 ORP의 감소를 견인한 것으로 판단된다.
A 지점 지하수 시료에 CPS 용액을 주입한 후 반응조 내 중금속 농도 변화를 Fig. 4(b)에 제시하였다. 수질 이화학적 특성의 변화와 유사하게, CPS 농도가 증가함에 따라 Cd의 농도는 급격히 감소된 반면, Zn와 Mn, Mg의 농도는 점진적으로 감소하였다. 또한, CPS 주입농도가 0.1~0.3%를 초과하는 경우, Cd과 Zn 농도가 급격하게 감소한 것을 확인하였다. 특히 0.1~0.2%의 CPS 농도가 적용된 시료에서 Cd이 불검출(Not Detected, N.D.)되었으며, 0.3%의 CPS 농도가 적용된 시료에서 Zn 농도가 1,233.66 mg/L → 0.11 mg/L로 저감되어 약 99.99%의 저감 효율을 나타냈다. 이러한 결과는 수질 이화학적 특성의 변화에 기반한 CPS 최적 주입 농도인 0.3%와 비교적 일치하며, 임계 농도(critical concentration) 이상의 CPS가 주입될 경우 오염 지하수 내 중금속의 침전을 통한 농도 저감이 효율적임을 알 수 있다. 또한, 각 중금속 별 CPS 최적 주입농도가 상이한 것으로 나타났는데, 이는 중금속 황화물의 반응속도와 결합형태가 다양한 물리화학적 인자에 따라 달라지기 때문이다.
중금속의 황화물 침전 과정에서 반응속도와 결합 형태는 중금속 이온의 양전하 밀도(charge density), 용해도곱 상수(Ksp), pH, 산화환원 상태와 밀접한 관계가 있다. 예를 들어, Cd은 Zn에 비해 더 낮은 Ksp 값을 가지며(Ksp: CdS = 1.0 × 10-28, ZnS = 1.6 × 10-23), 이는 침전 형성이 열역학적으로 더 유리함을 나타낸다. 이러한 특성으로 인해 Cd은 상대적으로 낮은 CPS 농도에서도 효과적으로 제거될 수 있다(Huang et al., 2021). 반면 Zn의 경우 Zn2+ 이온의 양전하 밀도가 Cd2+에 비해 낮아 황화물 형성에 필요한 황화이온 농도가 상대적으로 더 높다. 이로 인해 Zn 제거를 위해서는 더 높은 CPS 농도가 요구된다. 또한, 중금속 이온 간의 경쟁이온 존재도 중요한 영향을 미친다. 경쟁이온이 존재할 경우, 특정 이온과 황화이온 간의 반응이 우선시되어 다른 이온의 침전이 지연될 수 있다. 예를 들어, Mg2+와 같은 알칼리 토금속 이온이 Zn2+ 및 Cd2+와 동시에 존재하면 황화이온과의 경쟁 반응으로 인해 ZnS 및 CdS 형성이 지연될 가능성이 높아진다(Jo et al., 2007; Lee et al., 2020). 이와 같이, 중금속의 화학적 특성과 반응 환경의 물리화학적 조건이 결합하여 각 금속의 CPS 최적 주입 농도가 상이한 결과를 나타내는 것으로 판단된다.
3.2.2. 저농도 중금속 오염 지하수 변화
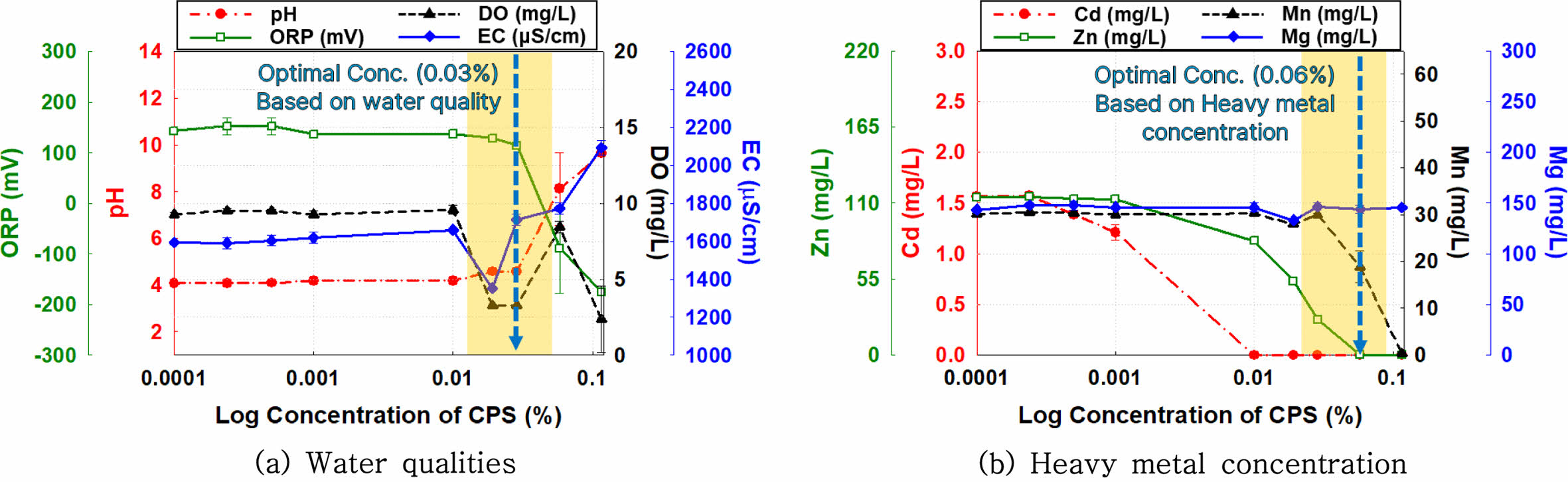
B 지점 지하수 시료에 CPS 용액 주입한 후 반응조 내 수질 이화학적 특성의 변화를 Fig. 5(a)에 제시하였다. A 지점과는 달리, B 지점 시료에서는 CPS 농도가 0.03%를 초과하는 시점부터 pH 와 ORP의 변화가 관찰되었다. 이는 고농도 중금속 시료의 최적 CPS 주입 농도인 0.3% 대비 약 10 배 낮은 농도로, 지하수 시료 내 CPS와 반응할 중금속의 질량이 상대적으로 적어 침전 반응에 필요한 CPS 요구량이 감소함을 의미한다. 또한 DO도 CPS 농도가 0.03%를 초과할 경우 감소하는 것으로 확인되었는데, 이는 최적 주입량 이상의 CPS가 적용되어 과량의 CPS로 인해 반응조 내 용존 산소가 감소하고 혐기상태로 전환된 것으로 판단된다. 그러나 EC는 고농도 지하수 실험 결과 대비 최적 주입량 이상의 CPS가 적용되어도 증가폭이 상대적으로 크지 않았는데, 이는 CPS가 초과 주입되더라도 CPS의 용해로 인한 용존물질의 양이 반응조 내 EC의 증가를 유의미하게 촉진할 만큼 많지 않기 때문인 것으로 해석된다.
B 지점 지하수 시료에 CPS 용액을 주입한 후 반응조 내 중금속 농도의 변화를 Fig. 5(b)에 제시하였다. 수질 이화학적 특성의 변화와 달리, CPS 농도가 0.01%를 초과하는 경우, Cd이 불검출(Not Detected, N.D.)되었으며, 0.06%의 CPS 농도가 적용된 시료에서 Zn 농도가 108.81 mg/L → 0.03 mg/L로 감소하여 약 99.97%의 제거 효율을 보였다. 이러한 결과는 수질 이화학적 특성의 변화에 기반한 CPS의 최적 주입 농도인 0.03%와 다소 차이가 있으며, CPS 주입 시 발생하는 황화수소(H2S) 및 황화물 이온(HS-)과 저농도 중금속의 반응은 고농도 중금속의 반응 대비 쉽게 중금속 화합물 침전물을 형성하지 못하고 결정화(crystalization) 과정을 위해 추가적인 CPS 주입량이 필요로 하기 때문이다. 이러한 CPS와 용존 중금속의 반응 속도와 침전효율의 차이는 CPS의 농도와 접촉 시간, 반응조 내 pH에 따라 크게 달라진다(Aspillaga et al., 2023). 저농도 중금속의 경우 효율적인 침전에 필요한 결정화 과정이 단시간에 발생하지 않고 보다 높은 CPS 주입이 요구되므로 pH 및 ORP의 변화 기반 CPS 주입량 보다 높게 산정된 것으로 판단된다. 또한, 반응조에 CPS 용액을 과량 주입하면 용액이 과포화(supersaturated) 상태가 되어 콜로이드나 작은 결정핵이 생성되는 초기 단계에서 반응 속도가 상대적으로 느려질 수 있는 것으로 보고되고 있다(Luther et al., 1999; Finney and Salvalaglio, 2023). 이러한 결과를 종합할 시 저농도의 중금속에서는 pH나 ORP는 변화하더라도 중금속이 침전되기 위해서는 추가적인 CPS의 주입이 필요할 수 있는 것으로 판단된다. 따라서 중금속 침전이 일정 농도 이하의 저농도에서 pH나 ORP 변화와 완전히 일치하지 않을 수 있으며 이는 지하수 내 중금속의 농도가 낮을수록 적정 CPS 주입량의 범위를 신중하게 산정해야 하는 근거가 될 수 있다(McGinty et al., 2020).
3.2.3. 중금속 농도별 최적 CPS 주입량 비교
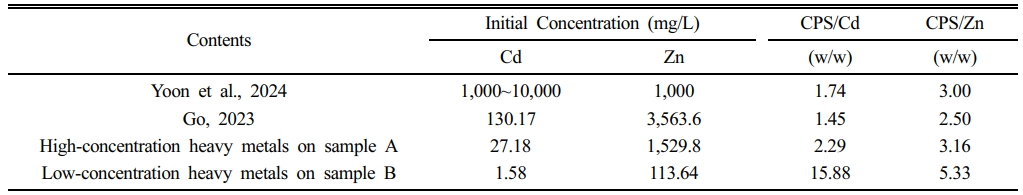
중금속 농도별 최적 중금속(Cd, Zn)의 중량(mg)과 주입된 CPS의 중량(mg)의 weight ratio (CPS/Heavy metal, w/w)를 Table 3에 제시하였다. 고농도 실험에서 감소된 각 중금속(Cd, Zn)과 주입된 CPS의 weight ratio (CPS/Heavy metal, w/w)는 CPS/Cd = 2.29, CPS/Zn = 3.13인 것으로 조사되었다. 이는 이전 연구(Yoon et al., 2024)에서 보고된 CPS/Cd = 1.45, CPS/Zn = 2.5 대비 상대적으로 높은 수치이다, 이전 연구에서 Cd의 농도는 약 130.2 mg/L, Zn의 농도는 약 3,563.6 mg/L로 본 연구에서 사용한 지하수 시료 대비 Cd 농도는 약 4배, Zn 농도는 약 2배 이상 높다. 따라서 본 연구의 지하수 시료에서는 CPS와 반응할 용존 중금속의 양이 상대적으로 적어, 소량의 중금속이 CPS와 반응하여 결정화(crystallization) 단계에서 결정핵(nucleation)을 형성한 후(Qian et al., 2021) 콜로이드 침전 과정을 통해 침전상태로 응결할 때 과량의 CPS가 필요한 결과로 판단된다(Aspillaga et al., 2023, Wielinski et al., 2024).
저농도 실험에서 각 중금속(Cd, Zn)의 감소된 중량과 주입된 CPS의 중량의 weight ratio (CPS/Heavy metal, w/w)는 CPS/Cd = 15.88, CPS/Zn = 5.33인 것으로 조사되었다. 본 실험에서 조사된 mass ratio는 이전에 진행된 연구(Yoon et al., 2024)에서 조사된 수치 및 고농도 실험에서 조사된 수치 대비 상대적으로 높은 수치이며, 중금속 침전에 필요한 CPS 주입량 (mg)은 감소했으나 각 중금속 종(Cd, Zn)의 침전에 필요한 CPS/Heavy metal (w/w)의 weight ratio가 증가한 것으로 확인되었다.
이러한 결과는 초기반응 때 콜로이드 응축과 응집이 필요하기 때문인 것으로 해석된다(Leite and Ribeiro 2011, Lewis et al., 2015, Gross et al., 2016; Teh et al., 2016). 중금속이 소량일 때 결정핵 생성을 유도하기 위해 과량의 CPS를 주입해 중금속을 고체상으로 변화 및 침전을 유도해야 하기 때문인 것으로 보고되고 있다(Wright et al., 2011; Hillis et al., 2017). 또한, 결정화 과정에서 혼합의 불균질성이나 반응조 내 국지적으로 과포화가 발생할 수 있으며, 이로 인해 중금속 농도가 낮을수록 중금속 양 대비 상대적으로 더 많은 CPS가 필요하게 되는 것으로 판단된다. 이는 결정핵이 쉽게 형성되지 않거나 응결에 더 많은 시간이 소요되는 저농도 환경에서 발생하는 일반적인 현상인 것으로 보고되고 있다(Mettler Toledo, 2017). 따라서 이전 연구 및 본 연구에서 서로 다른 농도로 오염된 지하수 정화에 필요한 CPS/Heavy metal (w/w)의 weight ratio가 모두 다르게 조사되었으므로, 향후 다양한 농도의 중금속으로 오염된 지하수에서 CPS 주입에 따른 중금속 저감 효율 및 최적 CPS/Heavy metal (w/w)의 weight ratio 산정을 위한 추가 연구가 필요할 것으로 판단된다.
3.3. 침전물 물질 특성 분석
3.3.1. XPS 결과
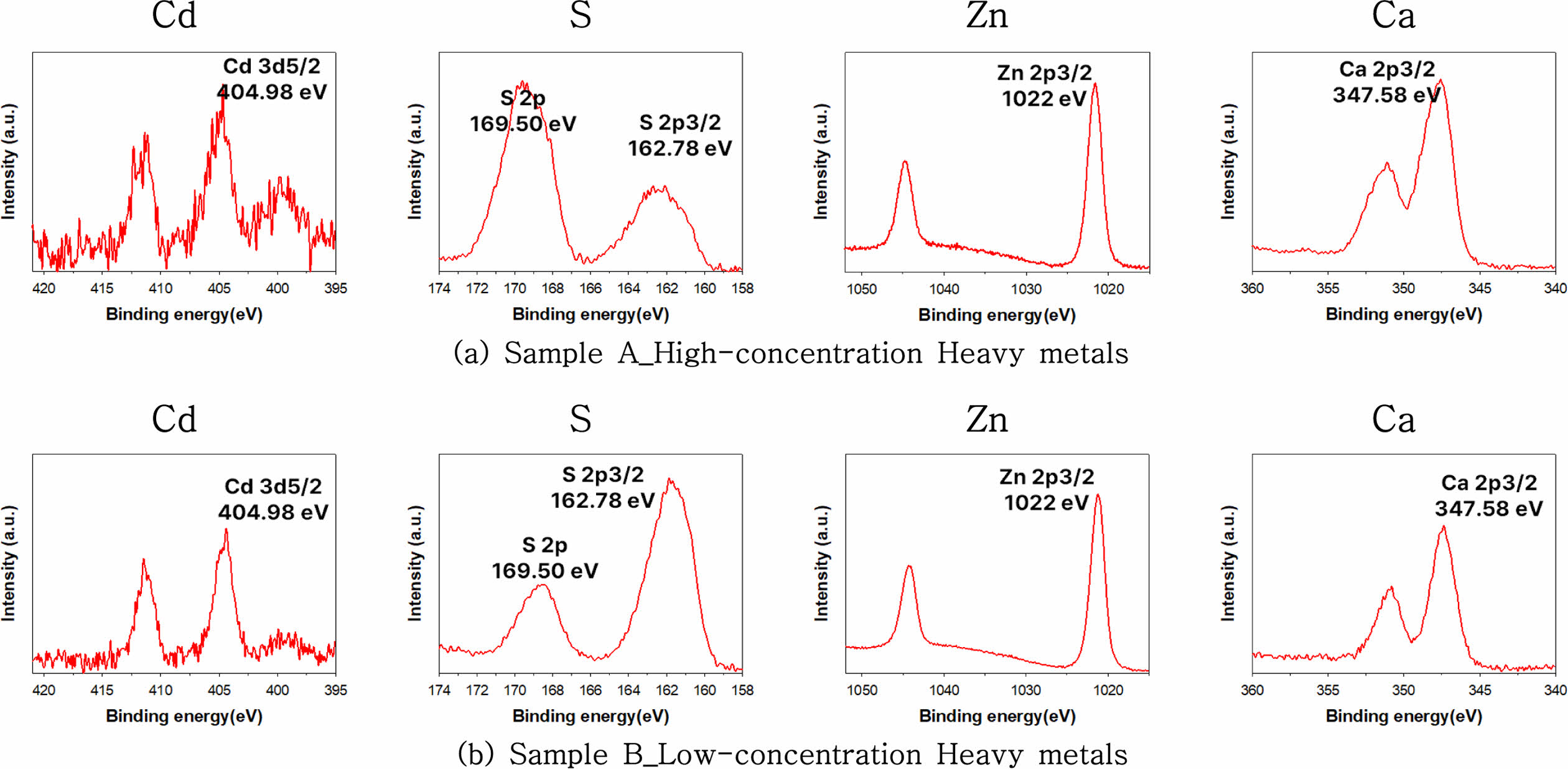
고농도 및 저농도 중금속 침전물의 XPS 분석 결과를 Fig. 6(a), (b)에 제시하였다. Zn 2p3/2 peak는 1,022 eV에서 확인되었으며, 이는 ZnS의 결합 에너지와 일치하는 것으로 보고되었다(Zhang et al., 2019; Simon et al., 2022). 이러한 결과는 Zn이 ZnS 형태로 존재함을 나타내며, 침전 반응에 의해 형성된 중금속 황화물임을 확인하는 결과이다. 추가적으로 S 2p3/2 peak가 162.78 eV에서 관찰되었는데, 이는 황화물(sulfide) 상태의 S를 나타내며 ZnS 구조에 기인한 것으로 판단된다(XPS Datebase, 2024). 그러나 Zn-S 결합 외에도 소량의 산화아연(ZnO)이 존재할 가능성을 배제할 수 없으므로, 이를 확인하기 위한 추가적인 분석이 필요하다.
Cd의 경우, Cd 3d5/2 peak가 404.98 eV에서 관찰되었으며, 이는 CdS의 결합 에너지(404.9~405.5 eV)와 일치하는 것으로 보고되었다(Cui et al., 2024; XPS Datebase, 2024). 이러한 결과는 Cd가 CdS 형태로 존재함을 나타내며, 침전 반응에 의해 형성된 중금속 황화물임을 시사한다. S 2p3/2 peak에서도 162.78 eV의 신호가 관찰되었으며, 이는 CdS의 황화물 구조와 일치한다. 그러나, Cd-S 결합 외에 CdCO3 같은 다른 형태의 존재 가능성도 고려될 필요가 있다.
Ca의 경우, Ca 2p3/2 peak가 347.58 eV에서 관찰되었으며, 이는 CaSO4와 같은 황산칼슘 결합에 기인한 것으로 판단된다. 그러나 이 peak는 단순히 CaSO4의 존재를 나타내는 것만이 아니라, Ca가 구조적으로 sulfate 또는 carbonate 내에서 결합된 형태로 존재할 가능성을 제시한다(XPS Datebase, 2024). S 2p peak가 169.5 eV에서 나타났는데, 이는 sulfate 그룹과 관련된 신호로 CaSO4의 존재 가능성을 강화하는 결과이다.
또한 Zn, Cd, Ca 외에도 시료에서 관찰된 다른 peak들에 대한 논의가 필요하다. 예를 들어, O 1s peak (531~532 eV)는 시료 표면의 산화물 또는 수산화물의 존재를 나타낼 수 있으며, 이는 침전물 형성 과정에서 물리적, 화학적 흡착반응과 관련이 있을 수 있다(Dupin et al., 2000; XPS Periodic Table, 2024). 이러한 결과는 침전물 표면에 중금속 황화물(ZnS, CdS)뿐만 아니라 기타 산화물과 황산염 구조가 혼재할 가능성을 나타낸다.
3.3.2. SEM-EDS 결과
XPS 분석에서 침전물 표면의 화학 상태와 결합 형태를 확인할 수 있었으나, XPS 분석은 표면에서 약 5~10 nm 깊이까지만 분석이 가능하다. 본 연구의 중금속 침전물 시료와 같이 다양한 종류의 중금속 및 결정, 비결정질 물질이 혼합된 복잡한 시료에서는 피크 간 구분이 어려워 정확한 결합 형태를 파악하는 데 한계가 있다(Fantauzzi et al., 2015). 이러한 표면 분석의 한계를 보완하기 위해 SEM-EDS 분석을 활용하여 침전물의 표면에 존재하는 원소 조성과 분포를 파악하였다. SEM-EDS는 X선 검출기를 활용하여 특성 원소의 분포와 농도를 시각화 할 수 있다(Kotula et al., 2023). 따라서 침전물 구성 상태 확인을 위해 SEM-EDS 분석을 진행하였다.
침전물의 SEM-EDS 결과를 Fig. 7(a), (b)에 제시하였다. 각각의 원소가 시료 내에서 어떻게 분포하는지 시각적으로 나타내어 특정 영역에 원소가 집중적으로 분포하는지를 확인하였다. 7(a)와 7(b) 모두에서 Zn가 존재하는 영역에 S의 분포가 겹치는 것이 확인되어, 침전물 내부에 ZnS가 존재하는 것으로 판단된다. Ca의 분포는 O의 분포와 겹치는 부분이 있으며, 해당 위치에서 S의 분포도 일부 겹치는 것이 확인되어 기둥 모양의 침전물이 CaSO4 침전물인 것으로 판단된다. Cd은 집중적으로 분포된 위치가 확인되지 않았지만 SEM 이미지에서 침전물 결정이 존재하는 부분에 고르게 분포하는 것이 관찰되었다. 대부분의 침전물 위치에 S가 분포하는 것이 확인되었으므로 Cd 또한 Zn와 유사하게 CdS 형태로 존재하고 있는 것으로 판단된다.
|
Fig. 4 Changes in heavy metal concentration and water qualities following the injection of varying concentrations of calcium polysulfide (CPS) in a batch reactor containing high concentrations of heavy metals (A sample). |
|
Fig. 5 Changes in heavy metal concentration and water qualities following the injection of varying concentrations of calcium polysulfide (CPS) in a batch reactor containing low concentrations of heavy metals (B sample). |
|
Fig. 6 X-ray Photoelectron Spectroscopy (XPS) results of the precipitates recovered from sample A (Fig. a) and sample B (Fig. b). |

|
Fig. 7 Scanning Electron Microscopy coupled with Energy Dispersive X-ray Spectroscopy (SEM-EDS) results of the precipitates recovered from sample A (Fig. a) and sample B (Fig. b). |
|
Table 2 Chemical properties and concentration of heavy metals and sulfate in groundwater samples |
|
Table 3 Comparison of the optimal mass ratios of CPS to Cd and CPS to Zn with initial concentrations of Cd and Zn between this study and previous studies |
본 연구에서는 고농도 및 저농도 복합 중금속으로 오염된 지하수의 정화를 위해 Calcium polysulfide (CPS)의 최적 주입 프로토콜을 도출하는 것을 목표로 하였다.
CPS 주입에 따라 pH는 증가하고 ORP는 감소하는 경향을 나타내었다. 이는 CPS가 중금속과 반응하여 금속 황화물을 형성한 후 잔여 CPS가 pH의 증가(pHCPS = 11.2~11.6) 및 ORP의 감소(ORPCPS = -240~260 mV)를 견인하기 때문인 것으로 판단된다. 중금속 농도에 따라 증가 폭의 차이는 있었으나, 지표의 변화 패턴은 동일하였다. 따라서, pH 및 ORP는 CPS 주입에 있어 유의한 지표(indicator)가 될 수 있다.
고농도와 저농도 중금속(Cd, Zn) 오염 지하수에서 CPS 주입에 따른 중금속 제거량과 최적 주입비를 도출, 비교하였다. 고농도 중금속 오염 지하수(sample A)에서 CPS가 0.3% 적용된 시료에서 Cd 및 Zn가 99% 이상 제거되었으며, CPS/Heavy metal weight ratio는 CPS/Cd = 2.29, CPS/Zn = 3.13이었다. 이는 이전 연구의 CPS/Cd = 1.45, CPS/Zn = 2.5 대비 상대적으로 높은 것으로 조사되었다. 저농도 중금속 오염 지하수(sample B) 내 CPS가 약 0.03~0.06% 적용된 시료에서 Cd 및 Zn가 99% 이상 제거 되었으며, CPS/Heavy metal weight ratio는 CPS/Cd = 15.88, CPS/Zn = 5.33인 것으로 조사되었다. 이는 이전 연구 및 본 연구의 고농도 조건에서 산출된 CPS/Heavy metal 대비 상대적으로 높은 것으로 조사되었다. 이러한 결과는 본 연구의 지하수 시료에서 CPS와 반응할 용존 중금속의 양이 상대적으로 소량이고, 소량의 중금속이 CPS와 반응을 통해 결정화 단계에서 결정색 생성 후 콜로이드 침전 과정을 통해 응결시 과량의 CPS가 필요하기 때문인 것으로 판단된다. 침전물의 XPS 분석 결과, 고농도 및 저농도 시료 모두에서 Zn 2p3/2 peak가 1,022 eV에서 확인되어 ZnS의 형성을 나타냈다. Cd 3d5/2 peak는 404.98 eV에서 확인되어 CdS의 존재를 확인하였다. 이는 CPS 주입으로 CdS 및 ZnS 형태의 중금속 황화물이 형성되었음을 의미한다. SEM-EDS 분석에서 Zn가 존재하는 영역에 S의 분포가 겹쳐 침전물 내부에도 ZnS가 존재하는 것을 확인하였다. Cd는 Zn과 달리 집중적으로 분포된 위치가 확인되지 않았으나, 침전물 내 고르게 분포하여 CdS 형태로 존재하는 것으로 판단된다.
결론적으로, 지하수 내 중금속 농도가 낮을수록 중금속 양 대비 침전에 필요한 CPS의 비율은 증가하였다. 따라서 중금속 농도에 따른 최적 주입량 산출 방법이 CPS 주입 프로토콜에 반영되어야 하며, 이를 통해 다양한 현장의 현장 특이적(site specific) 특성에 따른 중금속 저감이 가능할 것으로 예상된다. 그러나, 지중 내 침전물 형태로 고정 또는 격리된 침전물은 주변 환경의 산화환원 조건이 변할 경우 일부 재용출될 가능성이 존재한다. 이에 따라, 침전물에 인위적으로 산화 조건을 형성해 침전물의 침전 안정성 및 용출 저항성을 파악하는 추가 실험을 진행중에 있다.
본 연구는 환경부의 “폐자원에너지화 특성화대학원사업”에서 지원받아 수행되었으며 이에 감사드립니다.
- 1. Akiyama, M., Shinkai, Y., Unoki, T., Shim, I., Ishii, I., and Kumagai, Y., 2017, The Capture of Cadmium by Reactive Polysulfides Attenuates Cadmium-Induced Adaptive Responses and Hepatotoxicity, Chem. Res. Toxicol., 30(11), 2209-2217.
-

- 2. Aratani, T., Yasuhara, S., Matoba, H., and Yano, T., 1979, Continuous Removal of Heavy metals by the Lime Sulfurated Solution (Calcium Polysulfide) Process, Bull. Chem. Soc. Jpn., 52(1), 218-222.
-

- 3. Asmare, G., Getachew, B., Kassa, T., and Abate, W., 2021, Tannery wastewater treatment by coagulation-flocculation technique using combination of calcium polysulfide and ferrous sulphate, Am. J. Chem. Eng., 9(4), 79-83.
-

- 4. Aspillaga, L., Bautista, D.J., Daluz, S.N., Hernandez, K., Renta, J.A., and Lopez, E.C.R., 2023, Nucleation and crystal growth: Recent advances and fufture trends, Eng. Proc., 56, 22.
-

- 5. Cheng, S., Hong, X., Tang, H., Chu, Y., and Huang, C., 2018, Preparation of calcium polysulfide to remediate groundwater contaminated by hexavalent chromium, Proc. AMMMS, 518-524.
-

- 6. Choi, H.M. and Lee, J.Y., 2009, Green remediation: Choice for low CO2 emission in soil and groundwater remediation, J. Soil Groundw. Environ., 14(1), 11-17.
- 7. Chrysochoou, M. and Ting, A., 2011, A kinetic study of Cr(VI) reduction by calcium polysulfide, Sci. Total Environ., 409(19), 4072-4077.
-

- 8. Chrysochoou, M., Ferreira, D.R., and Johnston, C.P., 2010, Calcium polysulfide treatment of Cr(VI)-contaminated soil, J. Hazard. Mater., 179(1-3), 650-657.
-

- 9. Chrysochoou, M., Johnston, C.P., and Dahal, G., 2011, A comparative evaluation of hexavalent chromium treatment in contaminated soil by calcium polysulfide and green-tea nanoscale zero-valent iron, J. Hazard. Mater., 201-202, 33-42.
-

- 10. Cui, Y., Liao, Y., Sun, Y., Wang, W., Wu, J., Dai, W., and Huang, T., 2024, Advanced XPS-based techniques in the characterization of catalytic materials: A mini-review, Catalysts, 14(9), 595.
-

- 11. Dahlawi, S.M. and Siddiqui, S., 2017, Calcium polysulphide, its applications and emerging risk of environmental pollution—A review article, Environ. Sci. Pollut. Res., 24, 7842-7856.
-

- 12. Dupin, J.C., Gonbeau, D., Vinatier, P., and Levasseur, A., 2000, Systematic XPS studies of metal oxides, hydroxides and peroxides. Phys. Chem. Chem. Phys., 2(6), 1319-1324.
-

- 13. EFSA, 2010, Conclusion on the peer reviewed of the pesticide risk assessment of the active substances lime sulfur, J. EFSA, 8(11), 1890.
-

- 14. Esalah, J.O., Weber, M.E., and Vera, J.H., 2000, Removal of lead, cadmium and zinc from aqueous solutions by precipitation with sodium Di-(n-Octyl) phosphinate, Can. J. Chem. Eng., 78(5), 945-952.
-

- 15. Estay, H., Barros, L., and Troncoso, E., 2021, Metal sulfide precipitation: Recent breakthroughs and future outlooks, Minerals, 11(12), 1385.
-

- 16. Fantauzzi, M., Elsener, B., Atzei, D., Rigoldi, A., and Rossi, A., 2015, Exploiting XPS for the identification of sulfides and polysulfides, RSC Advances, 5, 75953-75963.
-

- 17. Finney, A.R. and Salvalaglio, M., 2023, Theoretical and computational approaches to study crystal nucleation from solution, Wiley, New York, NY.
-

- 18. Fruchter, J., 2002, Peer reviewed: In-situ treatment of chromium-contaminated groundwater, Environ. Sci. & Tech., 36(23), 464A-472A.
-

- 19. Go, H.W., 2023, Application of Calcium polysulfide in various media for remediation of high concentration heavy metal contaminated groundwater, MS diss., Hanbat National University.
- 20. Gross, S., Vittadini, A., and Dengo, N., 2016, Functionalisation of colloidal transition metal sulphides nanocrystals: A fascinating and challenging playground for the chemist, Crystals, 7(4), 110.
-

- 21. Hillis, B.G., Losey, B.P., Weng, J., Ghaleb, N., Hou, F., and Martin, J.D., 2017, From rate measurements to mechanistic data for condensed matter reactions: A case study using the crystallization of [Zn(OH2)6][ZnCl4], Crystals, 7(1), 11.
-

- 22. Hu, S., Li, D., Man, Y., Wen, Y., and Huang, C., 2021, Evaluation of remediation of Cr(VI)-contaminated soils by calcium polysulfide: Long-term stabilization and mechanism studies, Sci. Total Environ., 790, 148140.
-

- 23. Huang, C.Y., Cheng, P.C., Chang, J.H., Wan, Y.C., Hong, X.M., and Cheng, S.F., 2021, Feasibility of remediation lead, Nickel, Zinc, Copper, and cadmium-contaminated groundwater by calcium sulfide, Water, 13(16), 2266.
-

- 24. Jo, Y.D., Kim, H.S., and Ahn, J.W., 2007, Precipitation characteristics of heavy metal ions in coal mine drainage, J. Miner. Soc. Korea, 20(2), 125-134.
- 25. Jung, M.C. and Jung, M.Y., 2006, Evaluation and management method of environmental contamination from abandoned metal mines in Korea, J. Korean Soc. Miner. Energy Resour. Eng., 43(5), 283-394.
- 26. Kapusta, P. and Sobczyk, L., 2015, Effects of heavy metal pollution from mining and smelting on enchytraeid communities under different land management and soil conditions, Sci. Total. Environ., 536(1), 517-526.
-

- 27. Kotula, P.G., Keenan, M.R., and Michael, J.R., 2003, Automated analysis of SEM X-ray spectral images: A powerful new microanalysis tool, Microscopy and Microanalysis., 9(1), 1-17.
-

- 28. Kubier, A., Wilkin, R.T., and Pichler, T., 2019, Cadmium in Soils and Groundwater: A Review, Appl. Geochem., 108, 104388.
-

- 29. Lee, G.M., Kim, G.R., Choi, S.K., and Lee, T.J., 2020, A study on adsorption of heavy metals with zeolite and FeS Media, J. Korean. Soc. Environ. Eng., 42(7), 349-359.
-

- 30. Lee, S.W., Kim, J.J., Park, M.J., Lee, S.H., and Kim, S.O., 2015, Human risk assessment of arsenic and heavy metal contamination and estimation of remediation concentration within abandoned metal mine area, J. miner. Soc. Korea, 28(4), 309-323.
-

- 31. Leite, E.R. and Ribeiro, C., 2011, Crystallization and Growth of Colloidal Nanocrystals, Springer, New York, US.
- 32. Lewis, A.E., 2010, Review of Metal Sulfide Precipitation, Hydrometallurgy, 104, 222-234.
-

- 33. Lewis, A. E., Seckler, M., Kramer, H., and Rosmalen, G., 2015, Industrial crystallization: Fundamentals and Applications. England.
-

- 34. Li, Y.Y. and Zhang, T.T., 2021, Stability properties of chromium in Cr(VI)-contaminated soil stabilized by calcium polysulfide (CaS5), Nature Environ. & Pollut. Tech., 20(1), 377-383.
-

- 35. Luther, G.W., Theberge, S.M., and Rickard, D.T., 1999, Evidence for aqueous clusters as intermediates during zinc sulfide formation, Geochimica et Cosmochimica Acta, 63(19-20), 3159-3169.
-

- 36. McGinty, J., Yazdanpanah, N., Price, C., ter Horst, J.H., and Sefcik, J., 2020, Nucleation and crystal growth in continuous crystallization, handbook of continuous crystallization, The Royal Soc. of Chem., 1-16.
-

- 37. Migdisov, A.A., Willians-Jones, A.E., Lakshtanov, L.Z., and Alekhin, Y.V., 2002, Estimates of the second dissociation constant of H2S from the surface sulfidation of crystalline sulfur, Geochimina et Cosmochimica Acta, 66(10), 1713-1725.
-

- 38. Mpouras, T., Papassiopi, N., Lagkouvardos, K., Mystrioti, C., and Dermatas, D., 2020, Evaluation of calcium polysulfide as a reducing agent for the restoration of a Cr(VI)-contaminated aquifer, Bull. Environ. Contam. Toxicol., 105, 45-52.
-

- 39. Pohl, A., 2020, Removal of heavy metal ions from water and wastewaters by sulfur-containing precipitation agents, Water Air Soil Pollut., 231, 503.
-

- 40. Prokkola, H., Nurmesniemi, E.-T., and Lassi, U., 2020, Removal of metals by sulphide precipitation using Na2S and HS− solution, ChemEngineering, 4(3), 51.
-

- 41. Qian, Y., da Silva, A., Yu, E., Anderson, C.L., Liu, Y., Theis, W., Ercius, P., and Xu, T., 2021, Crystallization of nanoparticles induced by precipitation of trace polymeric additives, Nature Communications, 12(1), 2767.
-

- 42. Sankhla, M.S. and Kumar, R., 2019, Contaminant of heavy metals in groundwater & its toxic effects on human health & environment, Int. J. Environ. Sci. Nat. Resour., 18(5), 555996.
-

- 43. Simon, P., Baldovino-Medrano, V.G., and Wojcieszak, R., 2022, X-Ray photoelecrton spectroscopy (XPS): Principles and application for the analysis of photoactive materials, Springer, 249-271.
-

- 44. Soya, K., Mihara, N., Kuchar, D., Kubota, M., Matsuda, H., and Fukuta, T., 2008, Selective sulfidation of copper, zinc and nickel in plating wastewater using calcium sulfide, World Acad. Sci. Eng. Technol., 44, 356-362.
-

- 45. Teh, C.Y., Budiman, P.M., Shak, K.P.Y., and Wu, T.Y., 2016, Recent advancement of coagulation-flocculation and its application in wastewater treatment, Ind. Eng. Chem. Res., 55(14), 4363-4389.
-

- 46. Tu, C., Guan, F., Sun, Y., Guo, P., Liu, Y., Li, L., Scheckel, K.G., and Luo, Y., 2018, Stabilizing effects on a cadmium polluted coastal wetland soil using calcium polysulphide, Geoderma, 332, 190-197.
-

- 47. U.S. DOE, 2007, Internet ref. https://www.ibl.gov/ERSP
- 48. U.S. EPA, 1999, Field applications of in situ remediation technologies: Permeable reactive barriers, DIANE Publishing.
- 49. U.S. EPA, 2000, Permeable Reactive Barriers for Inorganics, Washington, DC, 1-55.
- 50. U.S. FRTR, 2024, https://www.frtr.gov/matrix/Groundwater-Pump-and-Treat/
- 51. Wielinski, J., Huang, X., and Lowry, G.V., 2024, Characterizing the stoichiometry of individual metal sulfide and phosphate colloids in soils, sediments, and industrial processes by inductively coupled plasma time-of-flight mass spectrometry, Environ. Sci. Technol., 58, 12113-12122.
-

- 52. Wright, K.E., Hartmann, T., and Fujita, Y., 2011, Inducing mineral precipitation in groundwater by addition of phosphate, Geochemical Transactions, 12, 8.
-

- 53. XPS Database, XPS Reference Database, https://xpsdatabase.net/
- 54. XPS Periodic Table, Thermo Fisher Scientific., 2024, https://www.thermofisher.com/kr/ko/home/materials-science/learning-center/periodic-table/non-metal/oxygen.html
- 55. Yahikozawa, K., Aranani, T., Ito, R., Supo, T., and Yano, T., 1978, Kinetic studies on the lime sulfurated solution (Calcium Polysulfide) process for removal of heavy metals from wastewater, Bull. Chem. Soc. Jpn., 51(2), 613-617.
-

- 56. Yin, Y. and Allen, H.E., 1999, In situ chemical treatment, ground-water remediation technologies analysis center (GWRTAC), Pittsburgh, PA, 1-60.
- 57. Yoon, S., Jeong, S., Moon, C., and Nam, K., 2024, Removal of cadmium and zinc by calcium polysulfide in acidic groundwater: Injection ratio and precipitation mechanism, Chemosphere, 364, 143219.
-

- 58. Zhang, T., Wang, T., Wang, W., Liu, B., and Liu, Y., 2020, Reduction and stabilization of Cr(VI) in soil by using calcium polysulfide: Catalysis of natural iron oxides, Environmental Research, 190, 109992.
-

- 59. Zhang, X., Wu, H., Fu, E., and Wang, Y., 2019, In-depth characterization of secondary phases in Cu2ZnSnS4 film and its application to solar cells, Nanomaterials, 9(6), 855
-

- 60. Zhao, X., Joo, J.C., Kim, D., Lee, J.K., and Kim, J.Y., 2016, Estimation of the seedling vigor index of sunflowers treated with various heavy metals, J. Bioremediat. Biodegrad., 7(3),353.
-

- 61. Zhao, X., Joo, J.C., Lee, J.K., and Kim, J.Y., 2019, Mathematical estimation of heavy metal accumulations in helianthus annuus L. with a sigmoid heavy metal uptake model, Chemosphere, 220, 965-973.
-

- 62. Zhong, L., Qafoku, N.P., Szecsody, J.E., Dresel, P.E., and Zhang, Z.F., 2009, Foam delivery of calcium polysulfide to the vadose zone for chromium(VI) immobilization: A laboratory evaluation, Vadose Zone J., 8(4), 976-985.
-

 This Article
This Article
-
2024; 29(6): 49-59
Published on Dec 31, 2024
- 10.7857/JSGE.2024.29.6.049
- Received on Oct 19, 2024
- Revised on Nov 18, 2024
- Accepted on Nov 22, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jin Chul Joo
-
Department of Civil and Environmental Engineering, Hanbat National University, Daejeon 34158, Korea
- E-mail: jincjoo@hanbat.ac.kr





