- Nitroglycerin Biodegradation under Denitrification Conditions and Corresponding Microbial Community Shifts upon Acclimation
Wonchul Choi·Bumhan Bae*
Department of Civil & Environmental Engineering, Gachon University
- 탈질조건에서 nitroglycerin의 생물학적 분해 동역학 및 미생물 군집 변화
최원철·배범한*
가천대학교
Biodegradation of an explosive compound, glyceryl trinitrate (GTN), was studied with a denitrifying microbial culture grown in a
sequencing batch reactor and a GTN acclimated denitrifying culture. The GTN
acclimated culture, which were fed on GTN for 1 month, degraded GTN
regioselectively via denitration on C1 position as compared to C2 position
denitration by denitrifying culture that has never been exposed to GTN.
Accumulation of two isomeric glyceryl dinitrates (GDNs) in both
culture medium suggests that GDN denitration is the rate-limiting step in GTN
biodegradation. The first order GTN degradation rate normalized to cell
concentration of the acclimated culture was calculated to be 0.045 (±0.002) L/g-hr. Increasing concentration of electron acceptor(nitrate)
resulted in discouraged GTN degradation. According to microbial community
analysis, prolonged GTN exposure resulted in 25% increase in the genus level of
the GTN acclimated culture with the disappearance of two dominating
denitrifying microbial species of Methyloversatilis universalis and Hyphomicrobium
zavarzinii in the denitrifying culture.
Keywords: Denitration, Denitrification, GTN, Microbial shift, Reaction rate, SBR
Nitroglycerin은(Fig. 1) glyceride에 3개의 질산기가 첨가된 강력한 화약물질로, 이탈리아 화학자
Asconio Sobrero가 처음 합성하였으며 화학식명은 glyceryl trinitrate (GTN)이다(Husserl,
2011). GTN의 LogKOW는 1.62로, 대표적인 고폭 화약물질
RDX(hexahydro-1,3,5-trinitro-1,3,5-triazine)의 0.86에 비해 약 2배 높고
TNT(2,4,6-trinitrotoluene)의 1.86보다는 낮지만, 용해도가 1,250~ 1,950 mg/L로 높아 수용액에
존재하려는 성질을 갖는다(Pichtel, 2012).
GTN은 군용추진체에 많이 사용되는 화약물질로, 생산시설 폐수와 포탄 추진체의 불완전연소 및 불발탄에 의해 환경을 오염시키며, 사격장에서는
피탄지 보다 사격지점에서의 오염도가 높다. 미국 Camp Edwards 사격장 토양시료 515개에서 1.94%에서만 GTN이 검출되었고, 평균농도와
최댓값은 각각 15.2 및 51.7 mg/kg으로 오염도가 높지 않았다(Pennington et
al., 2006). 캐나다 Gagetown 군 사격장에서는 사격지점 후방 0~10 m 지점에서 4,700
mg/kg의 고도오염이 관측되었지만, 후방 30~40 m에서는 84 mg/kg로 급격히 감소하였다(Thiboutot
et al., 2004). 이상의 연구 결과와 같이 군 사격장 GTN 오염은 사격지점을 중심으로 국부적 고도오염이 발생하지만 오염범위는 넓지 않다.
생산 시설에서도 GTN이 배출되나, 타 공정에서 발생하는 폐수에 의해 희석되어 그 농도는 4.8 mg/L에 불과하였다(Cyplik
et al., 2012). 환경으로 유출된 GTN은 토양 및 지하수에 존재하는 미생물에 의해 분해되기도 하지만(Attaway, 1994), 높은
용해도와 이동성으로 하천 및 지하수를 오염시킨다.
생태계와 인간에 대한 GTN의 독성에 대한 연구도 활발히 진행되었다. 쥐의 경구 LD50이 80~100 mg/kg으로 높고, 체내로
흡수된 GTN은 nitroreductase에 의해 glyceryl-dinitrate(GDN) 및 glyceryl-mononitrate(GMN)로
전환된 후 glycerol을 거쳐 완전히 분해되었다(Dacre and Rosenblatt, 1974). 동물(개) 실험에서 흡입독성은 관측되지
않았으나, 0.1 g/kg의 GTN 정맥주사 후에 미미한 심장 이상과 GDNs의 반감기가 2배 증가되었고,
GTN의 피부 흡수도 처음으로 확인되었다(Dilley, 1976). Bentley et al.(1978)은 조류, 무척추동물 및 어류 각 4종을
대상으로 실험한 결과, 무척추동물의 LC50값이 어류에 비해 약 10배 높았고, 어류에 대한 유수 및 정지 독성실험 결과에서
급성 LC50은 1 mg/L 이상으로 동일하기에 누적독성은 없다고 보고하였다. 그러나
2년간 동물에 대한 장기 노출실험에서 GTN의 발암성이 확인되었을 뿐 아니라, 어류가 무척추동물에 비해 더욱 민감한 반응을 보였고, 0.22 mg/L에서도 유의적인 악영향을
주었다(Smith, 1986). 이 결과에 따라 발암위해도 10-6에서 1.4 ug/L의 강력한 수질기준을
제안하였으나, 미국 EPA에서는 수질에 대한 건강권고기준으로 5.0 ug/L을 설정하였다(US
EPA, 2009).
GTN은 글리세롤에 3개의 전자 친화적 질산기가 결합되어있어, 구조적으로 생물학적 난분해성물질이다. 그러나 활성슬러지 반응조에서
30 mg-GTN/L이
8~15시간 내에 제거되었는데, 순차적 탈질산기(denitration)반응에 의해 이성질체인
glycerol-1,2-dinitrate(1,2-GDN) 및 glycerol-1,3-dinitrate(1,3-GDN)이 생성된 다음,
glycerol-1-mononitrate (1-GMN) 및
glycerol-2-mononitrate(2-GMN)을 거쳐 glycerol로 분해되었다(Wendt et al., 1978).
토양에서 분리된 2종의 Pseudomonas 종도 GTN reductase에 의한 탈질산기 반응으로 GTN을 분해하여 탄소
및 질소원으로 사용하였다. GTN 분해에서는 P. putida 종은 탄소위치에 관계없이 무작위로 탈질산기 반응이 일어났으나, P.
fluorescens 종은 C2 위치에서 선택적 탈질산기 반응으로 GTN을 분해하여 NO2-를 생성하였다.
그러나 GMN은 효과적으로 분해되지 않았다(Blehart et al., 1997). 반면 농후 배양한 미생물은 GTN을 단일 탄소원과 질소원으로 사용하여
완전 분해할 수 있었는데, 질산기는 대부분 NO2-로 배출되었다. 이 연구에서 초기 농도 0.3 mM의 GTN은 62시간
후에, GDN은 90시간 후에 완전히 제거되었지만, GMN의 분해에는 약 260시간이 소요되어 GMN 분해가 제한단계이었다(Accashian
et al., 1998).
호기성-무산소 회분식 반응조에서 COD:GTN 비율 10:1 조건에서 5시간 처리하면 200 mg-GTN/L이 완전히
제거되었고, 반응조에 축적된 95 mg/L의 NO3-는 5시간의 무산소 탈질반응으로 모두 제거되었다(Pesari and Grasso,
1993). Accashian et al.(2000)은 연속회분식 반응조에서 순응미생물로 100 mg-GTN/L을 처리하였는데,
GDN의 탈질산기 반응이 제한단계임을 확인하였다. 혐기성 반응조에서 글루코오스를 탄소원으로 28일 만에 GTN을 완전히 분해하였으나, 호기성 조건과는
달리 C2 위치의 질산기를 선택적으로 제거함으로써 1,3-GDN 및 1-GMN 더 많이 축적되었고, GMN의 탈질산기 반응이 제한단계이었다(Christodoulatos
et al., 1997).
Marshall and White(2001)은 화약물질 제조공장 폐수의 배수구 토양에서 GTN을 분해하는 Pseudomonas
putida, Arthrobacter sp, Klebsiella sp. 및 Rhodococcus
sp. 4종의 미생물을 분리하여 특성을 조사한 결과, 호기성 미생물과 같이 C1 위치의 질산기를 선택적으로 제거하였다. 그 중, Rhodococcus
sp.는 GMN에서 탈질산기 반응으로 질산기를 제거하여 GTN을 완전 분해하였다. Arthrobacter sp. strain
JBH1은 탈질산기 반응으로 생성된 질산이온과 글리세롤을 각각 질소 및 탄소원으로 사용하였다(Husserl et al., 2010). 진균 Geotrichum
candidum은 2 mM 이하 농도에서 GTN을 1-GMN 및 2-GMN으로 분해하였으며(Ducrocq et
al., 1989), 목재 리그닌을 분해하는 곰팡이 Phanerochaete chrysosporium은 호기성 조건에서(Servant
et al., 1991), Pernicillium corylophilum Diercks은 탄소원(glucose)와 질소원(NH4NO3)의
존재 하에서 GTN을 분해하여 GDN과 GMN으로 전환하였으나(Zhang et al., 1997), 제거속도는 빠르지 않았다. Cyplik
et al.(2011)은 화약물질 생산공장에서 배출되는 3000 mg-NO3/L,
4.8 mg-GTN/L 및 1.9 mg/L의 nitroglycol을 함유하는 고농도 폐수를 C/N 비율은
4.0, pH 7~9 조건에서, 탈질미생물과 토양분리 미생물을 접종한 무산소 탈질반응조로 완전히 처리할 수 있었으나, 토양에서 분리한 혼합미생물군
접종이 실제 폐수처리에 필수적이었다. 해당 토양미생물 군집분석 결과, 혼합미생물군은 Alcaligenes xylosoxidans,
Citrobacter freundii, Comamonadaceae bacterium, Pseu- domonas sp.,
Pseudomonas stutzeri, Sphingobacterium kitahiroshimense, 및
Sphingobacterium sp.로 구성되었다.
토양에서의 GTN 분해는 생물학적 분해, 유기물 존재 여부 및 흡착이 상호 영향을 주고 있다. 사격장 토양을 채취하여 흡/탈착상수를
측정한 실험에서 순수 GTN의 흡착상수(Kd)는 0.9(mL/g)로 낮았다. 사격에 사용하지 않은 GTN의 Kd값은 살균제를 사용하면
0.6~1.1인 반면 살균제를 사용하지 않으면 7.9~10.5로 크게 증가되어, 생물작용에 의해 흡착이 증가하여 토양에서의 NG 이동이 지체됨을
보였다(Clausen et al., 2011). 토양유기물은 무산소 조건에서 여러 종류의 환원제로부터 전자를 전달하는 역할을 함으로써 GTN 분해를
증진하였고, 입자상 유기물이 있으면 토양에서 GTN을 흡착하여 이동을 저하시키고, 생물학적 분해가 발생할 수 있는 시간이 길어져 완전히 분해되었다(Bordeleau
et al., 2014a). 그러나 토양 칼럼실험에서 토양에 충분한 유기물과 영양물질이 있는 경우 용해된 GTN이 생물분해되지만, 영양물질 농도가
낮은 모래에서는 GTN 분해속도가 충분히 빠르지 않아 지하수 오염가능성이 있다고 하였다((Bordeleau et al., 2014b).
이상과 같이 GTN은 생물학적 분해가 가능하지만, 분해미생물과 조건이 선택적이라면 경제성과 효율성이 저하된다. 토양
근권 혹은 폐수처리장의 일반적인 탈질미생물에 의해 GTN 분해가 가능하다면, 오염토양 및 지하수는 자연감쇄 혹은 생물학적 활성화 공법으로, 폐수는
폐수처리장의 탈질반응조에서 경제적이고 효율적으로 처리할 수 있을 것이다. 이에 본 연구에서는 탈질조건에서의 GTN의 생물학적 분해 여부 및 처리 조건에 대한 연구를 수행하였다.
SBR(Sequencing Batch Reactor) 탈질반응조에서 배양한 탈질미생물과 GTN에
순응시킨 탈질미생물을 각각 배양하여, 두 미생물 군에 의한 GTN의
분해경로, 분해산물 및 제거율, 전자수용체가
주는 영향을 조사하였고, 미생물군집 변화를 분석하여 비교하였다.
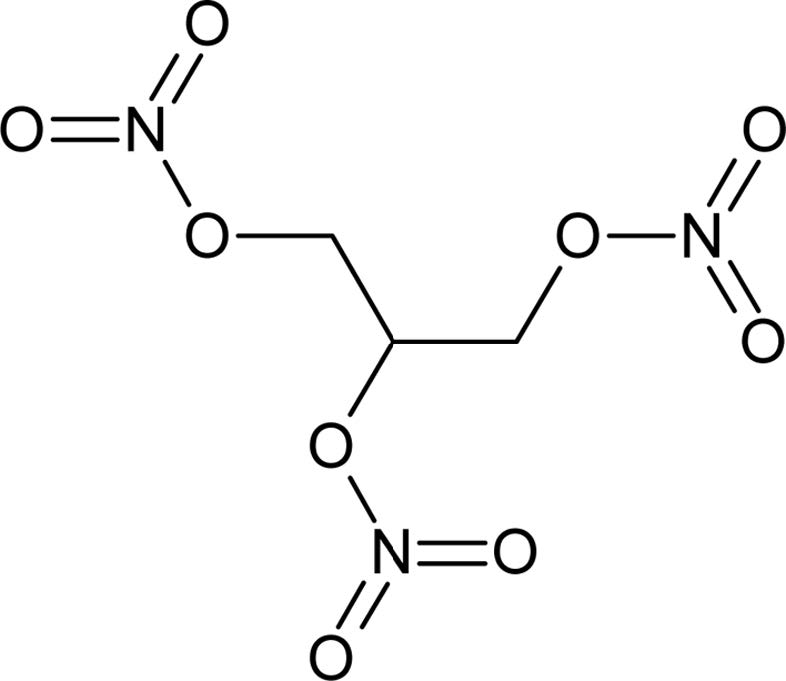
|
Fig. 1 Molecular structure of glycerol trinitrate. |
2.1. 탈질미생물 및 GTN
순응 탈질미생물 배양
활성이 높은 탈질미생물을 확보하기 위해, S시 공공하수처리장 2개소의 무산소조 반송관에서 탈질미생물을 채취하고, 실험실 SBR에서 배양하였다.
SBR은 온도, pH(Mettler Toledo), 용존산소(Hamilton Oxyferm 225)를 연속으로 관측하고 거품을 조절할 수 있는
용량 5 L의 발효기(Kobio Tech, 대한민국)로 작업용량은 4 L이었다. 운전조건은 유입
1분, 반응 22.5시간, 침전 1시간, 배출 0.5시간이며, 침전 후 침강액 1 L를 남기고 상징액 3 L를 연동펌프(Cole-Parmer)로
배출하였다. 이후 3 L의 인공 폐수와 탄소원으로 소량의 메탄올을 넣고 교반하면서, 초기시료와 3~4시간 간격으로
중간시료를 채취하여 액상 COD(Chemical Oxygen Demand), TSS(Total Suspended Solids),
VSS(Volatile Suspended Solids), TN(Total Nitrogen), TP(Total
Phosphorus), NO3-, NO2-, PO43-, pH 및 온도를 관측하였다.
사격장 혹은 화약물질 공장에서 배출되는 화약물질이 완전 산화되어 NO3-가 생성되고, 탈질에 사용되는 것으로 가정하여 TNT와 RDX 수용액을 오존으로 완전히 산화시켜
인공폐수를 제조하였고, 이 폐수의 NO3-, TN, TP 및 COD 농도는 각각 290, 70, 0.7 및 14.5 mg/L, pH는 6.6이었다.
메탄올 주입량은 식(1)에 근거하여, 폐슬러지 발생량을 최소화할 수 있는 유기물/질산성 질소(COD/NO3- 이하 C/N)비로 하였다.
이 최적조건을 찾기 위해 약 2달간 C/N 비를 변경하면서 계속 실험하였다.
5CH3OH + 6NO3- → 5CO2 + 3N2,g + 7H2O + 6OH- (1)
GTN 순응 탈질미생물(이하 GTN 순응미생물)은 다음과 같이 배양하였다. 갈색 삼각플라스크(500 mL) 8개에 하수처리장
무산소조에서 채취한 탈질미생물 100 mL를 넣고, 24시간 정치하고 진공 탈기한 수돗물 150 mL에 GTN 및 NO3- 최종농도가 각각 4 및 800 mg/L 되도록 제조하여
각 반응조에 주입하였다. 탄소원으로 메탄올 3,160 mg/L을 주입하였는데,
C/N비는 5.93:1이었다. 이후 GTN 순응반응조는 실리콘 마개로 밀봉하고 항온교반실(25oC)에서 100 rpm으로
교반배양하면서, 2일 간격으로 10분간 침전시켜 상징액 150 mL를 제거하고 초기 조건과
동일하게 GTN, NO3- 및 메탄올을 넣어 주었다.
순응여부는 미생물 성장과 배양액내 GTN의 농도감소로 판단하였는데, 한 달간 순응시킨 결과 배양 24시간 후 GTN 4 mg/L가 완전히 제거되었다.
2.2. 휴식세포실험
탈질미생물과 GTN 순응미생물에 의한 GTN 분해경로 및 제거속도를 비교하기 위해 휴식세포(resting cell) 실험을 수행하였다.
최적 조건에서 배양한 SBR 탈질미생물 및 GTN 순응미생물을 20,000 g(4oC)에서 원심 분리하여 수확하고,
탈기한 20 mM 인산염 완충액(pH 7.0)으로 3회 세척한 다음, 용량 500 mL인 갈색 삼각플라스크에
일정량을 주입하고 탈기한 인산염 완충액으로 250 mL이 되도록 하였다. 반응조
상부는 질소로 충진하고 실리콘 마개로 밀봉하여 항온교반실(25oC)에서 100 rpm으로 서서히 교반하였다.
이 때, 초기 GTN 농도는 6.0 mg/L로 하고, NO3-는 공급하지 않았다. 반응이 시작되고, 한 시간 간격으로 시료를 채취하여 GTN 및 부산물 농도를
UPLC (Ultra Pressure Liquid Chromatography)로 측정하였다. 반응 초기,
3시간 및 8시간 시료에 대하여는 TSS, VSS 및 NO3- 농도를 분석하였다. 각 미생물을 멸균하여 주입한 대조군을 동시에 운영하였고, 모든 반응조는
2배수로 실험하였다.
2.3. GTN 순응미생물에 의한 GTN
분해동역학
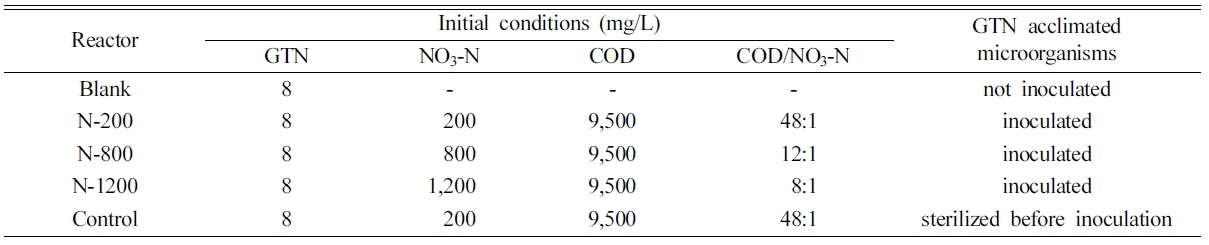
Resting cell 실험과 달리 GTN 순응미생물을 침전시켜 수확하고, 갈색 삼각플라스크(500 mL)에 순응미생물과
GTN이 용해된 메탄올 용액 2 mL 및 질산성 질소를 포함한 용액 250 mL을 Table 1과 같이
달리하여 주입한 다음 항온교반실(25oC)에서 100 rpm으로 천천히 교반배양하면서
GTN 분해속도를 측정하였다. 이 때, 초기 미생물농도(VSS)는 700 mg/L로 하였고, 미생물에
의한 GTN 흡착을 확인하기 위해 멸균미생물로 대조구(control)를, 광분해 등과 같은 무생물학적 제거를 확인하기 위한 무처리구(blank)도
함께 운영하였다. 반응초기, 3, 6 ,9, 12 및 24, 48시간에 시료를 채취하여 NO3-와 GTN 농도를 분석하고, 반응초기, 12, 24 및 48시간 시료에 대하여 TSS와
VSS를 측정하였다.
2.4. 화학물질 및 분석방법
GTN(순도>99%)은 메탄올에 1 g/L 농도로 용해하여
steel wool이 들어있는 금속제 용기에 안전하게 담긴 상태로 국방과학연구소에서 수령하여 운반한 다음, 방폭 화학물질 저장금고에 보관하였다.
폭발위험이 매우 큰 물질이므로 실험실에서 별도로 농축/정제하지 않았기 때문에, 고농도 GTN 실험을 위해서는 메탄올 주입량도 같이 증가하여 실험에
사용할 수 있는 GTN 농도는 매우 제한적이었다. 실험이 종료된 후, 잔여 GTN은 NaOH로 염기성 가수분해한 다음 처분하였다. GTN과 분해산물인
1,2-GDN, 1,3-GDN, 1-GMN 및 2-GMN의 표준물질은 AccuStandard(New Haven, CT, USA)에서 구입하였다.
또한 실험에 사용한 모든 화학물질은 HPLC 및 ACS 등급이었다.
미생물 농도, TN 및 TP는 수질오염공정시험방법에 준하여 실시하였는데, COD, TN, TP는 HACH사의 해당 vial로 분석하고
DR 4000으로 농도를 측정하였다. 액상 GTN은 0.2 um PVDF
syringe fliter로 시료여과 후, Waters UPLC H Class로 분석하였다. 분석조건은 유량 0.2 mL/min, H2O:ACN(Acetonitrile) = 60:40, 파장 214 nm, 칼럼온도 40oC, 시료 주입량 2.0 uL이며, Acquity
UPLC BEH C18 column(2.1×100 mm, 1.7 um) 칼럼으로 용리하였다. GTN 분해산물은 극성이 높아 별도의 용리조건으로 재분석하였다. 상기 방법과 동일한 분석법에서 용매 H2O:MeOH(Methanol)의
비율을 80:40에서 7분, 1분에 걸쳐 10:90으로 변경하여 6분 동안 유지한 다음, 1분에 걸쳐 80:20으로 환원하여 5분간 지속하였다.
질산성 질소(NO3-)는 IC(Ion
Chromatography)로 분석하였다. 질산성 질소 농도가 높을 경우에는 표준 검량선 범위(100 mg/L)내에 측정되도록
10~20배 희석하였다. 고순도 탈이온수(18.3 MΩ-cm)로 희석시킨 시료는
0.2 um PVDF syringe filter로 여과 후 Metrosep A Supp 4
column, Auto sampler로 구성된 Metrohm Compact IC 761으로 분석하였다. 분석 조건은 용리액(1.8 mM Na2CO3
+ 1.7 mM NaHCO3), 유량 1 mL/min,
suppressor 재생용액은 H2SO4 100 mM을 사용하였다. IC
측정 시 시료 1 set 시료의 측정 초기에 공시료를, 마지막에 표준물질을 같이 분석하는 분석품질관리를 실시하였다.
탈질미생물 및 GTN 순응미생물의 미생물군집은 (주)천랩에 의뢰하여
Illumina Misque 장비를 사용하여 NGS (Next-Generation
Sequencing) 방법으로 분석하였다.
|
Table 1 Experimental conditions for GTN degradation using GTN acclimated denitrifying microbial culture |
3.1. 탈질반응조 운전 결과
SBR 탈질반응조에 식종한 미생물을 인공하수에 순응시키고, 메탄올 주입량과 교반속도 등의 조건을 변화하면서 탈질미생물의 성장을 관측하였다.
용존산소 농도가 0.2 mg/L 이하로 유지되도록 교반하면서 탈질증진을 위해 메탄올 주입량을 증가하면 처리수 COD 농도가 200 mg/L 이상으로 증가하고
SBR 반응조 내 미생물이 과도하게 축적되었다. 최종적으로 매일 4 L당 0.8 mL의 메탄올을 주입하자
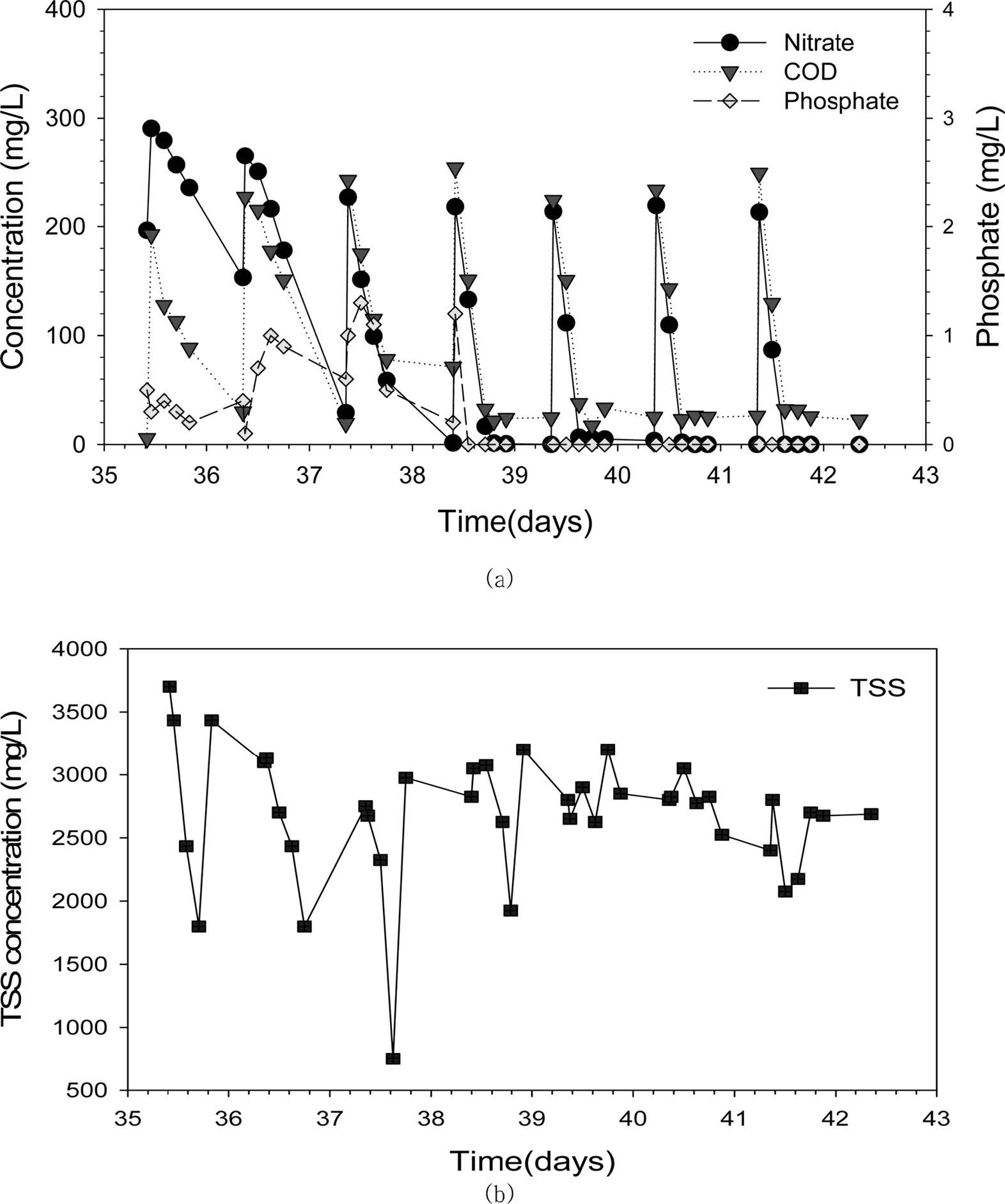
탈질율, 반응조 미생물 농도가 안정화되면서 정상상태에 도달하였다(Fig. 2a). SBR 탈질반응조에 원수를 유입시킨 다음 측정한 용액의 초기상태는
pH 7.3(±0.3), NO3-는 218.3(±4.9) mg/L, PO43-는 0.4(±0.5) mg/L, COD는 240(±10.8) mg/L이었고, 미생물 농도(TSS)는
2,800 (±142) mg/L이었다. 원수 유입과정에서 수류의 흐름에 의한 폭기로 DO가 증가하였으나,
3시간 내에 0.2 mg/L 이하로 감소하였다.
탈질미생물 배양을 위한 SBR의 운전 결과는 Fig. 2와 같다. SBR에 폐수원수와 탄소원(메탄올) 주입 후, 약 6~9시간까지
COD와 NO3-가 빨리 감소하였는데, 특히
NO3-는 99% 이상 제거되었다.
그 이후 COD는 더 이상 감소하지 않고 약 25 mg/L을 유지하였고(Fig.
2a). 미생물 지표인 TSS도 2,700 mg/L 정도로 큰 변동이
없었다(Fig. 2b). 이에 실험 39~41일 사이를 정상상태로 판정하였다. 정상상태에서 배출수 pH는 8.0(±0.2)로 탈질과정에서 배출된
알칼리도로 인해 증가하였고, COD는 4.5(±1.5) mg/L, NO3-는 0.3(±0.6) mg/L, PO43-는 0.6(±0.2)
mg/L이었다. 메탄올 주입으로 미생물 성장에 필요한 최소한의 에너지와 탄소원이 제공되었기 때문에 미생물 농도(TSS)는 2,669(±189)
mg/L로 일정하게 유지되었다.
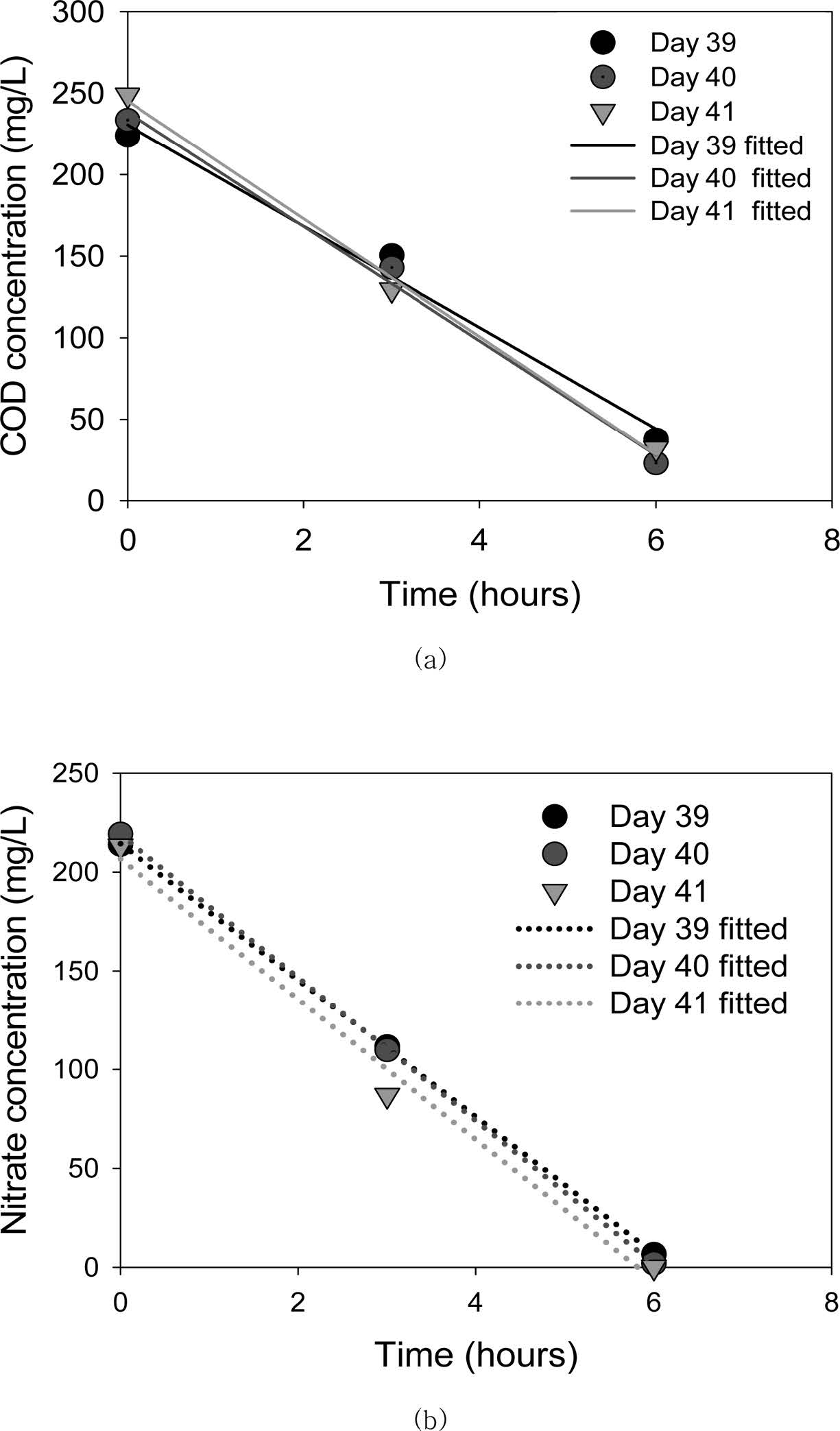
정상상태에서 COD와 NO3-는 0차 반응으로 제거되었으며, 제거상수는 각각 34.1(±2.7) 및 35.4(±0.8)
mg/L-hr로 일정하였다(Fig. 3). SBR 운전 기간
동안 반응조 미생물 농도(VSS)는 반응 시작 시(폐수원수 유입) 평균 2,520 mg/L이었고, 반응 종료
시에 2,430 mg/L로 TSS의 90%가 VSS 이었다. 미생물 농도에 일반화한 NO3- 탈질율을 반응 시작 시 미생물농도를 사용하여 구하면 다음 식 (2)와 같다. 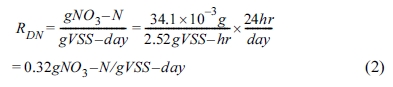
상기 값은 화약공장에서 배출되는 3,000 mg-NO3-/L 폐수를 C/N비 4.0 조건의 탈질반응조로 처리하였을 때 관측된 0.79 NO3--N/g VSS-day와 비교하면 약 50% 이상 낮다(Cyplick et al., 2012). 그러나 본 연구에서는 여분의 미생물 생성을 최소화하기 위해 C/N비 1.1로 하여
에너지원을 제한하였기 때문이라 판단되며, 타 문헌에서는 메탄올을 탄소원으로 사용했을 때 관측된 탈질율의 최곳값에 해당하는 결과이었다(Sedlak,
1981). 이에 SBR에서 주어진 배양 조건에서 빠른 탈질율을 가진 미생물군이 배양되어 안정적으로 탈질반응이 일어났다고 판단하고, GTN 분해실험에
탈질미생물로 사용하였다.
3.2. 휴식세포실험결과
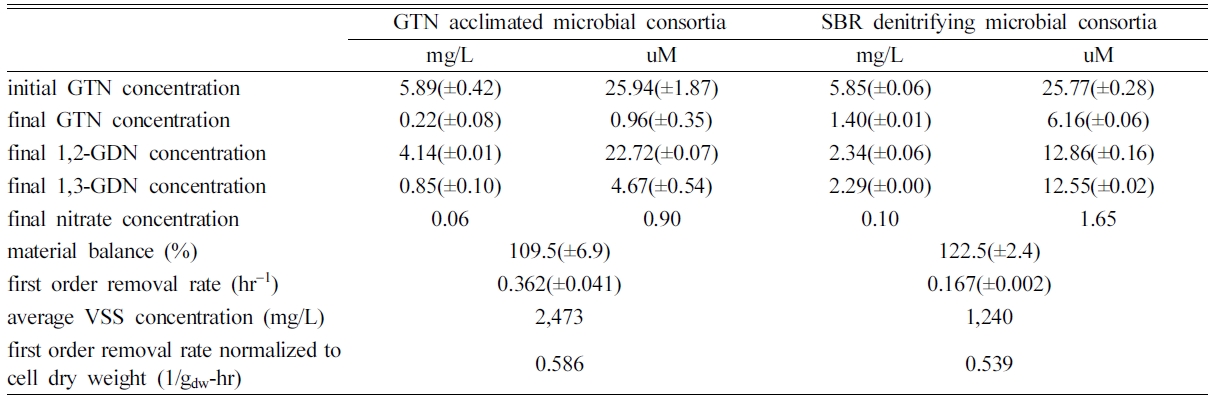
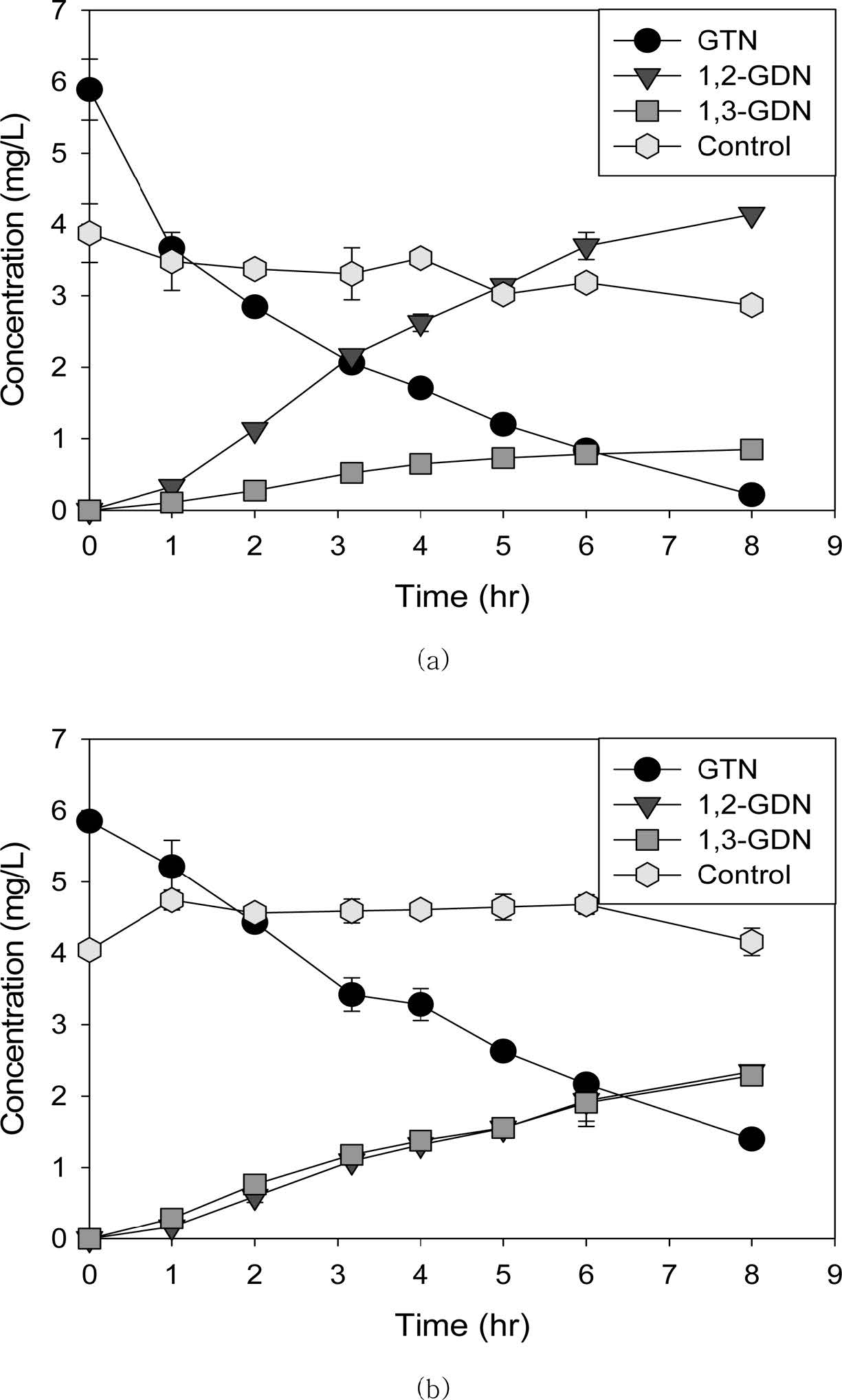
GTN 순응미생물과 SBR에서 배양한 탈질미생물로 휴식세포실험 결과는 Fig. 4와 같으며, 실험의 주요 결과는 Table 2에 요약하였다.
초기 GTN 농도(6.0 mg/L)는 두 미생물 군에서 모두 1차 반응으로 분해되었고, 멸균 접종한 대조군에서는 초기에
다량이 흡착되어 농도가 저감된 다음 분해는 일어나지 않았다. 반응 8시간 이후에는 GTN 순응미생물 반응조에서 초기농도의 96.3%가, 탈질미생물에
의해서는 76.1%만이 제거되었고, 중간 산물인 GDN이 축적되었다. 탈질산기 반응으로 생성된 NO3-를 두 미생물 군이 사용하였기에 최종농도가 각각 0.06 및 0.10 mg/L에 불과하였다.
두 미생물 군에 의한 1차제거상수는 GTN 순응미생물에서 0.36(±0.04) hr-1이며, 탈질미생물에서는
0.17(±0.00) hr-1로, GTN 순응미생물이
2배 이상 큰 값을 보였다(Table 2). 반응조 내 미생물 농도가 다르므로, 미생물 농도에 평균화한 1차제거상수(q)를 식 (3)에 의해 산정하면, GTN 순응미생물과 탈질미생물에서 각각 0.146 및
0.137 L/g-hr이다. GTN 순응미생물 VSS 평균농도가 2,473 mg/L로 탈질미생물의 평균농도 1,240 mg/L에 비해 약 2배
높기는 하지만, 순응과정에서 GTN의 악영향으로 직경 2~3 mm 정도의 단단한 구체형태로
뭉쳐있어, 잘 분산된 상태의 탈질미생물에 접촉 표면적은 넓지 않았다. 이는 Clausen et al.(2011)의 결과와 같이 생물분해가 발생하면
GTN의
흡착이 증가하여 응집을 유발한 것으로 판단된다. 그럼에도 GTN 순응미생물의 q값은 탈질미생물에 비해 약 10% 높았다. 
여기서, k는 1차 반응상수(hr-1), q는 미생물 농도에 평균화한 1차제거상수(L/g-hr), ![]() 는 미생물농도 평균값(g/L)
는 미생물농도 평균값(g/L)
반응 8시간 후, 1,2-GDN과 1,3-GDN 농도는 GTN 순응미생물에서 각각 4.14(±0.01) 및 0.85(±0.10)
mg/L이 생성되었고 탈질미생물에서는 각각 2.34(±0.06) 및 2.29 (±0.00) mg/L이
생성되었다. 몰수로 1,2-GDN/1,3-GDN 농도의 겉보기 비율을 계산하면 GTN 순응미생물 및 탈질미생물에서 각각 4.9 및 1.0이다.
GTN은 양단(C1 및 C3) 및 중앙(C3)에 NO2-가 있으므로 위치선택성(regio- selectivity)없이 무작위로 탈질산기 반응이 일어난다면
1,2-GDN/1,3-GDN 비율은 2.0이 되어야 한다(White and Snape, 1993). 두 중간산물비로 판단하면 GTN 순응미생물과
탈질미생물은 각각 선택적으로 양단 및 중앙의 NO2기를 제거하였다. GTN의 탈질산기 반응위치는 미생물에 따라 상이하다. 진균
Geotrichum candidum는 선택적으로 C2에서(Ducrocq et al., 1989), 다른 진균인 Phanerochaete
chrysosporium은 C1 위치에서 GTN을 분해하였다(Servent et al., 1991). 절대 혐기성 조건에서 배양한
혼합미생물은 C2에서 선택적인 탈질산기 반응으로 GTN을 분해하였다(Christodoulatos et al., 1996). 토양에서 분리한 4종의
GTN 분해미생물은, Arthrobacter 종은 C1에서, Klebsiella 종은 C2에서 NO2기를
제거한 반면, 나머지 Pseudomonas putida와 Rhodococcus 종은 선택적이지 않았다(Marshall
and White, 2001). 이상의 결과를 종합하면, GTN의 분해가 시작되는 지점은 미생물종, 더욱 정확히 미생물 효소체계에 의한 차이인
것으로 사료된다.
물질 수지를 계산하면 GTN 순응미생물 반응조는 109.5(±6.9)%, 탈질미생물 반응조는 122.5(±2.4)로 10~ 20%의 오차가 발생하였다. 이는 UPLC 분석에서 GDN 두 이성질체의 피크가 완전히 분리되지 않아 발생한 정량오차에 기인한 것으로
판단된다. GDN에서 탈질산기 반응이 거듭되면 1- 및 2-glyceryl mononitrate(GMN)가 생성된다. 본 연구에서 다양한 방법으로
GMN 두 이성질체를 UPLC로 분리하려 노력하였으나, 극성이 너무 높아 분리하지 못하였다. 또한 GMN이 용리되는 시간에서의 피크는 매우 미소하였다.
반응조에서 GDN이 생성되어 축적되는 과정이었고, GDN 분해가 GTN의 분해제한단계이며, 혼합미생물을 사용한 경우 GMN의 분해가 동시에 발생하기에(Accashian
et al., 2000), 다음 단계의(GMN) 농도는 매우 낮아 물질수지에 큰 영향을 주지 않을 것이라 판단된다.
SBR 반응조로 GTN을 처리하였을 때, GTN의 생물흡착량이 4% 이하이었고(Pesari and Grasso, 1993),
HPLC 분석과정 중에 시료보관용기(플라스틱 및 유리), 여과필터 및 septum에서 발생하는 GTN의 흡착손실량은 무시할 수 있다고 하였다(Accashian
et al., 2000). 그러나 Fig. 4에서와 같이 autoclave로 멸균한 다음 GTN을 주입한 경우, GTN 순응미생물 및 탈질미생물
반응조에서 각각 50.7 및 29.0%의 흡착손실이 발생하였다. 이를 미생물농도로 평균화하면 각각 1.22 및 1.37 mg-GTN/gdw이었다. GTN의 LogKOW는
1.62이므로 멸균과정에서 미생물 원형질 내 지질이나 세포벽의 인지질이 남아있을 경우, GTN의 흡착이 가능할 것이라 판단된다. 이 결과는 토양에서의
GTN 거동에도 흡착이 중요한 요소임을 시사하고 있다. 개인화기 사격장 토양을 사용한 흡착실험에서 GTN의 토양흡착은 24시간 내 평형을 이루었고
흡착 Kd 평균값은 0.9 L/kg으로 토양유기물함량 및 양이온교환 능에 영향을 받았다. 반면 탈착은 미생물활동을 억제하였을
경우에만 가능하였으며, 탈착 Kd 평균값은 1.6 L/kg으로 흡착에 비해
1.8배 높았다(Clausen et al. 2010). 즉 토양으로 배출된 GTN의 생물학적 분해는 흡∙탈착에 영향을 주어 GTN의 토양 내에서의 거동을 제어할 수 있는
주요 요인인 것과 같이, 본 실험에서도 대조구에서 흡착손실이 중요한 변수가 되었다.
3.3. GTN 분해에 탄소원 및 질산성
질소가 미치는 영향
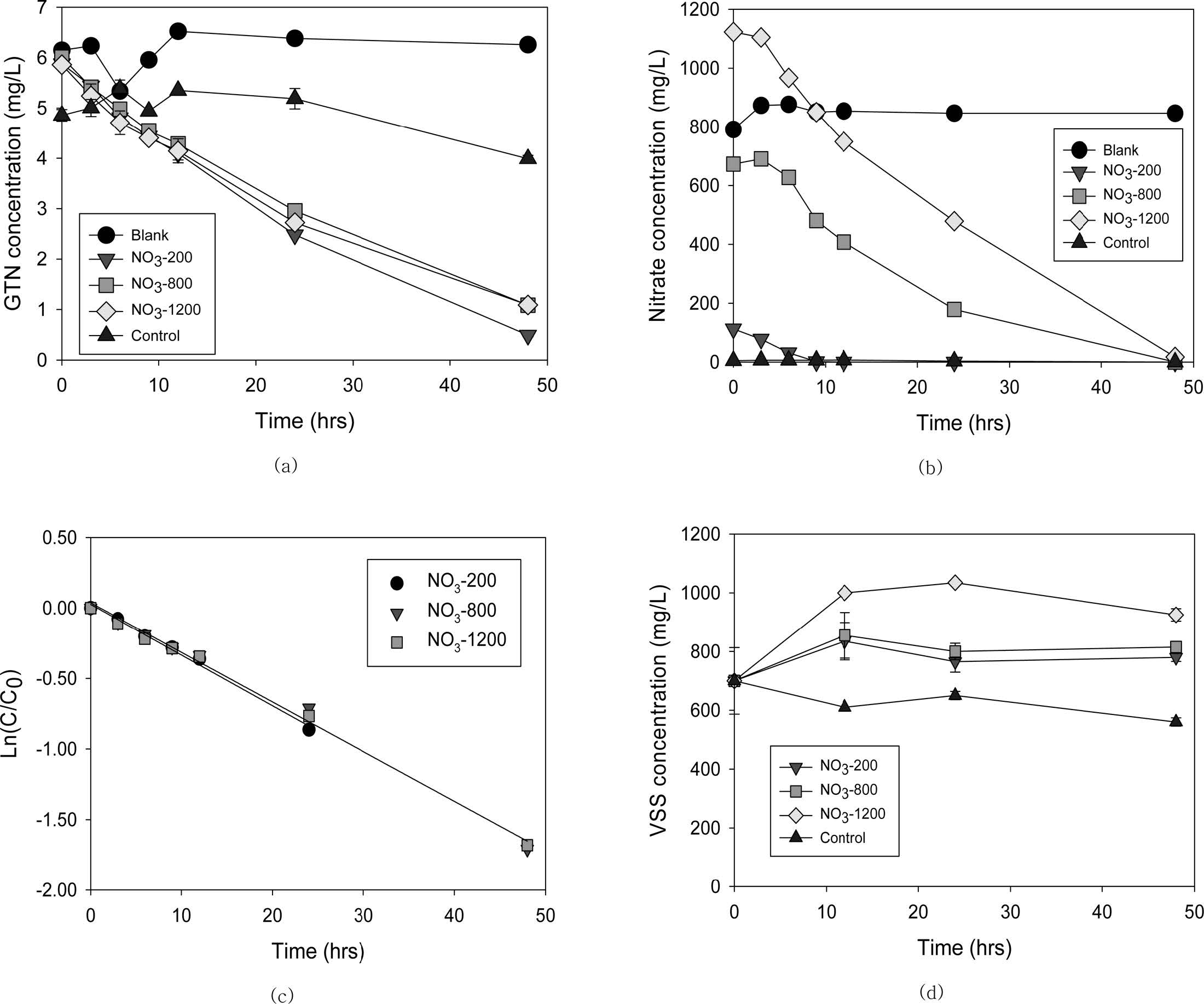
순응미생물에 의한 GTN 분해에 NO3- 농도가 미치는 영향을 확인하기 위해 Table 1과 같이 초기 탄소원(COD)을 9,500 mg/L로 충분히 공급하고
NO3- 농도를 200, 800 및 1,200 mg/L로 변화하며 실시한
분해실험 결과는 Fig. 5와 같다. 무처리구와 멸균미생물 반응조인 대조구에서는 GTN 분해는 일어나지 않았고, 크로마토그램에도 분해산물이 관측되지
않았다. 상기한 바와 동일하게 흡착으로 GTN이 초기농도 대비 약 20% 감소하였는데, 단위 미생물 중량당 흡착량은 1.52 mg-GTN/g-cell로
휴식세포실험
결과와 비교하면 25%의 오차 밖에 나지 않았다.
대조군 및 무처리군을 제외하고 GTN 순응미생물을 주입한 경우, GTN의 분해가 일어났다(Fig. 5a). 초기 NO3- 200 mg/L 반응조에서, 9시간
후에 NO3-가 모두 제거되었음에도 불구하고(Fig.
5b), GTN이 전체 실험기간동안 유사1차 반응으로 감소되어 48시간 이후에는 0.5 mg/L만 잔류하였다(Fig.
5a). 초기 NO3- 농도를 4배 혹은 6배 증가시켜도
순응미생물에 의한 GTN 분해속도에는 큰 영향이 없으므로, 주어진 조건에서 GTN 분해는 NO3- 농도에 독립적이다(Fig. 5c). 모든 반응조에서 1차제거상수값은 kGTN = 0.034(±0.001)
hr-1로 동일하였다(R2=0.99).
반면에 다량으로 주입한 NO3-는 탄소원과 함께 미생물 성장을 촉진하여, NO3- 1,200 mg/L 반응조에서 미생물
농도(VSS)는 초기 700 mg/L에서 24시간 이후 1,035 mg/L로 1.48배 증가하였고,
타 반응조에서도 미생물 성장이 관측되었다(Fig. 5d).
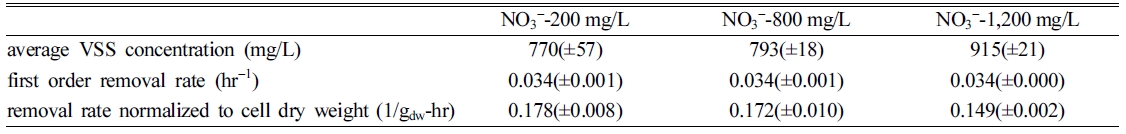
이에 각 반응조 미생물농도에 평균화한 1차제거상수 q값을 산정하면 Table
3과 같다. 초기 NO3- 농도가 200, 800,
1200 mg/L로 증가할수록 q값은 각각 0.045(±0.002), 0.043(±0.003)
및 0.037(±0.003) L/g-hr로 감소하였는데, 휴식세포실험의 0.146 L/g-hr에 비해 약
30% 수준으로 불과하였다. 이 q 값은 호기성 SBR로 처리하였을 때 관측된 0.60~0.97 L/g-hr에 비하여
10-1 정도이지만(Accashian et al.,
2000), 혐기성 처리에서 관측된 0.005~0.0006 L/g-hr(Christodoulatos
et al., 1996)에 비하면 101 정도 높은 값이다.
미생물 종류와 배양 조건에 따라 외부 탄소원 및 질소원이 GTN 분해에 주는 영향은 다양하게 보고되고 있다. 초기에 GTN의 생물학적
분해는 공대사(cometabolism)으로 인식되었으나(Pesari and Grasso, 1993; Zhang et al., 1997),
GTN을 탄소 그리고/혹은 질소원으로 사용하는 다양한 미생물이 분리되면서, GTN 분해율 향상에 대한 연구로 변경되었다. 진균 Geotrichum
candidum의 GTN 분해는 유기물 및 유기질소원 농도에 영향을 받지 않았지만(Ducrocq et al., 1989), GTN을 탄소/질소원으로
사용하는 호기성 미생물도 glycerol 및 pyruvate가 존재할 때 GTN 분해율이 증가하였다(Halecky et al., 2014).
GTN을 탄소 및 질소원으로 사용하는 미생물종도 배양액에(NH4)2SO4를 첨가하면
GTN 분해율이 증가하였다(Blehert et al., 1996).
무산소 및 호기성 조건에서도 외부 탄소원을 첨가하면 GTN 분해가 증진되었는데(Saad et al., 2010), 입자상 유기물질은
분해에 필요한 에너지를 공급할 뿐 아니라 상기한 바와 같이 GTN을 흡착함으로써 토양에서의 이동이 지체되었다(Bordeleau et al.,
2014a). 호기성-무산소 2단 회분식 반응조에서 초기 NO3- 농도 3,000 mg/L, COD
22,000 mg/L, GTN 1.9 mg/L인 폐수 처리에서
5일 내 GTN은 제거되었으나 탈질에 총 13일이 소요된 반면, 조의 순서를 무산소-호기성 2단 활성슬러지로 처리할 경우 GTN 제거에는 7일,
탈질은 6일에 완결되었다(Cyplik et al., 2012). 이상과 같이 외부탄소원을 공급하면 GTN의 분해를 촉진하였으나, 본 연구에서와
같이 NO3- 농도 증가에 따른 GTN
분해율 감소는 보고된 바 없다. 이 결과는 GTN 순응미생물에서 이화에 용이한 메탄올과 NO3-를 에너지원과 전자수용체로 사용함으로써 GTN 제거율이 감소하였기 때문이라 판단된다.
3.4. 미생물 천이
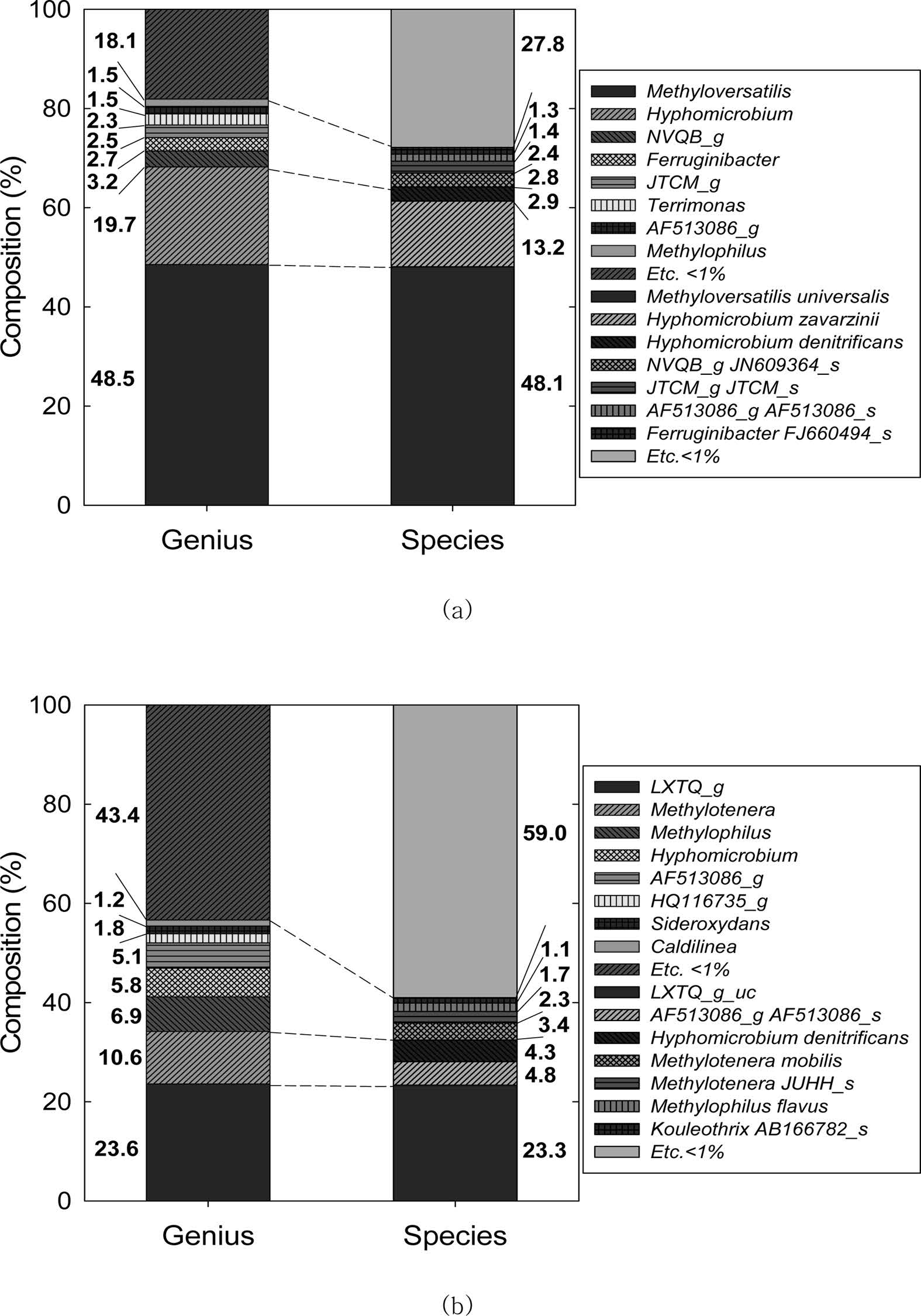
3.4.1. SBR 탈질미생물 군집
SBR 탈질반응조가 정상상태로 운영되었던 기간(Day 41)에 탈질미생물 시료를 채취하여 GTN 순응미생물과 같이 (주) 천랩에 송부하여
미생물 군집을 분석하였다. SBR 탈질미생물은 Proteobacteria 77%, Bacteroidetes 16%, Chloroflexi 4%
및 기타 3%로 구성되었고, 총 340속 477종이 속하였다. 그 중에서 Methyloversatilis universalis 종이 48.1%로 우점하고
있고, Hyphomicrobium zavarzinii 종이 13.2%, 다음으로 Hyphomicrobium
denitrificans 종이 2.9%를 구성하고 있다(Fig. 6a). 속(Genus)로
구분하면, 메탄올을 탄소원으로 이용하는 Methylophilus 속이 48.5%로 우점하고 있으며, 다음으로 Hyphomicrobium이
19.7%이었다.
탈질에 필요한 탄소원으로 메탄올을 사용하였으므로 Methylophilus 속 미생물이 우점한 것으로 사료된다. Methylophilaceae과에는
Methylophilus, Methylobacillus, Methylovorus 및 Methylotenera
종이 속하는데, 절대 혹은 제한적 통기성(facultative) 그램음성 단간균이며, 메틸영양미생물로 메탄올 혹은 메틸아민을 단일탄소원 및 에너지원으로
사용하지만 메탄은 사용할 수 없다(Doronina et al., 2014). 두 번째로 우점하는 Hyphomicrobium 종은 메탄올을
에너지원으로 사용하는 주요한 탈질미생물로, H. denitrificans, H. zavarzinii 및 H.
nitrativorans 종이 가장 대표적이다. 그 중에서 H. nitrativorans는 염도 및 NO3- 농도가 높은 조건에서 우점한다(Martineau
et al., 2015). 본 연구의 SBR 반응조 내 NO3- 농도는 반응초기를 제외하고 50 mg/L 정도로 낮기 때문에
H. nitrativorans 종이 우점하지 않고, H. denitrificans 및 H. zavarzinii 종이
우점하였다. 이상의 결과에서와 같이 SBR 탈질미생물은 메탄올을 탄소 및 에너지원으로 사용하며 저농도 질산성 질소에 적합한 탈질미생물로 구성되었기에
문헌상에서 보고된 최고의 탈질율을 달성하게 된 것이라 판단된다.
3.4.2. GTN 순응 탈질미생물 군집
GTN에 순응미생물의 미생물 군집을 분석하여, 탈질미생물과 비교하였다. GTN 순응 탈질미생물은 Proteo- bacteria 72%,
Chloroflexi 12%, Bacteroidetes 9%, Chlorobi 2% 및 기타 5%로 구성되었으며, 404속 547종이 박테리아를
포함하고 있다. GTN 순응 후, Chloroflexi 비율이 3%에서 12%로 증가하였다. 최우점 미생물은 Fig. 6b에서와 같이 Methylophilaceae에
속하는 미지의 미생물속인 LXTQ_g_uc(23.6%)이었고, 다음으로 Methylotenera 속(10%), Methylophilus
속(6.9%) 및 탈질미생물인 Hypho- microbium 속(5.8%)의 순이었다.
메탄올이 탄소원이어서 메틸영양생물이 여전히 우점하고 있으나, GTN의 영향으로 Methyloversatilis속이 쇠퇴하고 다른 메틸영양생물로
우점종 천이가 일어났다. 미생물속중에서 Rhodocyclales목에 속하는 Dechloromonas
denitrificans 종이 0.1% 검출되었는데, 이 미생물은 질산성 질소를 전자수용체로 사용할 뿐 아니라, 질산성 질소가 소모되면
perchlorate를 전자수용체로 사용하는 미생물이다(Wan et al., 2016). 따라서 본 연구에서 개발한 GTN 순응 미생물은, 폐탄처리장
혹은 사격장 발사지점에서 배출된 perchlorate도 처리할 수 있을 것으로 사료된다.
|
Fig. 2 Temporal changes of (a) COD, nitrate and phosphate concentration, (b) total volatile suspended concentration in the denitrifying sequencing batch reactor. |
|
Fig. 3 Estimation of zero order removal rate of (a) COD, (b) nitrate during steady state operation in the denitrifying sequencing batch reactor. |
|
Fig. 4 Changes in GTN and its metabolites concentration in the resting cell experiments. (a) GTN acclimated denitrifying microbial culture, (b) denitrifying microbial culture. |
|
Fig. 5 Results of batch experiments with GTN acclimated denitrifying microbial culture. (a) GTN concentration, (b) nitrate concentration, (c) estimation of first order reaction rate, (d) temporal changes in volatile suspended solids. |
|
Fig. 6 Microbial community analysis results of genius and species level. (a) SBR denitrifying microbial culture, (b) GTN acclimated denitrifying microbial culture. |
|
Table 3 Data summary of GTN degradation by GTN acclimated denitrifying microbial culture |
탈질조건에서 미생물의 순응 여부, 전자수용체의 농도 및 외부탄소원이 화약물질 GTN의 생물학적처리에 주는 영향을 연구하였다. 휴식세포실험에서
탈질미생물과 GTN 순응 탈질미생물은 모두 탈질산기 반응으로 GTN을 분해하여 1,3-GDN 및 1,2-GDN이 반응조에 축적되었다. 그러나 탈질미생물군은
C2에서, 순응 탈질미생물은 C1에서 선택적 탈질산기 반응으로 GTN을 분해하여 미생물 군집이 변화하였음을 간접적으로 보였다. 탈질미생물의
GTN 순응 전후 미생물 군집을 비교한 결과, GTN 노출 전에 우점하였던 Methyloversatilis
universalis와 Hyphomicrobium zavarzinii 종이 쇠퇴하고, Methylophilaceae에
속하는 미지의 미생물과 Methylotenera 속이 우점하였다. 또한 구성 미생물속이 25%이상 증가하였고 우점종의 점유 비율이
감소하여, 미생물 종 다양성이 증가하였다. 탈질미생물을 1개월의 짧은 기간 동안 GTN에 순응시킨 결과, GTN 제거율이 10% 증가하였다. 따라서
순응기간이 길어진다면 GTN의 분해속도도 증가시킬 수 있으며, 지속적인 연구가 수행된다면 GTN 분해에 최적화된 미생물제제를 확보할 수 있을 것이다.
회분식 반응조에서 충분한 탄소원이 공급되었을 때 전자수용체(NO3-) 농도가 증가할수록 GTN 제거상수는 감소하였는데, 미생물 군이 GTN 분해보다 NO3-에 대한 친화력이 높기 때문일 것이라 판단된다. 주어진 NO3- 농도 200 mg/L에서 미생물량에 평균화한
1차제거상수값은 0.043(±0.003)L/g-hr이었고, 이 값은 문헌상의 혐기성 조건에서의 GTN 분해율의 약 101배,
호기성 조건에서의 GTN 분해율의 10-1 배에 해당하였다. 호기성
조건에 비하여 분해속도는 느리지만, 폐수처리 탈질반응조 혹은 토양 근권에서 GTN과 질산성 질소를 동시에 제거함으로써, 하천 혹은 지하수로 유입되는
질산성 질소를 감소시킬 수 있는 장점이 있다.
GTN은 환경으로 배출되는 농도가 높지 않으나, 인체에 큰 위해를 줄 수 있는 물질이며, 국내 사격장 및 화약생산 및 처리시설의 폐수로 배출될
가능성이 높은 물질이다. 그러나 배출 농도에 대한 자료가 없고, 안전문제로 인해 고농도 GTN에 대한 생물학적 처리실험을 수행하지
못하였다. 향후, 추가 연구가 지속된다면 고농도 GTN에 순응된 미생물의 개발하여 배양 조건이 미치는 영향을 연구하여 본 연구와 비교해 보는 것도
필요할 것이다.
본 연구는 국방과학연구소 과제번호 UE161121GD의 연구비 지원과 가천대학교 일부 연구비 지원으로 수행되었습니다.
- 1. Accashian, J.V., Vinopal, R.T., Kim, B.J., and Smets, B.F., 1998, Aerobic growth on nitroglycerin as the sole carbon, nitrogen, and energy source by a mixed bacterial culture, Appl. Environ. Microbiol., 64(9), 3300-3304.
- 2. Accashian, J.V., Smets, B.F., and Kim, B.J., 2000, Aerobic biodegradation of nitroglycerin in a sequencing batch reactor, Water Environ. Res., 72(4), 499-506.
-

- 3. Attaway, H., 1994, Biodegradation of Nitroglycerin and Perchlorate in Propellant Wastewater, AFRL-ML-TY-TR-1998-4547, Airbase and Environmental Technology Division Manufacturing and Materials Directorate, Air Force Research Laboratory, Tyndall Air Force Base, Florida, USA.
-

- 4. Blehert, D.S., Becker, K., and Chambliss, 1996, Isolation and Characterization of Bacteria that Degrade Nitroglycerin, US Department of Defense, Defense Technical Information Center, ADP017717.
- 5. Blehert D.S., Knoke K.L., Fox B.G., and Chambliss G.H., 1997, Regioselectivity of nitroglycerin denitration by flavoprotein nitroester reductases purified from two Pseudomonas species, J. Bacteriol., 179(22), 6912-6920.
-

- 6. Bordeleau, G., Martel, R., Bamba, A.N., Blais, J.-F., Ampleman, G., and Thiboutot, S., 2014a, Nitroglycerin degradation mediated by soil organic carbon under aerobic conditions, J. Contam. Hydrol., 166, 52-63.
-

- 7. Bordeleau, G., Martel, R., Drouin, M., Ampleman, G., and Thiboutot, S., 2014b. Biodegradation of nitroglycerin from propellant residues on military training ranges, J. Environ. Qual., 43(2), 441-449.
-

- 8. Christodoulatos, C., Bhaumik, S., and Brodman, B.W., 1996, Anaerobic biodegradation of nitroglycerin, Water Res., 31(6), 1462-1470.
-

- 9. Clausen, J.L., Scott, C., Mulheerin, N., Bigl, S., Gooch, G., Douglas, T., Osgerby, I., and Palm, B., 2010, Adsorption/Desorption Measurements of Nitroglycerine and Dinitrotoluene in Camp Edwards, Massachusettes Soil., US Army Corps of Engineers, ERDC/CRREL TR-10-1.
- 10. Clausen J.L., Scott, C., and Osgerby, I., 2011, Fate of nitroglycerin and dinitrotoluene in soil at small arms training ranges, Soil Sediment Contam., 20(6), 649-671.
-

- 11. Cyplik, P., Mareeik, P., Pitrowska-Cyplik, A., Olejnik, Drozdzynska, A., Chrzanowski, L., 2012, Biological denitrification of high nitrate processing wastewaters from explosives production plant, Water Air Soil Pollut., 223, 1791-1800.
-

- 12. Dacre J.C. and Rosenblatt, D.H., 1974, Mammalian Toxicology and Toxicity of Aquatic Organisms of Four Important Types of Waterborne Munitions Pollutants-An Extensive Literature Evaluation(AD-778 725), US Army Medical Research & Development Command, Washington, DC, USA.
- 13. Dilley, J.V., 1976, Evaluation of the Occupational Health Hazards of Nitroglycerin Using Mammalian Models(AD A082459), U.S. Army Medical Research And Development Command, Fort Detrick, Frederick, Maryland, USA.
- 14. Doronina N., Kaparullina E., and Trotsenko Y., 2014, The Family Methylophilaceae In: Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Eds., The Prokaryotes. Springer, Berlin, Heidelberg. Germany.
- 15. Ducrocq, C., Servy, C., and Lenfant, M., 1989, Bioconversion of glyceryl trinitrate into mononitrates by Geotrichum candidum, FEMS Microbiol. Lett., 65, 219-222.
-

- 16. Fleming, E. C., Cerar, R., and Christenson, K., 1996, Removal of RDX, TNB, TNT, and HMX From Cornhusker Army Ammunition Plant Waters Using Adsorption Technologies(No. WES/TR/EL-96-5), Army Engineer Waterways Experiment Station, Vicksburg, MS, USA.
- 17. Halecky, M., Spackova, R., Paca, J., Stiborova, M., and Kozliak, E., 2014, Biodegradation of nitroglycerin and ethylene glycol dinitrate by free and immobilized mixed culture, Water Res,, 48, 529-537.
-

- 18. Husseral, J., Spain, J.C., and Hughes, J.B., 2010, Growth of Arthrobacter sp. Strain JBH1 on nitroglycerin as the sole source of carbon and nitrogen, Appl. Environ. Microbiol., 76(5), 1689-1691.
-

- 19. Marshall, S.J. and White, G.F., 2001, Complete denitration of nitroglycerin by bacteria isolated from a washwater soakaway, Appl. Environ. Microbiol., 67(6), 2622-2626.
-

- 20. Martineau, C., Mauffrey, F., and Villemur, R., 2015, Comparative analysis of denitrifying activities of Hyphomicrobium nitrativorans, Hyphomicrobium denitrificans, and Hyphomicrobium zavarzinii, Appl. Environ. Microbiol., 81(15), 5003-5014.
-

- 21. Pennington, J.C., Jenkins, T.F., Ampleman G., Thiboutot, S., Brannon, J.M., Hewitt, A.D., Lewis, J., Brochu, S., Diaz, E., Walsh, M.R., Walsh, M.E., Taylor, S., Lynch, J.C., Clausen, J., Ranney, T.A., Ramsey, C.A., Hayes, C.A., Grant, C.L., Collins, C.M., Bigl, S.R., Yostand, S., and Dontsova, K., 2006, Distribution and Fate of Energetics on DOD Test and Training Ranges: Interim Report 6(TR 06-12), Strategic Environmental Research and Development Program, US Army Corps of Engineers Engineer Research and Development Center, Vicksburg, Miss, USA.
- 22. Pesari, H. and Grasso, D., 1993, Biodegradaton of an inhibitory nongrowth substrate (nitroglycerin) in batch reactors, Biotechnol. Bioeng., 41(1), 79-87.
-

- 23. Pichtel, J., 2012, Distribution and fate of military explosives and propellants in soil: A review, Appl. Environ. Soil Sci., 3, 1-33.
-

- 24. Saad, R., Thiboutot, S., Ampleman, G., Dashan, W., and Hawari, J., 2010. Degradation of trinitroglycerin (TNG) using zero-valent iron nanoparticles/nanosilica SBA-15 composite (ZVINs/SBA-15), Chemosphere, 81, 853-.858.
-

- 25. Sedlak, R., 1981, Phosphorus and Nitrogen Removal from Municipal Wastewater: Principles and Practice, 2nd Eds., The Soap and Detergent Association, New York, USA.
- 26. Servent, D., Ducrocq, C., Henry, Y., Guissani, A., and Lenfant, M., 1991, Nitroglycerin metabolism by Phanerochaete chrysosporium: evidence for nitric oxide and nitrite formation, Biochim. Biophys. Acta, 1074, 320-325.
-

- 27. Smith, J.G., 1986, Water Quality Criteria for Nitroglycerin (ORNL-6180), U.S. Army Medical Research And Development Command, Fort Detrick, Frederick, Maryland, USA.
- 28. Thiboutot, S., Ampleman, G., Marois, A., Gagnon, A., Bouchard, M., Hewitt, A. Jenkins, T., Walsh, M., and Bjella, K., 2004, Environmental Condition of Surface soils, CFB Gagetown Training Area: Delineation of the Presence of Munitions-Related residues (Phase III, Final Report), TR 2004-205. Val-Belair, PQ: Defence Research Establishment Valcartier.
- 29. US EPA, 2009, 2009 Edition of the Drinking Water Standards and Health Advisory, Office of Water, EPA 822-R-09-011.
- 30. Wan, D., Liu, Y., Niu, Z., Xiao, S., and LI, D., 2016, Perchlorate reduction by hydrogen autotrophic bacteria and microbial community analysis using high-throughput sequencing, Biodegradation, 27(1), 47-57.
-

- 31. Wendt, T.M., Cornell, J.H., and Kaplan, A.M., 1978, Microbial degradation of glycerol nitrates, Appl. Environ. Microbiol., 36(5), 693-699.
- 32. White, G.F. and Snape, J.R., 1993, Microbial cleavage of nitrate esters: defusing the environment, J. Gen. Microbiol., 139, 1947-1957.
-

- 33. Zhang, Y.Z., Sundaram, S.T., Sharma, A., and Brodman, B.W., 1997, Biodegradation of glyceryl trinitrate by Penicillium corylophilum Dierckx, Appl. Environ. Microbiol., 63(5), 1712-1714.
 This Article
This Article
-
2019; 24(5): 42-54
Published on Oct 31, 2019
- 10.7857/JSGE.2019.24.5.042
- Received on Sep 24, 2019
- Revised on Oct 15, 2019
- Accepted on Oct 23, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumhan Bae
-
Department of Civil & Environmental Engineering, Gachon University
- E-mail: bhbae@gachon.ac.kr