- Effect of Repetitive Redox Transitions to Soil Bacterial Community and its Potential Impact on the Cycles of Iron and Arsenic
Sujin Park1·Sanghyun Kim1·Hyeonyong Chung1·Sun Woo Chang2·Heesun Moon3·Kyoungphile Nam1*
1Department of Civil and Environmental Engineering, Seoul National University, Seoul 08826, Korea
2Korea Institute of Civil Engineering and Building Technology, Gyeonggi-Do 10223, Korea
3Korea Institute of Geoscience and Mineral Resources, Daejeon 34132, Korea- 비소오염토양에서 반복적인 Redox 환경 변화가 토양 미생물 군집과 비소 및 철의 순환에 미치는 영향
박수진1·김상현1·정현용1·장선우2·문희선3·남경필1*
1서울대학교 건설환경공학부
2한국건설기술연구원
3한국지질자원연구원
In a redox transition zone, geochemical reactions are facilitated by
active bacteria that mediate reactions involving electrons, and arsenic (As)
and iron (Fe) cycles are the major electron transfer reactions occurring at
such a site. In this study, the effect of repetitive redox changes on soil
bacterial community in As-contaminated soil was investigated. The results
revealed that bacterial community changed actively in response to redox
changes, and bacterial diversity gradually decreased as the cycle repeated.
Proportion of strict aerobes and anaerobes decreased, while microaerophilic
species such as Azospirillum oryzae group became the predominant
species, accounting for 72.7% of the total counts after four weeks of
incubation. Bacterial species capable of reducing Fe or As (e.g., Clostridium,
Desulfitobacterium) belonging to diverse phylogenetic groups were
detected. Indices representing richness (i.e., Chao 1) and phylogenetic
diversity decreased from 1,868 and 1,926 to 848 and 1,121, respectively.
Principle component analysis suggests that repetitive redox fluctuation, rather
than oxic or anoxic status itself, is an important factor in determining the
change of soil bacterial community, which in turn affects the cycling of As and
Fe in redox transition zones.
Keywords: Redox transition zone, Bacterial community, Phylogenetic diversity, As contaminated soil
토양에서는 수분 포화도에 따라 산소 유입 정도가 영향을 받으며 산화환원전위(Eh)가 지속적으로 변화한다(Clague et al., 2019). 물로 포화될 경우, 유기물 분해로 인한 산소 소모로
인해 토성과 무관하게 환원 조건이 형성될 수 있다(Noël et al., 2019). 논 토양, 강우나 관개로 인하여 지하수위가 변화하는 얕은 대수층,
그리고 양수 등의 수문학적 처리가 이루어지고 있는 부지 등이 이러한 산화-환원 경계면(Redox transition zone)의 대표적인 예이다(Muntau et al., 2017; Lin et al., 2018; Clague et al., 2019). Redox transition zone은 건조 토양과 침수 토양의
redox 환경이 번갈아 조성된다는 독특한 성질을 가져 최근에 연구 대상으로 주목받고 있으며(Rodriguez-Mora et al., 2015; Bishop et al., 2019; Möller et al., 2019; Zhao et al., 2019), 이러한 성질로 인해 다양한
전자수용체와 전자공여체가 공존하기 때문에 미생물들이 활성을 가지고 여러 핵심적 지구화학 반응을 촉진시킬 수 있는 장소이다(Lee et al., 2015). 경계면에서는 redox 변화에 민감한 무기오염물질의 화학적 존재
형태가 변화하며 이동성과 독성이 증가하는 경우가 있는데, 대표적 물질이 비소이다. 실제로 남아시아와 미국을 필두로, 전세계적으로 경계면 인근 지하수
내 비소 농도가 증가하는 사례들이 지속적으로 보고되고 있다(Jung et
al., 2015; Meng et al., 2017; Xie et al., 2018; Duan et al., 2019).
비소는 대표적인 토양오염물질로, 자연기원으로 존재하거나 광산 유출수와 살충제 등을 통해 토양으로 유입된다(Smedley and Kinniburgh, 2002; Winkel et al., 2008). 화학적으로 여러 형태가
있으나, 토양과 지하수에서는 거의 As(III) (arsenite) 또는
As(V) (arsenate) 로 존재한다(Mandal and Suzuki, 2002). 토양 내에서 비소는 대부분
5가 상태로 철산화물에 흡착 또는 공침되어 안정화된 상태로 존재하지만(Mandal
and Suzuki, 2002), 환원 조건이 조성될 경우 철산화물 표면에 3가 철이 환원되며 비소와 철이 함께 지하수로 용출될 수 있다(Harvey et al., 2002). 이 때 5가 비소 또한 3가 비소로 환원될 수 있는데,
3가 비소는 일반적인 토양의 pH 환경에서 H3AsO30 형태로 전하를 띠지 않기 때문에
음전하인 5가 비소(H2AsO4-, HAsO42-)와 비교하여 광물에 흡착되는 정도가 낮으므로 이동성이 매우 높아 주의가 필요하다(Oremland and Stolz, 2005). 토양에서 지하수로의 비소
용출은 심각한 환경 문제이며, 비소 오염 지하수에 노출될 경우 수용체에 DNA 손상과 피부 병변을 비롯하여 위장관, 피부, 방광, 간 등에 암이
발생할 우려가 있다(Calatayud et al., 2014; Paul et
al., 2015). 철과 비소의 환원은 열역학적으로는 일반적인 토양 pH 범위(5-8)에서 Eh가 약 200 mV 이하일 때 발생 가능하지만,
반응 속도가 매우 느리다(Burnol et al., 2007). 실제 자연환경에서는 미생물이
전자공여체인 탄소원과 전자수용체인 철과 비소 간의 전자 전달을 용이하게 하며 환원 반응을 촉진시킨다(Newman and Banfield, 2002). 이러한 dissimilatory Fe/As reducing
bacteria는 Shewanella, Geobacter, 그리고 Clostridium이 대표적이며 이외에도
매우 다양하다(Dobbin et al., 1999; Lovley,
2006; Jiang et al., 2013). 토양미생물 중 철 또는 비소를 전자 수용체로 사용 가능한 종의 상대적 풍부도와 다양성은 해당
원소의 거동과 생물학적 이용성에 상당한 영향을 미친다(Lara et
al., 2012). 따라서 토양 미생물 군집은 비소의 이동성과 독성을 결정하는 핵심적 요소이다.
토양에서 새로운 환경이 조성될 경우 각 미생물들은 적응에 성공하거나 실패하며 전체 미생물 군집을 지속적으로 변화시킨다. 미생물 군집에
영향을 줄 수 있는 주요 환경 인자로는 토양의 입자 크기, pH, Eh, 그리고 영양분 등이 있다(Torsvik and Øvreås, 2002). 이중에서도 Eh는 미생물 군집에 큰 영향을 주는 주요 환경인자
중 하나이다. Eh가 변화할 경우 미생물이 이용할 수 있는 최종전자수용체가 변화하며 대사에 영향을 준다. 미생물 군집 조성은 토양 내 비소(As)와
철(Fe)을 비롯한 탄소(C), 황(S), 질소(N), 인(P) 등의 주요 무기물의 순환에 영향을 주므로(Loreau, 2001; D'Hondt et al., 2004; Falkowski et al.,
2008), redox transition zone에서 미생물 군집 변화의 특성을 연구하는 것은 비소오염토양의 위해 예측과 저감뿐만 아니라 토양
내 물질 순환에 있어 매우 중요하다. 현재까지 철 및 비소 환원 미생물에 의한 비소의 용출 촉진 현상에 관해서는 다양한 연구가 수행되었다(Islam et al., 2004; Wang et al., 2016; Wang et al.,
2017; Yang et al., 2018). 그러나 아직까지 Eh가 변화하는 경계면에서 토양 미생물 군집 변화의 경향성을 다룬 연구는
부족한 상황이다. 계절 변화나 조석 현상으로 인하여 환경 조건이 변화하는 토양에서 시간에 따라 미생물 군집을 분석한 연구는 있으나(Boucher et al., 2006; Waldrop and Firestone, 2006), 현장 조사 연구이기 때문에
주기적이고 반복적인 Eh 변화와 미생물 군집 변화 간의 직접적 상관관계는 아직까지 확실하지 않다.
본 연구에서는 일회성의 Eh 변화와 반복적 Eh 변화가 미생물 군집에 다른 영향을 줄 것이라 가정하고 batch 실험을 통해 주기적이고
반복적인 Eh 변화가 토양 미생물 군집에 줄 수 있는 영향을 밝히고자 하였다. 연구의 목적은 산화-환원 조건이 지속적으로 변화하는 비소 오염토양에서
미생물 군집 변화의 특성을 규명하여 장기적으로 경계면에서 비소 용출 특성을 예측하기 위한 배경 자료를 제시하는 것이다. 경계면 토양을 모사하기
위하여 비소 인공오염토양과 토양용액을 혼합한 토양 슬러리에 각 7일간의 환원-산화 조건을 네 번 반복적으로 조성하였다. 각 기간 종료 후 토양을
샘플링하여 미생물 군집분석을 수행하고, 군집분석 결과를 바탕으로 통계 분석을 진행하였다.
2.1. 토양 성분 분석 및 비소 인공 오염 토양 제조
본 연구에서 사용된 토양은 직경 500 μm 미만으로, 토양의 금속
원소 전함량은 USEPA 3052(HNO3 : HF : H2O2 : dH2O,
9 : 3 : 1 : 1, v/v/v/v)에 따라
분석되었다. 토양의 주요 광물 및 원소 조성은 각각 XRD(DAVINCI, D8 ADVANCE, Bruker AXS, Germany)와
XRF(S4 PIONEER, Bruker AXS, Germany)를 이용하여 분석하였으며, 그 결과는 Table 1에 제시하였다. 토양은 주로
석영(57.95%)과
알바이트(29.98%)로 구성되었다. 원토양을 풍건 후 As(V) (sodium
arsenate dibasic heptahydrate) 용액과 혼합하여 250 mg/kg As(V) 농도로 인공 오염시키고 75일 간 에이징 한 후 실험에 사용하였다. 에이징 과정을 거친 원토양
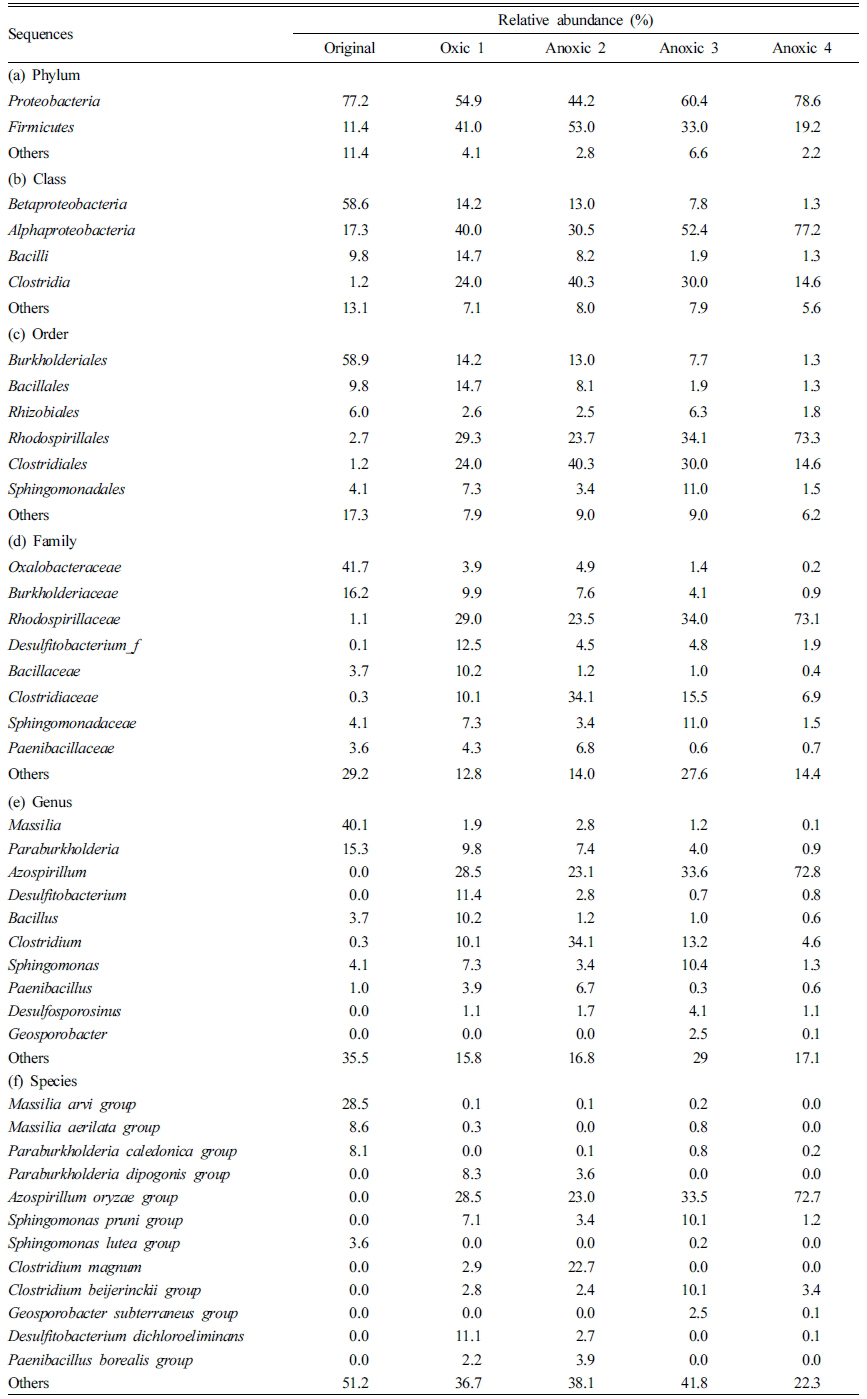
내 비소의 존재형태를 Wenzel 5단계 연속추출법으로 분석한 결과(Wenzel
et al., 2001), 전체 비소의 53.6%가 0.2 M NH4-oxalate
버퍼 용액으로 추출 가능한 3단계로 존재하는 반면, 0.2 M NH4-oxalate와
0.1 M ascorbic acid로 추출 가능한 4단계 비소는 16.5%에 불과했다(Fig.
1). Wenzel 5단계 연속추출법에서 3단계 비소의 대표적 형태는 비결정질 철산화물에 결합된 비소이며 4단계 비소의 대표적 형태는 결정질 철산화물에
결합된 비소임을 고려하였을 때(Table 2), 원토양 내에서 비소는 주로 결정질 보다는 비결정질 철산화물에 결합되어 있다 판단되었다.
2.2. 토양 배양 실험 및 샘플링 방법
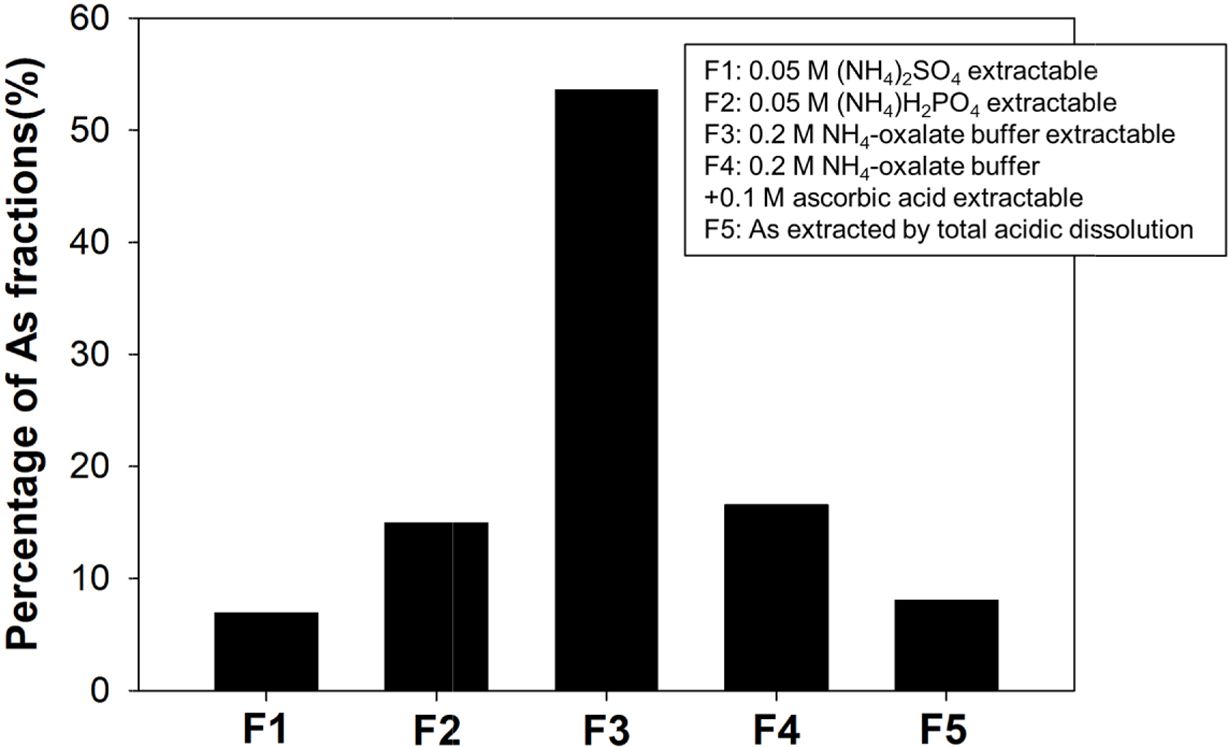
토양의 산화-환원 조건을 변화시키기 위하여, 건조 토양 10 g을 200 mL의 인공토양용액과 혼합하여
토양 슬러리를 제조하고 56일간의 토양 배양 시험을 수행하였다(Couture
et al., 2015). 환원-산화 조건이 네 번 반복되었고 각 조건은 7일간 유지되었다(Fig. 2). 사용한 인공 토양용액의
성분은 다음과 같다: pH 7.0, 2 mM glucose, 10 mM PIPES, 2.7 mM KCl, 0.3 mM MgSO4,
7.9 mM NaCl 및 0.4 mM CaCl2·2H2O(Duan
et al., 2019). 인공토양용액 성분 중 포도당은 미생물이
이용하기 쉬운 탄소원으로, 철과 비소의 환원 시 전자공여체로서 작용할 수 있다. 환원 조건 시작 이전에, 토양 슬러리에 질소 가스를 15분 동안
주입 후 산소 유입을 방지하기 위하여 고무 마개로 막은 후 알루미늄 캡으로 밀봉하였다. 7일 경과 후, 산소 가스를 주입하고 7일 간 유지시켰다.
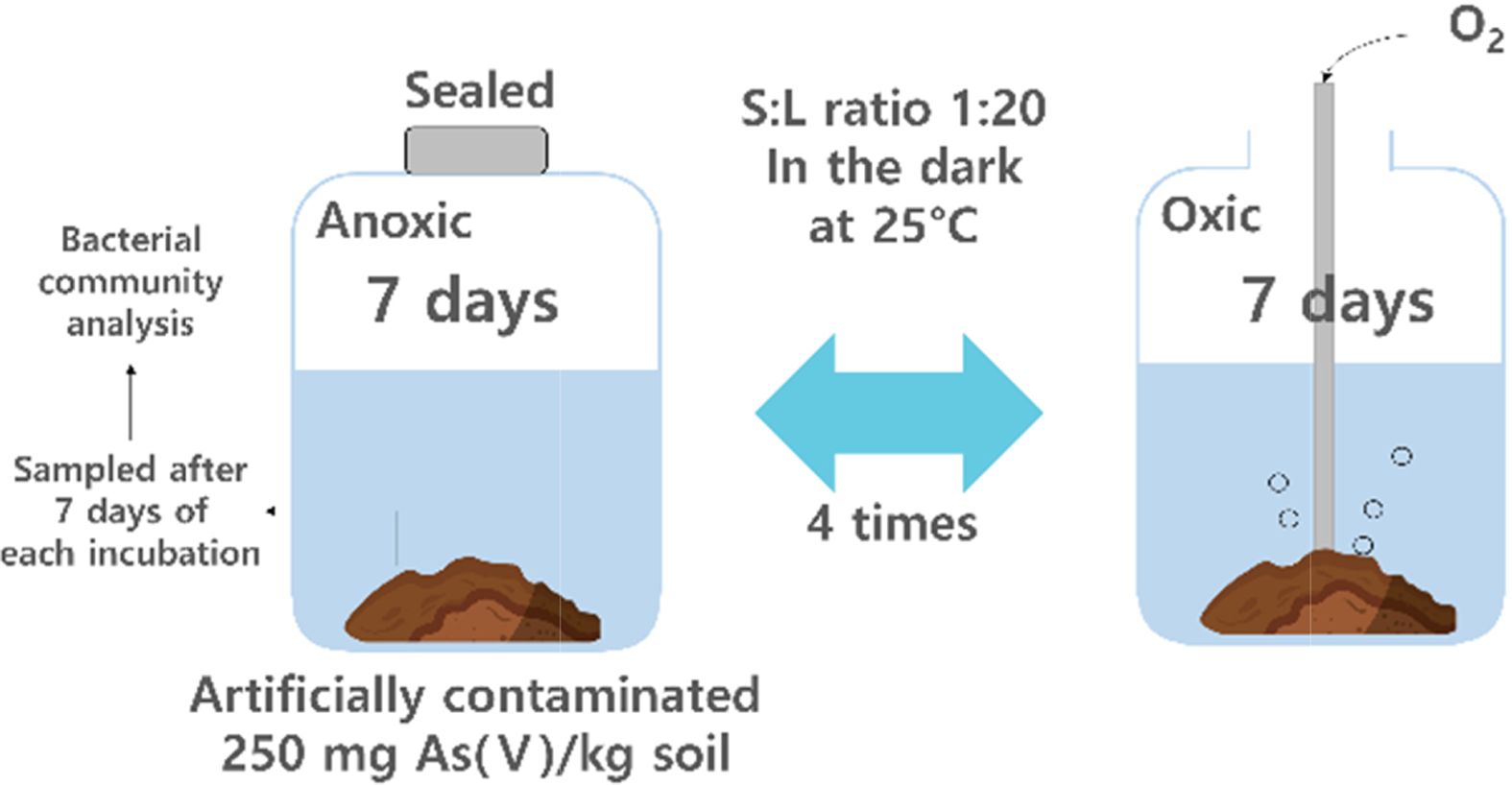
각 배양 기간의 2, 4, 7일 째에 pH/Eh combination meter(US/720A, Thermo Scientific, USA)로 토양용액의
Eh와 pH를 측정하고 토양용액을 4 mL씩 샘플링하여 ICP-MS(G8421A, Agilent
Technologies International, Japan)로 용액 내 비소 농도를, ferrozine assay로 2가 철 농도를 측정하였다
(Stookey, 1970). 산화 조건에서는 Eh가
300 mV 이상으로 유지되었다(Fig. 3).
전 기간 동안 토양 슬러리는 25oC의 어두운 곳에 보관하였다. 환원 조건일 때는 혐기 챔버에서 샘플링하여 산소 유입을 차단하였다.
토양 샘플링을 위해 각 주기마다 샘플을 개별적으로 제작하였으며, 각 배양 기간 종료 후 토양을 샘플링하였다. Original(원토양),
Oxic 1(14일간 배양, 첫 번째 산화 조건에서 샘플링한 토양), Anoxic 2(21일간 배양, 두 번째 환원 조건에서 샘플링한 토양),
Anoxic 3(35일간 배양, 세 번째 환원 조건에서 샘플링한 토양), Anoxic 4(49일간 배양, 네 번째 환원 조건에서 샘플링한 토양)을
이용하여 미생물 분석을 수행하였다.
2.3. DNA 추출 및 토양 미생물 군집 분석
샘플링한 토양을 Chunlab, Inc.(서울)에 의뢰하여 차세대 시퀀싱(NGS: Next Generation Sequencing)을
수행하였다. FastDNA SPINKit for Soil(MP Biomedicals, USA)을 사용하여 토양에서
genomic DNA를 분리하고 DNA 증폭을 위하여 16S rRNA의 V3와 V5 영역을 대상으로 하는 프라이머를 사용하였다.
사용된 프라이머의 서열은 다음과 같다: bacteria 특이적 프라이머 341F(5’-TCGTCGGCAGCGTC-AGATGTGTATAAGAGACAG-CCTACGGGNGGCWGCAG-3’)와
805R(5’-GTCTCGTG GGCTCGG-AGATGTGTATAAGAGACAG-GACTACHVGGGTATCTAATCC-3’);
archaea 특이적 프라이머 A519F-Mi(5’-TCGTCGGCAGCGTC-AGATGTG TATAAGAGACAG-CAGCCGCCGCGGTAA)와A958R-Mi(5’-GTCTCGTGGGCTCGG-AGATGTGTATAAGAG ACAG-YCCGGCGTTGAMTCCAATT-3’).
2.5 mM dNTP (2.5 μL), 10X
buffer(2.5 μL), primer(1 μL), DNA(2 μL) 및 TaKaRa
Ex Taq DNA polymerase(0.25 μL)가 포함된 총 25 μL 혼합물을 반응시켰다.
처음 95oC에서 3분 동안 denaturing을 시킨 후 55oC에서 annealing,
72oC에서 30초간 extension 시켰다. Final extension은 72oC에서 5분 동안 수행하였다.
총 25 cycle을 수행하였다. PCR 반응은 1% agarose gel에서 전기 영동하여 확인하였다.
Illumina
sequencing(Miseq) 및 Agilent 2100 Bioanalyzer이 사용되었다.
2.4. 군집 다양성 지표 비교 및 통계분석
서로 다른 토양의 미생물 군집을 비교하기 위하여 통계 분석을 수행하였다. Venn diagram은 R 프로그램의 Venn
diagram package를 사용하여 계산하였다. 군집의 다양성을 평가하기 위하여 alpha-diversity 지표인
Abundance-based coverage estimators(ACE), Jackknife, Chao 1, 그리고
phylogenetic diversity를 산정하였다. 이 중 ACE, Jackknife, 그리고 Chao 1은 전체
OTU(Operational Taxo- nomic Unit) 대비 singleton 또는
doubleton의 비율을 통하여 종의 풍부도(richness)를 나타내는 지표로, 값이 높을수록 측정되지 않은 종이 많아 종 풍부도가 높다고
판단한다. Phylogenetic diversity는 계통수에서 노드(node) 간 최단 거리를 합산하여 종 간의 계통학적 차이를 수치화하는 지수로,
종의 다양성과 양의 상관관계가 있다. 미생물 군집 간 유사성을 판단하기 위하여 UniFrac method를 이용한 Principal
component analysis(PCA) 분석을 수행하였다.
|
Fig. 1 Results of Wenzel 5-step sequential extraction of aged soil. |
|
Fig. 2 Schematic diagram of the experimental procedure. |
|
Fig. 3 (A) Eh and (B) pH of the soil solution. |
3.1. 미생물 군집분석 결과 요약
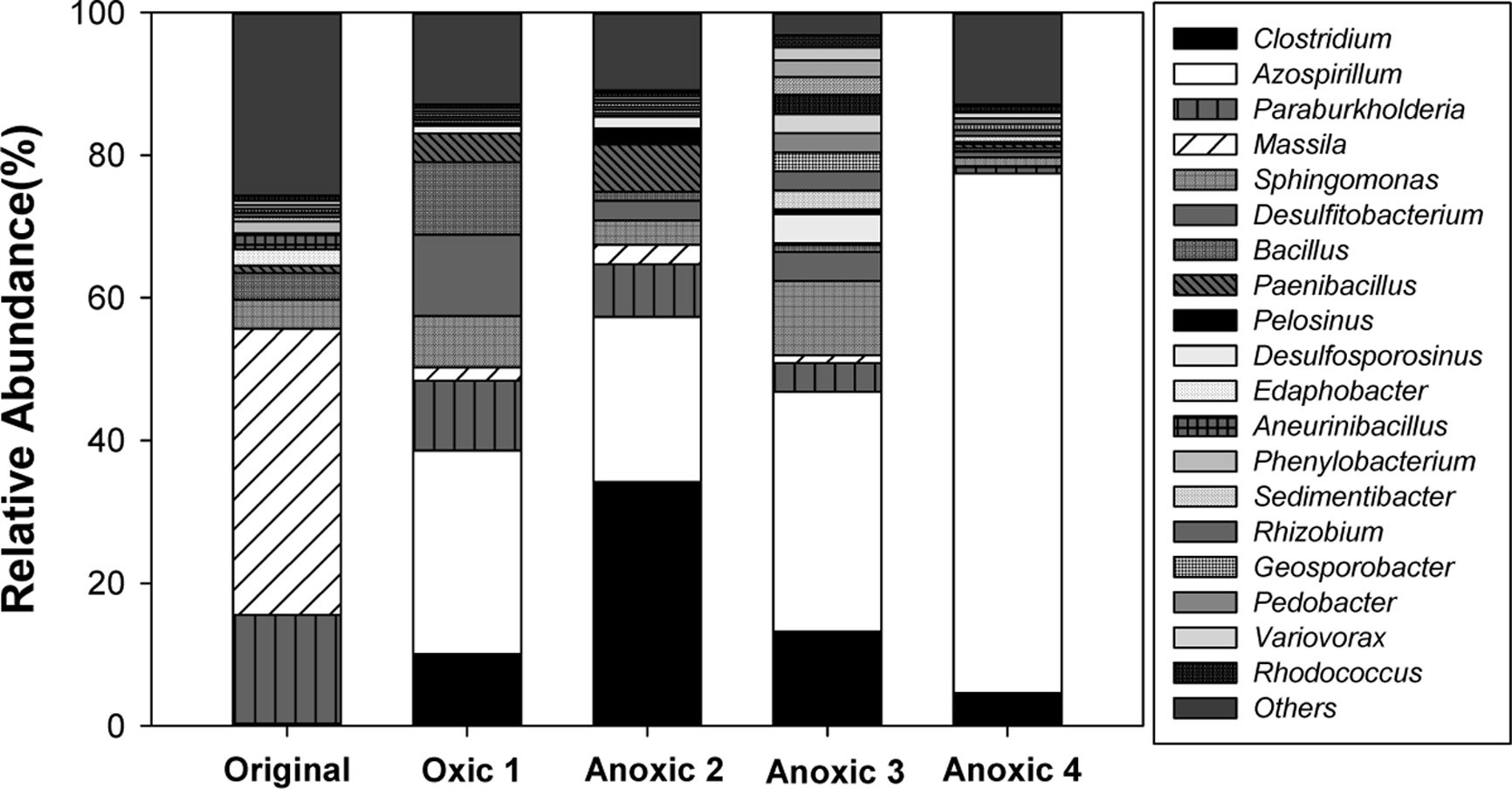
반복적 산화-환원 조건 변화 하에서 미생물 군집의 변화를 확인하기 위하여 Original, Oxic 1, Anoxic
2, Anoxic 3 및 Anoxic 4 토양을 샘플링하여 Illumina sequencing을 수행하였다. 속(genus) 수준에서 미생물 군집의
상대적 구성비와 Heatmap 분석 결과는 각각 Fig. 4과 Fig. 5에 나타나 있다. Fig. 4에서 총 구성비의 2% 미만을
차지하는 그룹은 기타(Others)로 분류되었다. Fig. 5에는 토양 시료에서 발견된 철 또는 비소 환원 미생물의 풍부도를 heatmap으로
표시하였다. 97% 유사도를 기준으로 종(species) 수준으로 동정된 각 시료의 total reads 수는 각각 58,813,
61,582, 50,160, 72,741, 그리고 63,540였다. 각 시료에서 Rarefaction curve는 모두 saturation
phase에 근접하는 유사한 형태로 나타나, 샘플의 read 수가 OTU값을 얻기 위해 적절함을 확인하였다. 전체 read에서
singleton을 제외한 OTU로 계산되는 Good’s coverage of library는 모든 시료에서 99.7%로, 샘플의 시퀀싱 리드
수가 미생물 군집을 설명하기에 통계적으로 충분하다는 것을 나타냈다.
3.2. 반복적 Redox 변화가 미생물 군집 구성에 주는 영향
각 시료에서 미생물 군집의 상대 풍부도는 Table 3에 요약하였다. 분석 결과 원토양과 배양 초기의 토양에는 다양한 종류의 미생물이
존재하였다. 모든 토양 시료에서 군집의 대다수를 차지하는 문(phylum)은 Proteobacteria (44.2-78.6%)와 Firmicutes(11.4-53.0%)였다. 강(class) 수준에서는
Betaproteobacteria(1.3-58.6%)가 시간이 지남에 따라 유의하게 감소한 것에 반해, Alphaproteobacteria (17.3-77.2%)는 점차 증가하는 양상을 보였다. 이외의 강(class)으로는 Bacilli(1.3-14.7%)와 Clostridia(1.2-40.3%)가 있었다. 목(order)
수준에서는 Burkholderiales(1.3-58.9%), Bacillales(1.3-14.7%),
Rhizobiales(1.8-6.3%), Rho- dospirillales(2.7-73.3%), Clostridiales(1.2-40.3%),
그리고 Sphingomonadales(1.5-11.0%)가 우점하였다. 과(family) 수준에서 원토양에서는 호기성인 Massilia(40.1%)
속(genus)이 포함된 Oxalobacteraceae(0.2-41.7%)가 가장 풍부하였고, 환원 조건의 토양에서는 Rhodospirillaceae (1.1-73.1%)가 높은 비율을 차지하였다. 속(genus) 수준에서는 산화-환원 전위의 변화에 따라
토양 내 미생물 군집이 변화하는 것을 구체적으로 확인할 수 있었다. 다수를 차지하는 속(genus) 중Bacillus,
Paenibacillus, Rhizobium, Rhodococcus, 그리고 Sphingomonas는 3가 또는
5가 비소에 저항성을 가진다고 알려져 있다(Jackson et
al., 2005, Bachate et al., 2009; Oliveira et al., 2009).
Clostridium, Desulfosporosinus, Geosporobacter, Desul- fitobacterium, Paenibacillus,
Pedobacter, Pelosinus 등의 철 또는 비소 환원이 가능하다고 알려진 다양한 속(genus)이 존재하였고(Ahmed et al., 2012, Hong et al., 2015, Ray et al.,
2018), 그 중에서도 Clostridium(4.6-34.1%)이 가장 풍부하였다. Clostridium은 유기산을
생성하며 3가 철을 환원시킬 수 있는 미생물로, redox 경계면에서 흔히 우점하는 속(genus)이다(Wang et al., 2009, Mejia et al., 2016). 비결정질과 결정질 철산화물을
모두 전자수용체로 이용할 수 있으나, 그보다는 주로 휴믹산(humic acids)을 통해 전자를 흐르게 하여 철 환원을 촉진시킨다(Benz et
al., 1998). 네 번의 환원 조건에서
토양용액의 pH는 5.9-6.3까지 감소하였는데(Fig. 3), Clostridium과
같은 fermentative Fe/As 환원 미생물이 유기산을 생성하기 때문으로 판단된다. 3가 비소를 산화시킬 수 있다고 알려진 Rhodococcus를
제외하고는, 상위 15개 속(genus) 미생물이 2가 철과 3가 비소를 산화시킬 수 있는지 여부는 알려지지 않았다. 단, Paraburkholderia와
유사한 Burkholderia 속(genus)은 선행 연구에서 비소 산화가 가능하다고 보고된 바 있다(Sultana et al., 2012).
Azospirillum은 질소 고정 미호기성균(microaerophilic)으로(de Zamaroczy et al., 1989), Oxic
1(28.5%), Anoxic 3(33.6%) 및 Anoxic 4(72.8%) 토양에서 가장 풍부한 속(genus)이었으며 주기가 반복됨에
따라 그 양이 점차 증가하였다. 반면 절대 호기성 또는 절대 혐기성 미생물은 redox 변화가 반복됨에 따라 그 구성비가 점차 감소하였다. 이는
redox 환경이 지속적으로 변화하기 때문에 특정 redox 조건에서만 생존이 가능한 미생물(e.g., Massilia,
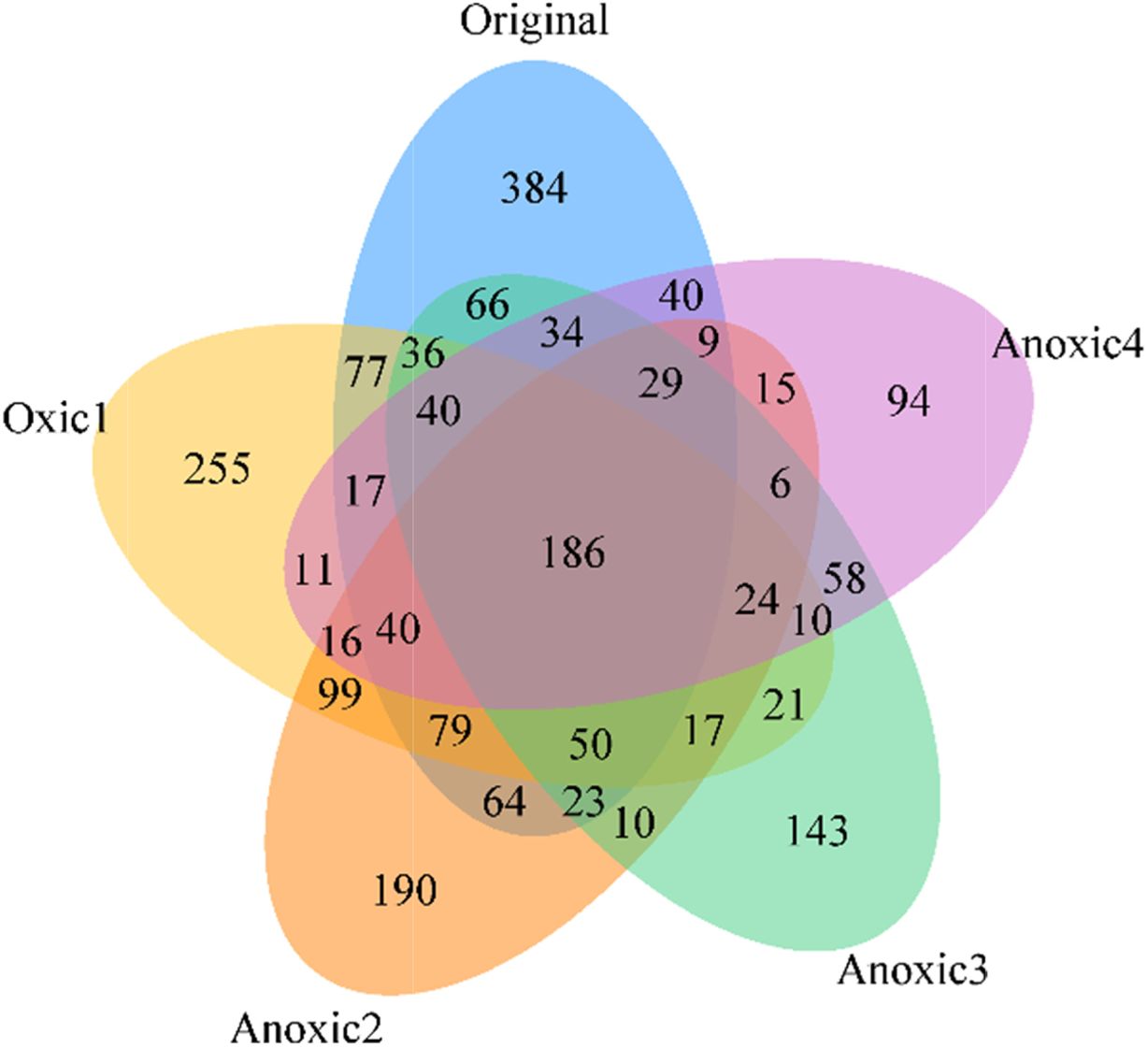
Clostridium)은 활성을 잃고, 두 조건 모두에서 생존 가능한 미생물이 우점하기 때문으로 보인다. 벤 다이어그램 분석 결과(Fig.
6), 총 186 개의 OTU가 모든 시료에서 공통적으로 존재하였으며 이 중 원토양을 제외한 모든 시료에서 구성비 0.5% 이상인 미생물 군집을
핵심 세균 군집으로 정하였다(Shade and Handelsman,
2012). 핵심 세균 군집은 Azospirillum oryzae group 과 철 및 비소 환원이 가능한 Clostridium
beijerinckii group였다(Dobbin et
al., 1999).
산화 조건의 토양(Oxic 1)과 환원 조건의 토양(Anoxic 2)를 비교한 결과, 환원 조건이 형성될 경우 선행 연구에서 보고된
결과와 마찬가지로 철/비소 환원 미생물이 증가함을 확인하였다(Parsons et
al., 2013). Oxic 1 토양에서는 Clostridium이 10.1%에 불과하였으나 Anoxic 2 토양에서는34.1% 확연히 증가하였다.
Paenibacillus, Desul- fosporosinus, 그리고 Pelosinus
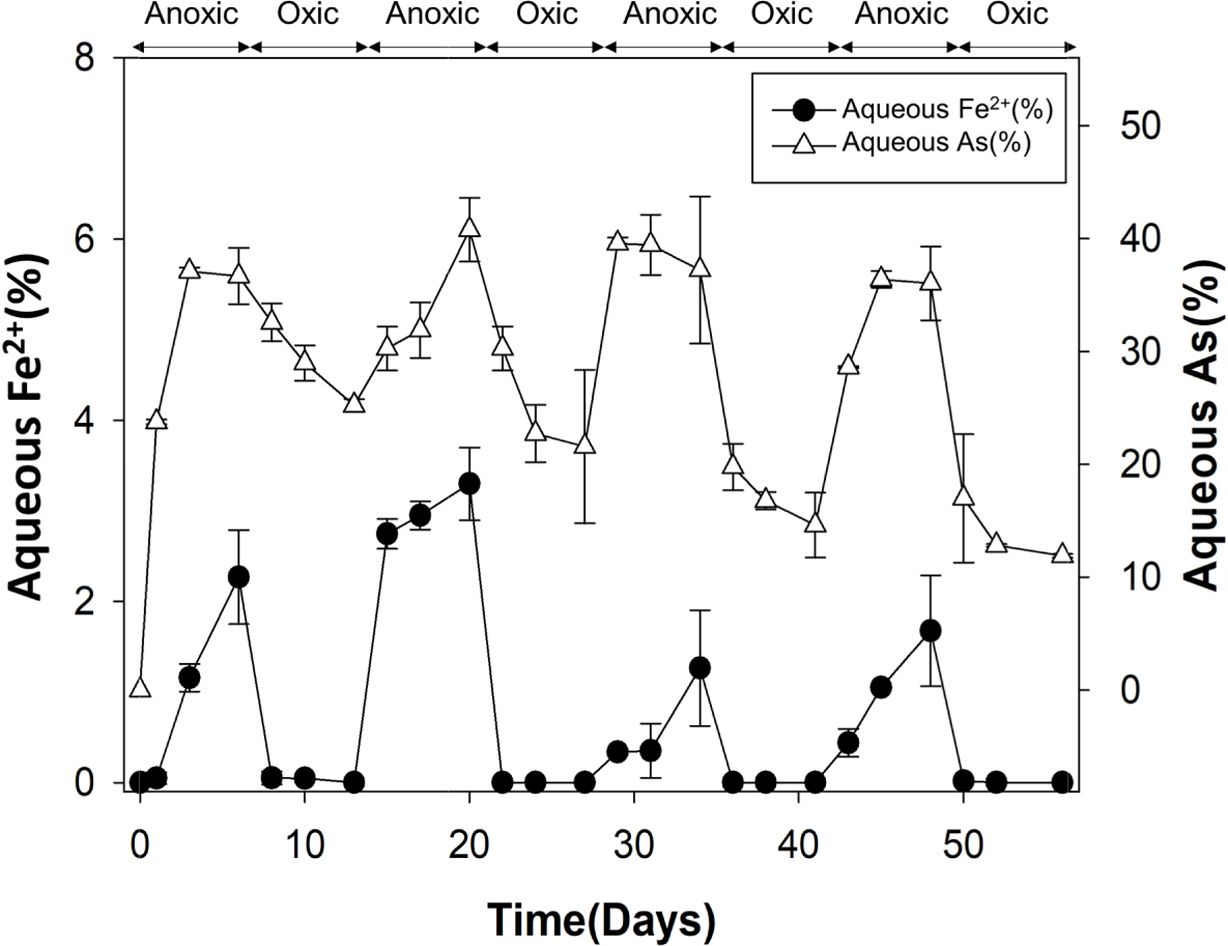
등의 철/비소 환원 미생물도 환원 조건에서 구성비율이 증가하였다. 환원 조건에서 철/비소 환원 미생물의 증가는 철과 비소의 용출을 촉진시켰을 가능성이
있다. 실제로 산화 조건의 토양용액에서는 2가 철이 전체 철의 0.1% 미만으로 측정되었으나, 환원 조건에서는 전체 철의 1.0-3.3%가 용액
중에서 2가 철 상태로 존재하였으며, 용액 중 존재하는 비소의 양 또한 유의하게 증가하는 것을 확인하였다(Fig. 7). 원토양에서 결정질 철산화물보다는
비결정질 철산화물에 결합된 비소의 비율이 높았기 때문에, 철 환원에 인한 비소 용출이 촉진될 수 있었다고 판단된다. 모든 토양에서 절대 호기성
또는 혐기성으로 알려진 미생물이 함께 발견되었는데, 이는 절대 호기성 또는 혐기성 미생물이라도 실제 환경에서는 지속적인 대사를 위해 일시적인 환원/산화
조건을 필요로 하고(Teh et al., 2005), Eh환경 적응에 상당한
시간이 소요되기 때문이다(DeAngelis et al., 2010).
3.3. 미생물 다양성 지표의 감소
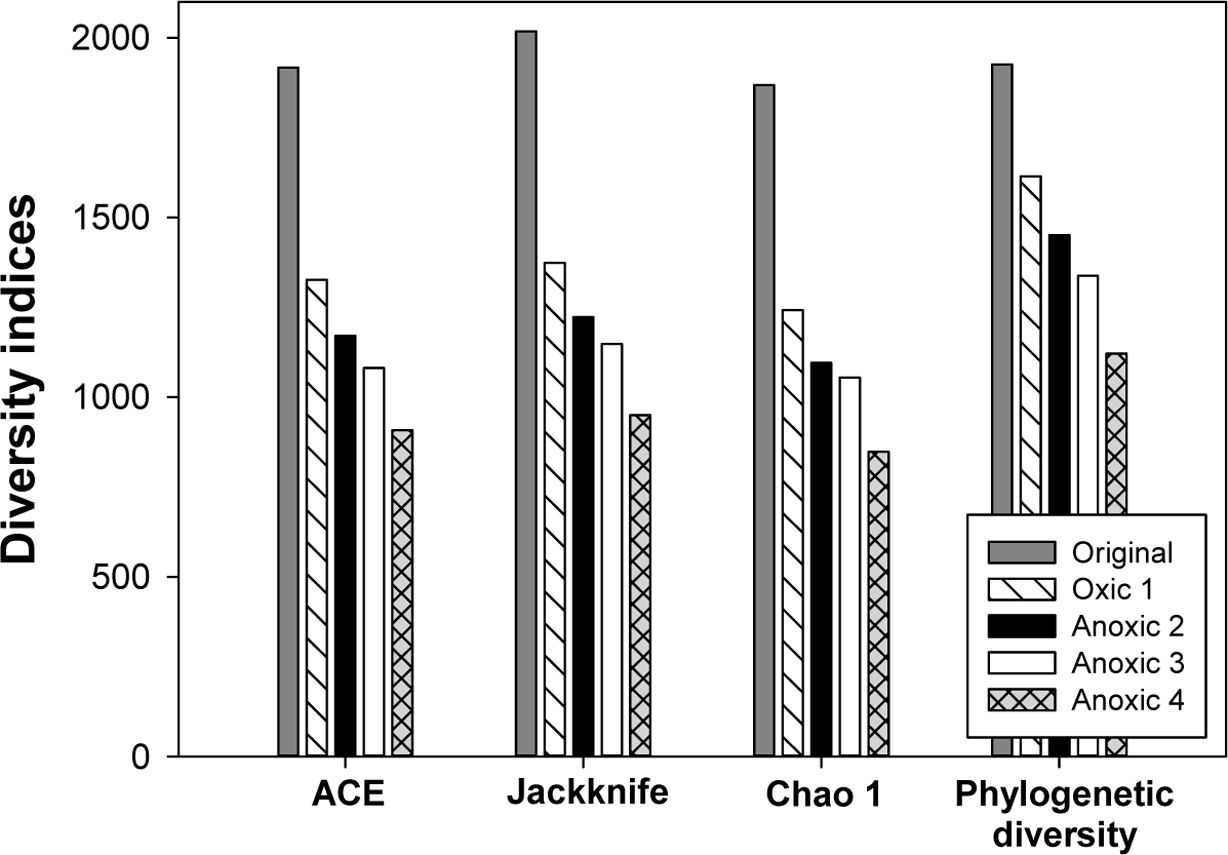
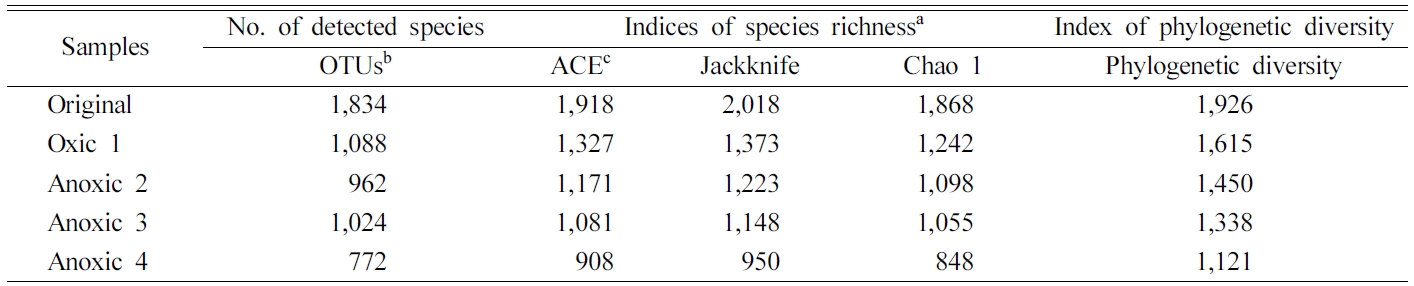
Redox 변화가 토양 미생물 군집의 다양성에 미치는 영향을 분석하기 위하여 각 토양에서의 다양성 지수를 비교하였다. ACE,
Chao 1, Jackknife 등의 다양성 지수는 Table 4과 Fig. 8에 제시되어 있다. 모든 다양성 지수는 redox 변화가 반복되면서
크게 감소하여 원토양에서 가장 높게 나타났고, Anoxic 4 토양에서 가장 낮았다. 97% 유사도를 기준으로 산정한 OTU는 네 번의
redox cycle에서 1,834(Original), 1,088(Oxic 2), 962(Anoxic 2), 그리고 1,024(Anoxic 3)에서 772(Anoxic 4)로 점차 감소하는 경향을 보였다. Jackknife는 2,018에서 950으로,
Chao
1은 1,868에서 848로, 그리고 phylogenetic diversity는 1,926에서 1,121로 급격히 감소하였다. 미생물 군집의 다양성이
감소하는 것은 반복적으로 Eh 환경이 변화하며 절대 호기성 또는 혐기성인 미생물이 감소하기 때문으로 판단된다. 벤 다이어그램에서
단일 시료에만 존재하는 종의 수는 Original(384), Oxic 1(255), Anoxic 2(190), Anoxic 3(143),
Anoxic 4(94)로 시간이 지남에 따라 감소함을 확인하였다. DeAngelis
et al.(2010)은 유사한 토양 배양 실험을
통해 Eh가 일정하게 유지될 경우보다 Eh가 변화할 때 미생물 군집의 다양성이 증가함을 보였는데, 본 연구는 이를 확장하여 Eh 변화가 반복될
경우에는 오히려 다양성이 감소함을 확인하였다. 미생물 군집 다양성이 높다는 것은 다양한 기능을 가진 미생물이 활성을 가지고 토양 내 물질을 효율적으로
활용할 수 있음을 의미한다(Loreau, 2001). 따라서, redox 변화
반복에 의한 미생물 다양성의 감소는 토양 내 다양한 무기물질의 효과적인 순환을 저해할 수 있다(Torsvik and Øvreås, 2002).
3.4. 전체 군집 구조 비교
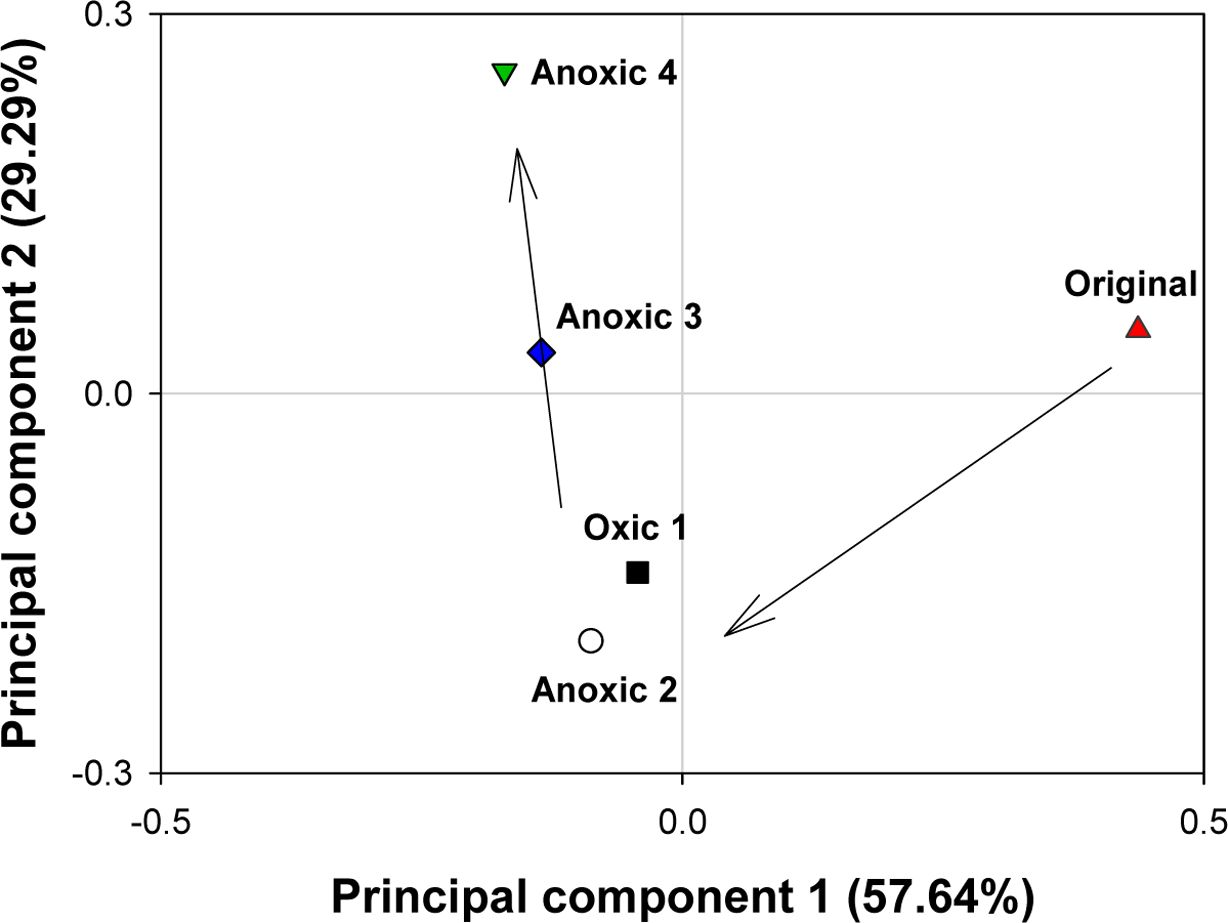
토양의 미생물 군집 변화를 규명하기 위하여 주성분 분석(Principal Component analysis, PCA)을 사용하여 계통분류학적
유사도를 고려하였다(Fig. 9). 분석 결과, 미생물 군집은 토양 배양 여부와 redox 반복에 따라 뚜렷이 구분되었다. 주성분
1(Principal component 1)과 주성분 2(Principal component 2)는 각각 전체 데이터 분산의 57.6과
29.3%를 차지하였다. 두 주성분만으로도 전체 데이터 분산의 86.9%를 보존하고 있어 2차원으로 시각화하여 토양 미생물 군집의 차이를 파악하기에
충분하였다. 주성분 1 기준으로는 토양 배양 여부에 따라 토양 미생물 군집이 유의한 차이를 보였다. 주성분 1에 대한 원토양(Original)의
값은 0.5에 가까운 반면, 배양된 토양(Oxic 1, Anoxic 2, Anoxic 3, Anoxic 4)의 값은 0 이하로 배양 여부에 따라
미생물 군집 조성이 크게 차이남을 알 수 있다. 주성분 2를 기준으로는 redox 변화의 반복이 중요한 변수였다. 주성분 2에 대하여 Oxic
1과 Anoxic 2 토양의 값은 각각 -0.14와 -0.20인 반면, Anoxic 3와 Anoxic 4 토양의 값은 각각 0.03과 0.25로
점차 증가하였다. 이는 redox 변화가 반복되면서 토양 미생물 군집 조성이 변화하였음을 의미한다. 반면, 환원 조건의 토양인 Anoxic 2와
산화 조건의 토양인 Oxic 1은 주성분 1과 2 모두를 기준으로 큰 차이를 보이지 않았다. 이는 일반적 통념과 달리, 산화 또는 환원 조건으로
구분되는 redox 상태 자체보다는 redox 반복이 미생물 군집에 더 큰 영향을 주었다는 것을 의미한다.
|
Fig. 4 The changes in bacterial communities at the genus level. |

|
Fig. 5 Heatmap analysis for Fe or As reducing bacterial communities at the genus level. |
|
Fig. 6 Venn diagram showing overlaps between species under redox changes. |
|
Fig. 7 Percentage of aqueous Fe2+ and As. |
|
Fig. 8 Alpha-diversity indices of the bacterial communities in different soils. |
|
Fig. 9 Principal component analysis of bacterial communities. |
|
Table 4 Alpha diversity indices of microbial communities in the samples |
a Index focused on species richness; The higher the value, the more species that are not found |
본 연구는 redox transition zone에서 발생할 수 있는 미생물 군집 변화를 규명하여 향후 비소 이동성에 줄 수 있는 영향을
파악하는 것을 목적으로 하였다. 기존 연구들이 환원 조건에서 Geobacter와 같은 철 환원 미생물의 풍부도 증가에 집중한 반면(Parsons et al., 2013; Mejia et al., 2016), 본 연구에서는 같은 산화/환원
조건이더라도 redox 반복의 횟수에 따라 특정 미생물이 선별적으로 증가하며 철/비소 환원 미생물 구성비에 차이가 발생함을 증명하였다. 반복된
redox 조건의 변화는 산화 조건과 환원 조건 모두에서 생존 가능한 미생물(e.g., Azospirillum) 의 풍부도를 선별적으로
높이고 절대 호기성인 미생물의 풍부도를 감소시키며 결과적으로 미생물 다양성을 감소시켰다. 환원 조건에서는 철 또는 비소 환원이 가능하다고 알려진
다양한 미생물(e.g., Clostridium, Desulfitobacterium) 이 존재하는 것을 확인하였다. 이 중에서도 Clostridium
beijerinckii group은 핵심 세균 군집을 이루었다. 이러한 연구결과는 실제 redox transition zone에서 범람,
계절, 또는 조류로 인한 redox 변화의 누적 횟수가 토양 미생물 군집 구성에 중요한 요소이며, 향후 비소와 철을 비롯한 다양한 토양 무기물질의
순환에도 영향을 줄 수 있음을 나타낸다. 따라서 redox transition zone에서 장기적으로 비소의 이동성을 예측하기 위해서는 부지의
현재 redox 상태뿐만 아니라 해당 부지 내 redox 변화의 이력을 함께 고려할 필요가 있다.
본 연구는 환경부의 재원으로 한국환경산업기술원의 지중환경오염위해관리기술개발사업의 지원을 받아 연구되었습니다(2018002450004).
또한, 2019년도 산업통상자원부의 재원으로 한국에너지기술평가원(KETEP)의 지원을 받아 수행한 연구과제입니다(20181510300800).
또한, 서울대학교 공학연구원의 기술적 지원에 감사드립니다.
- 1. Ahmed, B., Cao, B., McLean, J.S., Ica, T., Dohnalkova, A., Istanbullu, O., Paksoy, A., Fredrickson J.K., and Beyenal, H., 2012, Fe (III) reduction and U (VI) immobilization by Paenibacillus sp. strain 300A, isolated from Hanford 300A subsurface sediments. Appl. Environ. Microbiol., 78(22), 8001-8009.
-

- 2. Bachate, S.P., Cavalca, L., and Andreoni, V., 2009, Arsenic-resistant bacteria isolated from agricultural soils of Bangladesh and char-acterization of arsenate-reducing strains. J. Appl. Microbiol., 107(1), 145-156.
-

- 3. Benz, M., Schink, B., and Brune, A., 1998, Humic acid reduction by Propionibacterium freudenreichii and other fermenting bacteria. Appl. Environ. Microbiol., 64(11), 4507-4512.
-

- 4. Bishop, M.E., Dong, H., Glasser, P., Briggs, B.R., Pentrak, M., Stucki, J.W., Boyanov, M.I., Kemner, K.M., and Kovarik, L., 2019, Reactivity of redox cycled Fe-bearing subsurface sediments towards hexavalent chromium reduction. Geochim. Cosmochim. Acta, 252, 88-106.
-

- 5. Boucher, D., Jardillier, L., and Debroas, D., 2006, Succession of bacterial community composition over two consecutive years in two aquatic systems: a natural lake and a lake-reservoir. FEMS Microbiol. Ecol., 55(1), 79-97.
-

- 6. Burnol, A., Garrido, F., Baranger, P., Joulian, C., Dictor, M.-C., Bodénan, F., Morin, G., and Charlet, L., 2007, Decoupling of arse-nic and iron release from ferrihydrite suspension under reducing conditions: a biogeochemical model. Geochem. Trans., 8(1), 12.
-

- 7. Calatayud, M., Gimeno-Alcañiz, J.V., Vélez, D., and Devesa, V., 2014, Trivalent arsenic species induce changes in expression and levels of proinflammatory cytokines in intestinal epithelial cells. Toxicol. Lett., 224(1), 40-46.
-

- 8. Clague, J.C., Stenger, R., and Morgenstern, U., 2019, The influence of unsaturated zone drainage status on denitrification and the redox succession in shallow groundwater. Sci. Total Environ., 660, 1232-1244.
-

- 9. Couture, R.-M., Charlet, L., Markelova, E., Madé, B.t., and Parsons, C.T., 2015, On–off mobilization of contaminants in soils during redox oscillations. Environ. Sci. Technol., 49(5), 3015-3023.
-

- 10. D'Hondt, S., J©ªrgensen, B.B., Miller, D.J., Batzke, A., Blake, R., Cragg, B.A., Cypionka, H., Dickens, G.R., Ferdelman, T., and Hinrichs, K.-U., 2004, Distributions of microbial activities in deep subseafloor sediments. Science, 306(5705), 2216-2221.
-

- 11. de Zamaroczy, M., Delorme, F., and Elmerich, C., 1989, Regulation of transcription and promoter mapping of the structural genes for nitrogenase (nifHDK) of Azospirillum brasilense Sp7. Mol. Gen. Genet., 220(1), 33-42.
-

- 12. DeAngelis, K.M., Silver, W.L., Thompson, A.W., and Firestone, M.K., 2010, Microbial communities acclimate to recurring changes in soil redox potential status. Environ. Microbiol., 12(12), 3137-3149.
-

- 13. Dobbin, P.S., Carter, J.P., García-Salamanca San Juan, C., von Hobe, M., Powell, A.K., and Richardson, D.J., 1999, Dissimilatory Fe (III) reduction by Clostridium beijerinckii isolated from freshwater sediment using Fe (III) maltol enrichment. FEMS Microbiol. Lett., 176(1), 131-138.
-

- 14. Duan, Y., Schaefer, M.V., Wang, Y., Gan, Y., Yu, K., Deng, Y., and Fendorf, S., 2019, Experimental constraints on redox-induced arsenic release and retention from aquifer sediments in the central Yangtze River Basin. Sci. Total Environ., 649, 629-639.
-

- 15. Falkowski, P.G., Fenchel, T., and Delong, E.F., 2008, The microbial engines that drive Earth's biogeochemical cycles. Science, 320(5879), 1034-1039.
-

- 16. Harvey, C.F., Swartz, C.H., Badruzzaman, A., Keon-Blute, N., Yu, W., Ali, M.A., Jay, J., Beckie, R., Niedan, V., and Brabander, D., 2002, Arsenic mobility and groundwater extraction in Bangladesh. Science, 298(5598), 1602-1606.
-

- 17. Hong, H., Kim, S.-J., Min, U.-G., Lee, Y.-J., Kim, S.-G., Jung, M.-Y., Seo, Y.-S., and Rhee, S.-K., 2015, Geosporobacter ferrire-ducens sp. nov., an anaerobic iron-reducing bacterium isolated from an oil-contaminated site. Antonie Van Leeuwenhoek, 107(4), 971-977.
-

- 18. Islam, F.S., Gault, A.G., Boothman, C., Polya, D.A., Charnock, J.M., Chatterjee, D., and Lloyd, J.R., 2004, Role of metal-reducing bacteria in arsenic release from Bengal delta sediments. Nature, 430(6995), 68-71.
-

- 19. Jackson, C.R., Dugas, S.L., and Harrison, K.G., 2005, Enumeration and characterization of arsenate-resistant bacteria in arsenic free soils. Soil Biol. Biochem., 37(12), 2319-2322.
-

- 20. Jiang, S., Lee, J.-H., Kim, D., Kanaly, R.A., Kim, M.-G., and Hur, H.-G., 2013, Differential arsenic mobilization from As-bearing ferrihydrite by iron-respiring Shewanella strains with different arsenic-reducing activities. Environ. Sci. Technol., 47(15), 8616-8623.
-

- 21. Jung, H.B., Zheng, Y., Rahman, M.W., Rahman, M.M., and Ahmed, K.M., 2015, Redox zonation and oscillation in the hyporheic zone of the Ganges-Brahmaputra-Meghna Delta: implications for the fate of groundwater arsenic during discharge. Appl. Geochem., 63, 647-660.
-

- 22. Lara, J., González, L.E., Ferrero, M., Díaz, G.C., Pedrós-Alió, C., and Demergasso, C., 2012, Enrichment of arsenic transforming and resistant heterotrophic bacteria from sediments of two salt lakes in Northern Chile. Extremophiles, 16(3), 523-538.
-

- 23. Lee, J.H., Fredrickson, J.K., Plymale, A.E., Dohnalkova, A.C., Resch, C.T., McKinley, J.P., and Shi, L., 2015, An autotrophic H 2-oxidizing, nitrate-respiring, T c (VII)-reducing A cidovorax sp. isolated from a subsurface oxic-anoxic transition zone. Environ. Microbiol. Rep., 7(3), 395-403.
-

- 24. Lin, Z., Wang, X., Wu, X., Liu, D., Yin, Y., Zhang, Y., Xiao, S., and Xing, B., 2018, Nitrate reduced arsenic redox transformation and transfer in flooded paddy soil-rice system. Environ. Pollut., 243, 1015-1025.
-

- 25. Loreau, M., 2001, Microbial diversity, producer–decomposer interactions and ecosystem processes: a theoretical model. Proc. R. Soc. London, Ser. B, 268(1464), 303-309.
-

- 26. Lovley, D., 2006, Dissimilatory Fe (III)-and Mn (IV)-reducing prokaryotes. The Prokaryotes: Volume 2: Ecophysiology and Bio-chemistry, 635-658.
-

- 27. Mandal, B.K. and Suzuki, K.T., 2002, Arsenic round the world: a review. Talanta, 58(1), 201-235.
-

- 28. Mejia, J., Roden, E.E., and Ginder-Vogel, M., 2016, Influence of oxygen and nitrate on Fe (hydr) oxide mineral transformation and soil microbial communities during redox cycling. Environ. Sci. Technol., 50(7), 3580-3588.
-

- 29. Meng, X., Dupont, R.R., Sorensen, D.L., Jacobson, A.R., and McLean, J.E., 2017, Mineralogy and geochemistry affecting arsenic solubility in sediment profiles from the shallow basin-fill aquifer of Cache Valley Basin, Utah. Appl. Geochem., 77, 126-141.
-

- 30. Möller, L., Laas, P., Rogge, A., Goetz, F., Bahlo, R., Leipe, T., and Labrenz, M., 2019, Sulfurimonas subgroup GD17 cells accumu-late polyphosphate under fluctuating redox conditions in the Baltic Sea: possible implications for their ecology. The ISME journal, 13(2), 482-493.
-

- 31. Muntau, M., Schulz, M., Jewell, K.S., Hermes, N., Hübner, U., Ternes, T., and Drewes, J.E., 2017, Evaluation of the short-term fate and transport of chemicals of emerging concern during soil-aquifer treatment using select transformation products as intrinsic re-dox-sensitive tracers. Sci. Total Environ., 583, 10-18.
-

- 32. Newman, D.K. and Banfield, J.F., 2002, Geomicrobiology: how molecular-scale interactions underpin biogeochemical systems. Sci-ence, 296(5570), 1071-1077.
-

- 33. Noël, V., Boye, K., Kukkadapu, R.K., Li, Q., and Bargar, J.R., 2019, Uranium storage mechanisms in wet-dry redox cycled sediments. Water Res., 152, 251-263.
-

- 34. Oliveira, A., Pampulha, M., Neto, M., and Almeida, A., 2009, Enumeration and characterization of arsenic-tolerant diazotrophic bacte-ria in a long-term heavy-metal-contaminated soil. Water, Air, Soil Pollut., 200(1-4), 237-243.
-

- 35. Oremland, R.S. and Stolz, J.F., 2005, Arsenic, microbes and contaminated aquifers. Trends Microbiol., 13(2), 45-49.
-

- 36. Parsons, C.T., Couture, R.-M., Omoregie, E.O., Bardelli, F., Greneche, J.-M., Roman-Ross, G., and Charlet, L., 2013, The impact of oscillating redox conditions: arsenic immobilisation in contaminated calcareous floodplain soils. Environ. Pollut., 178, 254-263.
-

- 37. Paul, S., Majumdar, S., and Giri, A.K., 2015, Genetic susceptibility to arsenic-induced skin lesions and health effects: a review. Gene. Environ., 37(1), 23.
-

- 38. Ray, A.E., Connon, S.A., Neal, A.L., Fujita, Y., Cummings, D.E., Ingram, J.C., and Magnuson, T.S., 2018, Metal transformation by a novel pelosinus isolate from a subsurface environment. Front. Microbiol., 9.
-

- 39. Rodriguez-Mora, M.J., Scranton, M.I., Taylor, G.T., and Chistoserdov, A.Y., 2015, The dynamics of the bacterial diversity in the redox transition and anoxic zones of the Cariaco Basin assessed by parallel tag sequencing. FEMS Microbiol. Ecol., 91(9), fiv088.
-

- 40. Shade, A. and Handelsman, J., 2012, Beyond the Venn diagram: the hunt for a core microbiome. Environ. Microbiol., 14(1), 4-12.
-

- 41. Smedley, P.L. and Kinniburgh, D.G., 2002, A review of the source, behaviour and distribution of arsenic in natural waters. Appl. Geochem., 17(5), 517-568.
-

- 42. Stookey, L. L., 1970, Ferrozine---a new spectrophotometric reagent for iron. Anal. Chem., 42(7), 779-781.
-

- 43. Sultana, M., Vogler, S., Zargar, K., Schmidt, A.-C., Saltikov, C., Seifert, J., and Schlömann, M., 2012, New clusters of arsenite oxi-dase and unusual bacterial groups in enrichments from arsenic-contaminated soil. Arch. Microbiol., 194(7), 623-635.
-

- 44. Teh, Y.A., Silver, W.L., and Conrad, M.E., 2005, Oxygen effects on methane production and oxidation in humid tropical forest soils. Global Change Biol., 11(8), 1283-1297.
-

- 45. Torsvik, V. and ¨ªvreås, L., 2002, Microbial diversity and function in soil: from genes to ecosystems. Curr. Opin. Microbiol., 5(3), 240-245.
-

- 46. Waldrop, M.P. and Firestone, M.K., 2006, Seasonal dynamics of microbial community composition and function in oak canopy and open grassland soils. Microb. Ecol., 52(3), 470-479.
-

- 47. Wang, N., Xue, X.-M., Juhasz, A.L., Chang, Z.-Z., and Li, H.-B., 2017, Biochar increases arsenic release from an anaerobic paddy soil due to enhanced microbial reduction of iron and arsenic. Environ. Pollut., 220, 514-522.
-

- 48. Wang, X.-J., Yang, J., Chen, X.-P., Sun, G.-X., and Zhu, Y.-G., 2009, Phylogenetic diversity of dissimilatory ferric iron reducers in paddy soil of Hunan, South China. J. Soils Sed., 9(6), 568-577.
-

- 49. Wang, Y., Liu, X.-h., Si, Y.-b., and Wang, R.-f., 2016, Release and transformation of arsenic from As-bearing iron minerals by Fe-reducing bacteria. Chem. Eng. J., 295, 29-38.
-

- 50. Wenzel, W.W., Kirchbaumer, N., Prohaska, T., Stingeder, G., Lombi, E., and Adriano, D.C., 2001, Arsenic fractionation in soils us-ing an improved sequential extraction procedure. Anal. Chim. Acta, 436(2), 309-323.
-

- 51. Winkel, L., Berg, M., Amini, M., Hug, S.J., and Johnson, C.A., 2008, Predicting groundwater arsenic contamination in Southeast Asia from surface parameters. Nature Geoscience, 1(8), 536-542.
-

- 52. Xie, Z., Wang, J., Wei, X., Li, F., Chen, M., Wang, J., and Gao, B., 2018, Interactions between arsenic adsorption/desorption and indigenous bacterial activity in shallow high arsenic aquifer sediments from the Jianghan Plain, Central China. Sci. Total Environ., 644, 382-388.
-

- 53. Yang, Y.-P., Zhang, H.-M., Yuan, H.-Y., Duan, G.-L., Jin, D.-C., Zhao, F.-J., and Zhu, Y.-G., 2018, Microbe mediated arsenic re-lease from iron minerals and arsenic methylation in rhizosphere controls arsenic fate in soil-rice system after straw incorporation. En-viron. Pollut., 236, 598-608.
-

- 54. Zhao, R., Hannisdal, B., Mogollon, J.M., and J©ªrgensen, S.L., 2019, Nitrifier abundance and diversity peak at deep redox transition zones. Scientific Reports, 9(1), 8633.
-

 This Article
This Article
-
2020; 25(1): 25-36
Published on Mar 31, 2020
- 10.7857/JSGE.2020.25.1.025
- Received on Dec 23, 2019
- Revised on Dec 26, 2019
- Accepted on Feb 24, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kyoungphile Nam
-
Department of Civil and Environmental Engineering, Seoul National University, Seoul 08826, Korea
- E-mail: kpnam@snu.ac.kr