- Study on Stabilization of Arsenic in Soil through in situ Formation of Amorphous Fe Oxides and use of X-ray Absorption Spectroscopy
Jinhee Park1·Hyeonyong Chung1·Sang Hyun Kim1·Jinsung An2·Kyoungphile Nam1*
1Department of Civil & Environmental Engineering, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Republic of Korea
2Department of Biological & Environmental Engineering, Semyung University, 65 Semyung-ro, Jecheon-si, Chungcheongbuk-do 27136, Republic of Korea- 비결정질철산화물 원위치 형성을 통한 비소오염토양 안정화 및 X선 분광분석법의 활용에 대한 연구
박진희1·정현용1·김상현1·안진성2·남경필1
1서울대학교 건설환경공학부
2세명대학교 바이오환경공학과
This study was conducted to investigate the in situ formation of
amorphous Fe oxides as a stabilization technology in As-contaminated soil.
After addition of ferric nitrate and the neutralizing agent, most of
extractable fractions of As in soil (i.e., SO42- and PO43--extractable
As) was converted into As bound to amorphous Fe oxides. In addition, results of
solubility bioavailability research consortium (SBRC) test indicated that a
significant amount of As in untreated soil changed to a non-bioaccessible form
after stabilization. The reason was attributed to the newly formed amorphous Fe
oxides in the stabilized soil, which was confirmed by linear combination of
fitting (LCF) using X-ray absorption spectroscopy (XAS) analysis.
Interestingly, after five months of aging of the stabilized soil, ferrihydrite
and schwertmannite newly formed in the soil were transformed to crystalline Fe
oxides such as goethite, and further decrease in SBRC extractable fraction of
As was observed. The results suggest that co-precipitated As with amorphous Fe
oxides can be further immobilized with time, due to the crystallization of
amorphous Fe oxides.
Keywords: Co-precipitation, Arsenic, Amorphous Fe oxides, Crystallization, X-ray absorption spectroscopy (XAS)
중금속으로 인한 토양오염이 발생하는 경우 오염원 및 부지의 특성에 따라 다양한 정화공법을 선택하여 적용할 수 있으나, 현장에서의 토양
굴착 및 적극적 정화공법의 적용이 어려운 경우 환경매질 내에 안정화제를 주입하여 오염물질의 이동성(mobility) 및 생물학적이용성(bio- availability)을
낮추기 위한 안정화 공법이 적용되고 있다(Jeong et
al., 2016; Yang et al., 2016). 특히 토양 내에서 산화 음이온으로 존재하는 비소는 철산화물과 쉽게 결합할 수 있는 것으로
알려져 있어 철화합물을 기반으로 한 안정화 공법이 연구되어 왔다(An et
al., 2019; Gimenez et al., 2007; Voegelin and
Hug 2003). 기 형성된 철산화물을 비소오염토양에 주입하는 경우에는 일반적으로 흡착(adsorption)을 통한 안정화 효과를 기대할 수 있는
것으로 알려져 있다(An et al., 2017; Jeong et al.,
2016). 그러나 실제로 비소오염토양에 원위치 안정화 공법을 적용하여 비소의 화학적 추출성 및
Solubility/bioavailability research consortium(SBRC)를 통한 경구 생물학적접근성(bioaccessibility)을
평가한 결과 안정화 효과는 비특이적으로 결합된 비소의 감소에 국한될 뿐만 아니라 생물학적접근성의 감소율은 최대 19% 정도에 불과한 것으로 확인되었다(An et al., 2019).
일반적으로 기 형성된 철산화물에 비소가 유입되는 환경에서는 흡착과 같은 현상을 통해 비소와 철산화물의 결합이 발생하는 것으로 알려져
있다. 그러나 비소가 존재하는 상태에서 철산화물이 형성되는 경우 비소와 철산화물이 함께 침전되면서(co-precipitation) 보다 안정한
형태로 비소가 결합될 수 있다고 알려져 있다(Crawford et
al., 1993). 광산폐수와 같은 용액 상의 중금속을 효과적으로 제거하기 위해 철산화물 공침과 같은 기작이 활용되고 있으나(Dave and Chopda 2014; Mello et al., 2018) 실제 중금속 오염토양의 원위치
안정화 기술로써의 활용에 대한 연구는 미비한 실정이다. 공침현상을 이용한 기술은 산성광산배수 및 중금속 함유 폐수의 처리를 위해서도 사용될 수
있다는 점에서 그 활용성이 높고(Gault et al., 2005;
Regenspurg et al., 2004; Wang et al.,
2003) 비소가 철산화물과 공침되었을 때 흡착에 비해 화학적 추출성이 낮은 형태로 존재하게 된다는 점에서(Jeong et al., 2017) 비소오염토양에 이를 적용하는
경우 비소의 생물학적이용성을 효과적으로 감소시킬 수 있을 것으로 기대할 수 있다.
이에 본 연구에서는 토양 내에서 비결정질 철산화물를 형성시키고 그 과정에서 비소를 보다 화학적 추출성이 낮은 공침의 형태로 안정화시킬
수 있으며 현장에서 굴착 없이 용이하게 적용될 수 있는 원위치 비소오염토양 안정화 공법을 제시하고자 하였으며, SBRC를 통해 평가한 비소의 생물학적접근성을
바탕으로 본 공정에 대한 위해저감효과를 검증하고자 하였다. 또한 비결정질 철산화물 형성을 통한 원위치 안정화 공법을 수행함에 따라 토양 내에 형성될
수 있는 비결정질 철산화물의 종류와 변화를 규명하고자 X-ray absorption spectroscopy(XAS) 분석을 활용하였다. 선행연구를
통해 토양에서의 에이징 효과에 따라 비소의 화학종(speciation) 및 생물학적접근성의 변화에 대한 연구가 수행된 바 있으나(Tang et al., 2007; Wang et al., 2015) 실제 철산화물 원위치 형성을
통한 안정화 공법을 적용한 후 토양에서의 에이징 효과를 확인한 사례는 전무하다. 따라서 본 연구에서는 안정화 후 토양을 대상으로 에이징 효과에
따른 비소 및 철산화물에 대한 화학적 추출성, 생물학적접근성평가 및 XAS 분석을 통해 적용된 안정화 공법의 장기적 안정성을 추가적으로 검증하고자하였다.
2.1. 시료채취 및 토양특성분석
풍건하여 2 mm 체 거름한 임야 토양을 As(V) 용액(13.3 mM sodium
arsenate dibasic heptahydrate solution)과 혼합하여 3일 간 교반하여 인공오염시킨 후 실험에 사용하였다.
전함량 분석 결과(USEPA 1996), 토양시료의 비소농도는
1,014 mg/kg으로 확인되었다. 토양 시료에 대해 토양 pH, 유기물 함량, Fe/Al/Mn 산화물
함량, 양이온 교환능 및 토성(texture)을 분석하였다(Table 1) (An et al., 2017; Gee and Bauder 1986;
Sumner and Miller 1996; Thomas 1996; USEPA 1996; Walkley and Black 1934). Table 1에 나타낸 토양 시료의 물리화학적특성은 다음과 같다. 위 시료는 모래(sand) 및 실트(silt)의
함량이 높은 sandy loam 으로 분류되었으며, CEC 는 27.31 cmol/kg, 유기물 함량은 8.9%로 확인되었다. 또한 안정화 전
토양 시료에서의 철산화물의 함량은 2,527 mg/kg 수준으로 확인되었다.
2.2. 비소오염토양 원위치 안정화 실험
토양 내에서 비결정질 철산화물을 형성시키고 토양 비소와의 공침을 유도하기 위해 토양시료에 질량 대비 2% 수준의 3가 철(Iron
(III) nitrate nonahyrate, Daejung,
+98.0% purity)을 주입하고 고액비 30%(v/w) 가량이 되도록 증류수를 주입하였다. 토양에서의 비결정질 철산화물의 형성 및 침전을
유도하기 위해 고체 시약의 NaOH를 이용하여 pH를 7로 조절한 후 24시간 동안 상온에서 반응시킨 후 해당 토양시료를 “안정화 토양(stabilized
soil)”으로 명명하였으며, 장기적인 비소의 안정화 효과를 검증하기 위하여 다섯 달 동안 상온에서 에이징을 수행한 토양시료의 경우 “안정화 후
에이징 토양(aged soil after stabilization)”으로 구분하였다.
2.3. 토양 내 비소의 화학적 추출성 평가
원위치 비소오염토양 안정화 적용성을 평가하기 위해 Wenzel의 5단계 연속추출 방법에 따라 토양 내 비소의 화학적 추출성을 조사하였다(Wenzel et al., 2001). 토양에 비특이적으로 결합한 비소(Non-specifically
sorbed As: F1)와 특이적으로 결합한 비소(Specifically sorbed As: F2)를 추출하기 위해 각각 (NH4)2SO4와
(NH4)H2PO4 용매를 사용하였다. 반면에 철산화물에 흡착 또는 공침하여 존재하는
비소의 경우 비결정질에 결합한 비소(As bound to amorphous Fe oxides: F3), 결정질에 결합한 비소(As bound
to crystalline Fe oxides: F4)로 구분할 수 있는데, 이는 각각 NH4-oxlate buffer(pH
3.25) 용액과 NH4-oxalate buffer/ascorbic acid(pH 3.25) 용매를 이용하여 추출하였다. 최종적으로
잔류성 비소(Residual As: F5)의 농도는 USEPA 3052 방법에 따라 추출하였다(USEPA 1996). 각 단계별 추출을 완료한 용액을 원심분리(14,000 g, 15 min)하고 0.45 μm(Pall, Port Washington, NY) 필터로 거른 후
ICP-OES(inductively coupled plasma optical emission
spectrometer(iCAP7000 Series, Thermo Scientific, USA)를 이용하여 상등액의 비소 농도를 분석하였다.
단계별 추출방법에 대해 보다 자세한 내용은 Table 2에 나타내었다.
인체로 유입되어 생물학적으로 이용될 수 있는 비소의 농도를 평가하기 위하여 in vitro 생물학적접근성평가방법인
SBRC를 수행하였다(Ruby et al., 1999). 인체로 유입된 토양입자의
위(Stomach phase)에서의 소화과정을 모사하기 위해 HCl을 이용해 pH 1.5 ± 0.05 수준으로 조절한
0.4 M glycine buffer 용액을 사용하였다. 모사된 인공 소화액을 100 mL 취하여 150 μm 이하로 체거름시킨 토양
시료 1 g과 혼합하여 교반하고(37oC, 1 hr) 필터링 후 상등액의
비소 농도를 분석하였다. 최종적으로 토양 내 비소의 생물학적접근성은 전체 비소 농도 중에서 SBRC 방법을 통해 추출된 비소의 농도 비를 통해
결정하였다(Yang et al., 2014)]
2.4. X선 흡수 분광법(X-ray absorption spectroscopy) 분석
토양 시료 및 다양한 reference 물질 간 Extended X-ray absorption fine
structure(EXAFS) 데이터의 선형조합피팅(Linear combination fitting)을 통해 토양 내 비결정질 철산화물의 형성여부를
확인하였다. 또한 안정화시킨 토양을 상온에서 다섯 달 동안 에이징시킨 후 토양 내 비소 및 철산화물에 대한 변화를 관찰하여 이에 따른 장기적 안정화
효과를 검증하고자 하였다. 이에 앞서 안정화 공법 전후 토양 내 비소의 산화수를 확인하기 위하여 As K-edge 스펙트럼의 X-ray
absorption near edge structure(XANES) 분석을 수행하였다. As K-edge 스펙트럼은 포항공과대학교 가속기 연구소의
빔라인 10C를 형광 모드(fluorescence)로 측정하였으며, 안정화 전후 토양 시료 내 비소의 산화수는 3가 비소(iAs(III), arsenite) 및 5가 비소(iAs(V), arsenate)의 XANES 스펙트럼 분석을 통해 결정되었다.
안정화 전후 토양 시료에 존재하거나 혹은 존재하게 될 것으로 예상되는 다양한 철산화물을 준비하여 Fe K-edge 선형조합피팅을 위한
reference 시료로 활용하였다. 토양시료 및 reference 시료에서의 Fe K-edge 스펙트럼은 포항공과대학교 가속기 연구소의 빔라인
10C를 통해 투과 모드(transmission mode)로 측정하였다. 결정질 철산화물인 hematite(α-Fe2O3),
goethite(α-FeOOH), magnetite(Fe3O4)와 비결정질 철산화물로 구분되는
ferrihydrite((Fe3+)2O3· 0.5H2O) 및 schwertmannite(Fe8O8(OH)6(SO4)·nH2O)를
사용하여 안정화 전 토양(original soil), 안정화 후 토양(stabilized soil), 안정화 후 에이징 토양(aged soil
after stabilization)의 철산화물 구성을 확인할 수 있는 선형조합피팅(Linear combination fitting: LCF)을
수행하였다. 각 시료의 Extended X-ray absorption fine structure(EXAFS) 스펙트럼을 바탕으로
k-range 2.0-9.0 Å-1에서 선형조합피팅을 수행하고
안정화 전후 토양에서의 철산화물 변화를 조사하였다. 데이터의 보정, 정규화,
선형조합피팅 등은 ATHENA software를 사용하여 진행하였다 (Ravel
and Newville 2005).
|
Table 1 Physicochemical properties and As concentrations of the soil used in this study |
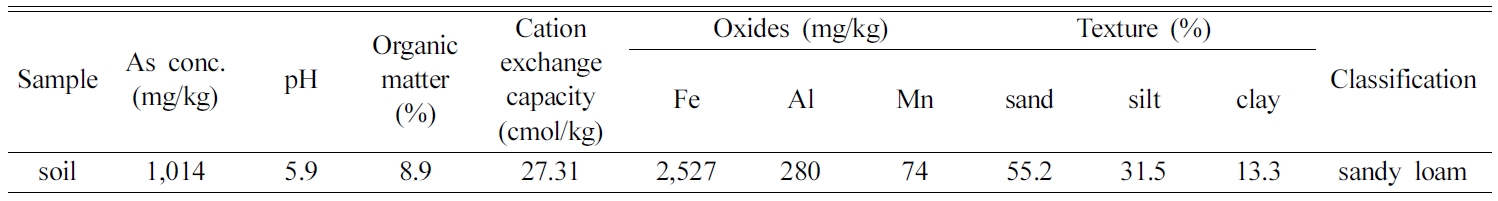
3.1. 토양시료의 물리화학적특성 및 비소오염특성
Table 1에 나타낸 토양 시료의 물리화학적특성은 다음과 같다. 위 시료는 모래(sand) 및 실트(silt)의 함량이 높은
sandy loam으로 분류되었으며, CEC는 27.31 cmol/kg, 유기물 함량은
8.9% 로 확인되었다. 또한 안정화 전 토양 시료에서의 철산화물의 함량은 2,527 mg/kg 수준으로 확인되었다. 분석 결과는
Table 1을 통해 확인할 수 있다.
3.2. 비소오염토양의 원위치 안정화 효과
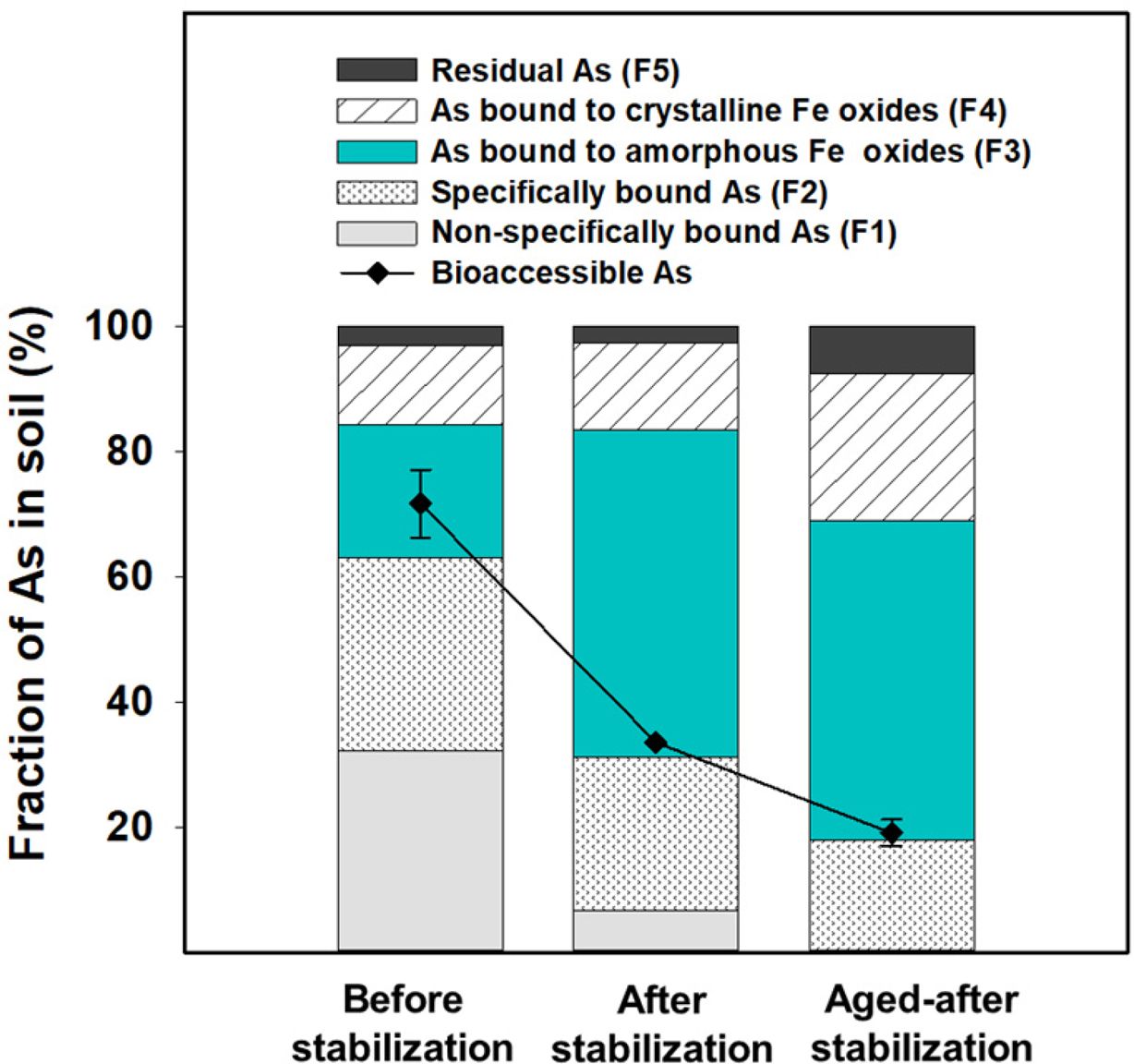
안정화 전후 토양 내 비소의 화학적 결합 형태에 대한 변화는 두드러지는 것으로 확인되었다(Fig. 1). 안정화 전 토양에서는 약
62.9% 가량의 비소가 SO42-, PO43-에
의해 용출이 되었으며, 이는 화학적 추출성이 높은 F1과 F2 형태의 비소이다. 그러나 안정화 후 토양에서는 그 비율이 약 2배 이상 감소하였으며,
대신 비결정질 철산화물과 결합된 비소인 F3가 21.4%에서 52.3%까지 큰 폭으로 증가되었다. 예비실험을 통해 질산철만을 주입하여 반응을 완료한
토양에서는 F3가 증가하지 않으나 질산철과 중화제를 모두 주입하여 안정화를 유도한 토양에서만 F3이 증가되는 것이 확인되었다. 따라서 안정화 후
F3의 증가는 새롭게 생성된 비결정질 철산화물에 의한 것으로 판단할 수 있다. 실제 안정화된 토양 내 철산화물의 함량 또한 8 배 이상 증가된
것으로 확인되었다.
일반적으로 철산화물과 결합한 비소는 F1과 F2에 비해 (Wang
et al., 2017; Wang et al., 2015) 화학적 추출성이 낮은 편이지만, 화학적 결합의 종류에 따라 그 생물학적접근성이
달라질 수 있는 것으로 알려져 있다. 실제 Ferrihydrite에 흡착된 비소에 비해 철산화물의 침전과정에서 공침된 비소가 화학적추출성과 생물학적접근성
모두 현저히 낮은 것으로 확인되었다(Jeong et al., 2017).
SBRC 방법을 통해 비소의 생물학적접근성을 평가한 결과, 안정화 전 토양 내 비소의 생물학적접근성은 77%였으며 이를 연속추출결과와
비교해 보면 F1, F2 대부분과 F3의 41% 정도에 해당되는 것을 알 수 있다(Fig. 1). 이는 화학적추출성이 높은 것으로 알려진 F1과 F2뿐만 아니라 비결정질 철산화물과 결합하고 있는 F3 형태의 비소도 상당량이
생물학적으로 이용 가능한 형태일 수 있음을 의미한다. 반면, 안정화 직후 토양에서 비소의 생물학적접근성은 33%까지 감소하였는데 이를 바탕으로
F1, F2 대부분과 F3 중 극히 일부(5%)만이 안정화 후 SBRC에 의해 추출되는 것을 확인할 수 있었다.
자연환경에서 유입된 토양 내 비소는 공극수로 용출되는 과정에서 토양에 존재하는 철/알루미늄 산화물 등에 흡착하여 존재할 수 있는 것으로
알려져 있다(An et al., 2017). 그러나 토양 환경의 변화로
인해 비소가 철산화물에 흡착하는 경우에도 비소의 생물학적접근성은 크게 감소하지 않을 수 있다. 실제로 철산화물을 기반으로 한 안정화제를 비소오염토양에
주입하여 원위치 안정화 공법을 수행한 경우, 철산화물에 결합한 비소의 증가에도 불구하고 생물학적접근성의 측면에서 주목할 만한 수준으로의 감소는
관찰되지 않았다(An et al., 2019; An et al., 2017). 그러나 본 연구에서는
비결정질철산화물의 원위치 형성을 통해 비소-철산화물 공침을 유도하고 이에 따른 생물학적접근성 저감 효과를 달성할 수 있다는 사실을 확인하였다.
3.3. 철산화물 결정화에 의한 장기적 안정화 효과
안정화된 토양에서의 비소의 생물학적접근성은 시간이 지남에 따라 더욱 감소되는 것으로 나타났다(Fig. 1). 안정화 후 토양을 상온에서 다섯 달 동안 에이징시킨 결과 비소의 생물학적접근성은 안정화 직후 토양에 비해 43% 정도 더 감소되었다.
또한 연속추출 결과 에이징된 토양에서는 결정질 철산화물에 결합한 비소인 F4의 분율이 14.0%에서 23.5%까지 큰 폭으로 증가하였다. 이는
안정화 직후 침전된 비결정질 철산화물이 시간이 지남에 따라 결정화될 수 있다는 것을 시사한다. 또한 비결정질 철산화물과 결합하여 안정화된 비소가
철산화물이 결정화됨에 따라 화학적 추출성이 더욱 낮은 형태로 안정화될 수 있다는 것으로 해석될 수 있다. 실제로 Sb(V)와 Se(IV) 등의 경우 ferrihydrite와 공침된 후 에이징 효과에 의해
hematite나 goethite와 같은 결정질 철산화물로 변화되는 과정에서 철산화물 격자에 격리된 상태로 고정(immobili- zation)되거나 입자의
집적(aggregation)에 의해 더욱 안정한 형태로 유지될 수 있음이 확인되었다(Francisco et al., 2018; Mitsunobu et al., 2013). 이에 본 연구에서는 추가적으로
X-선 흡수 분광법의 선형조합피팅을 활용하여 안정화 공법 적용에 따른 토양 내 철산화물의 구성에 대한 변화를 관찰하였다.
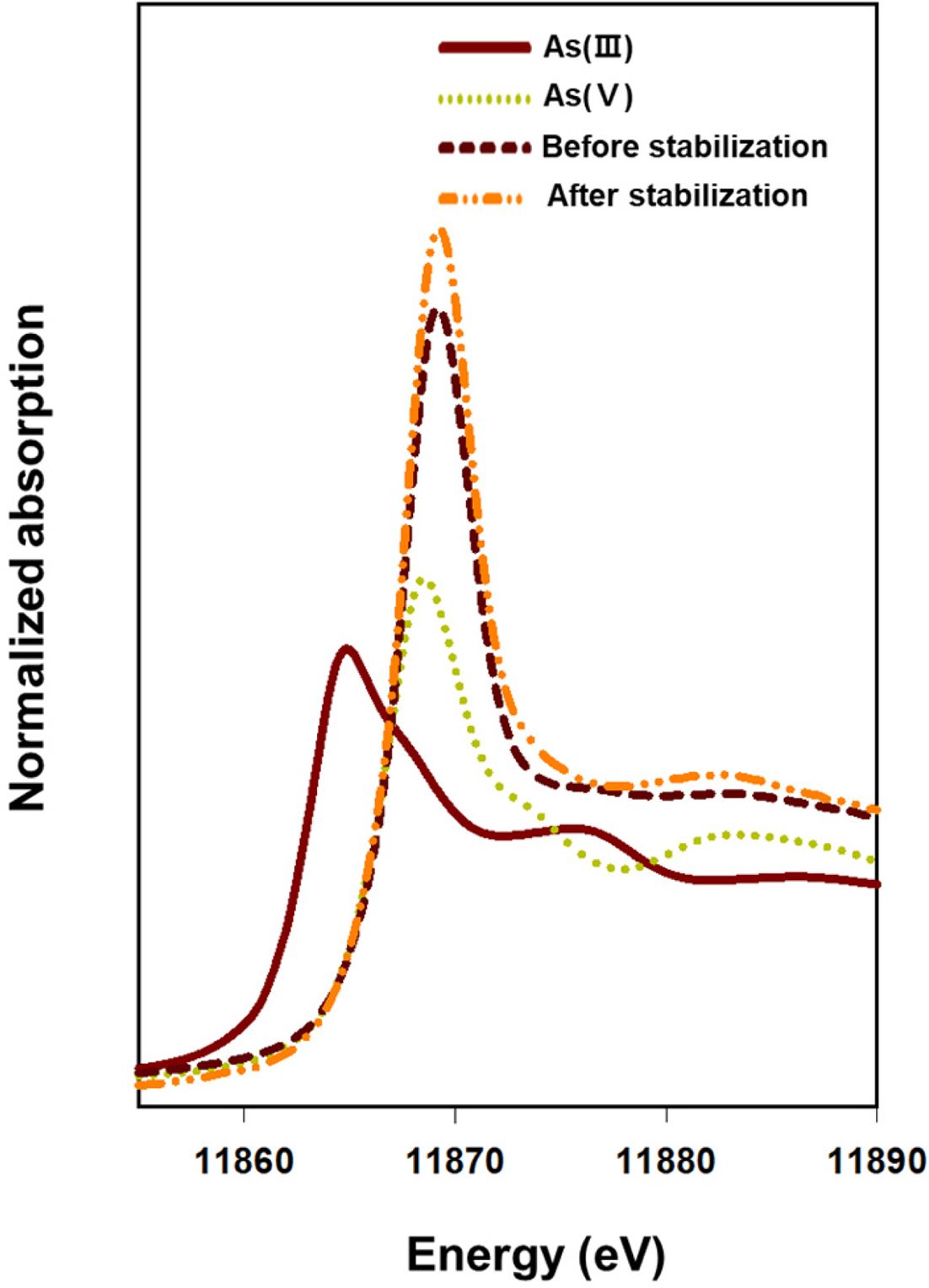
Fe K-edge EXAFS 스펙트럼 분석을 통해 안정화 전후 토양에서의 철산화물 변화를 확인하기에 앞서 As K-edge
XANES 분석을 수행하여 안정화 전후 비소의 산화수를 확인하고자 하였다. 안정화 전후 토양을 대상으로 3가 및 5가 비소의 XANES 스펙트럼과
비교한 결과 안정화 공법을 적용한 후에도 토양 내 비소는 환원되지 않고 5가 비소 상태로 유지되는 것으로 나타났다(Fig. 2). 또한 Fe
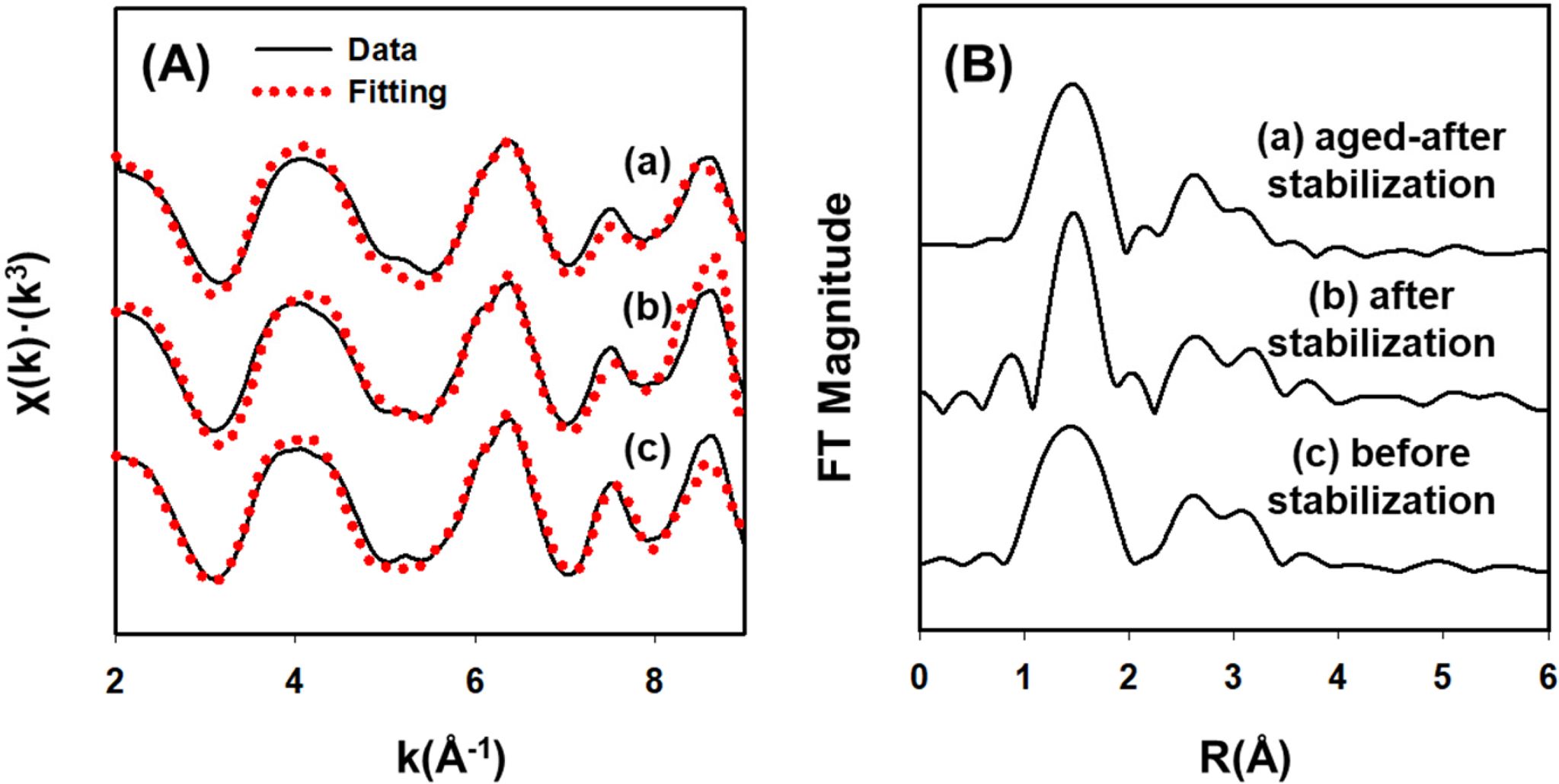
K-edge EXAFS 스펙트럼을 바탕으로 안정화 전후 토양시료에 대하여 reference 물질과 선형조합피팅을 수행한 결과를 Fig. 3에 나타내었다.
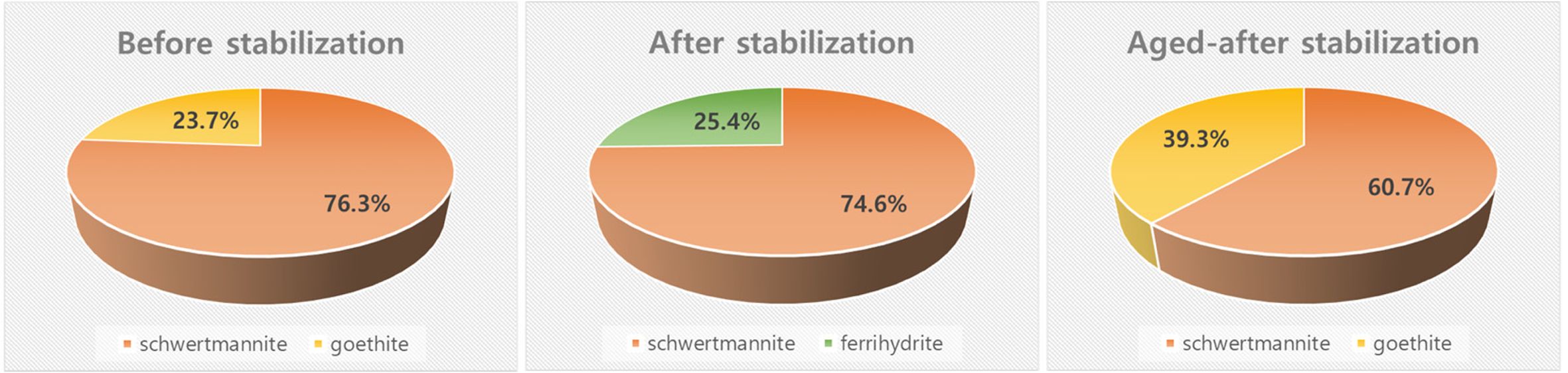
안정화 전 토양에서는 schwermtannite와 goethite가 존재하는 것이 확인되었으나 안정화 공법을 적용한 후에는 토양에서 비결정질철산화물인
ferrihydrite와 schwertmannite이 새롭게 형성되는 것으로 확인되었다. 그러나 안정화 후 토양을 상온에서 다섯 달 동안 에이징시킨 경우에는
ferrihydrite와 schwertmannit의 비율이 큰 폭으로 감소하였고 오히려 결정질 철산화물인 goethite의 비율이 증가하는 것으로
나타났다(Fig. 4). 이를 바탕으로 비결정질 철산화물 형성을 통한 비소 오염토양 안정화 공법을 적용하는 경우에는 에이징 과정에서 토양 내 철산화물이
더욱 안정한 형태로 결정화될 수 있을 뿐만 아니라 이 과정에서 비소와 철산화물의 결합이 오랫동안 유지될 수 있다는 사실을 확인하였다.
|
Fig. 1 Changes of the chemical forms and bioaccessibility of As in soil before and after stabilization. Stabilized soil was aged for five-months at room temperature, which sample was classified as ‘Aged-after stabilization’. |
|
Fig. 2 Oxidation states of As in soil before and after stabilization, which were confirmed by XANES analysis. |
|
Fig. 3 (A) Fe K-edge EXAFS spectra of the (a) aged soil after stabilization, (b) stabilized soil, and (c) original soil. Dotted line indicates the fitted results with various reference materials. (B) Radial structure functions (RSF) of the soils. |
|
Fig. 4 Mineralogical changes of Fe oxides in original soil, freshly stabilized soil, and aged soil after stabilization. The compositional results were acquired from EXAFS-LCF. |
본 연구에서는 비결정질 철산화물의 원위치 형성을 통해 토양 비소의 공침을 유도하였고 그로 인한 생물학적접근성 저감 현상을 확인하였다.
화학적 추출시험을 통해 안정화된 토양에서 생물학적접근성이 낮은 형태인 비소-철산화물 형성의 증가를 확인하였으며, X-선 흡수 분광법을 통해
ferrihydrite와 schwertmannite와 같은 비결정질 철산화물이 안정화 과정에서 토양에 형성 및 침전될 수 있다는 사실을 발견하였다.
나아가 시간이 경과함에 따라 이러한 비결정질 철산화물이 결정화되는 것을 확인하였으며 이는 안정화된 비소의 장기적인 안정화 효과를 기대할 수 있다는
것을 의미할 수 있다.
본 연구는 환경부의 재원으로 한국환경산업기술원의 지중환경오염∙위해관리기술개발사업의
지원을 받아 연구되었습니다(2018002450002). 또한, 서울대학교 공학연구원의 기술적 지원에도 감사드립니다.
- 1. An, J., Jeong, B., and Nam, K., 2019, Evaluation of the effectiveness of in situ stabilization in the field aged arsenic-contaminated soil: Chemical extractability and biological response, J. Hazard. Mater., 367, 137-143.
-

- 2. An, J., Yang, K., Kang, W., Lee, J.S., and Nam, K., 2017, Risk Mitigation Measures in Arsenic-contaminated Soil at the Forest Area Near the Former Janghang Smelter Site: Applicability of Stabilization Technique and Follow-up Management Plan, J. Soil Groundw., 22(6), 1-11.
- 3. Crawford, R.J., Harding, I.H., and Mainwaring, D.E., 1993, Adsorption and coprecipitation of single heavy metal ions onto the hy-drated oxides of iron and chromium, Langmuir, 9(11), 3050-3056.
-

- 4. Dave, P.N. and Chopda, L.V., 2014, Application of iron oxide nanomaterials for the removal of heavy metals, J. Nanotechnol., 2014(1), 1-14.
-

- 5. Francisco, P.C.M., Sato, T., Otake, T., Kasama, T., Suzuki, S., Shiwaku, H., and Yaita, T., 2018, Mechanisms of Se (IV) co-precipitation with ferrihydrite at acidic and alkaline conditions and its behavior during aging, Environ. Sci. Technol., 52(8), 4817-4826.
-

- 6. Gault, A.G., Cooke, D.R., Townsend, A.T., Charnock, J.M., and Polya, D.A., 2005, Mechanisms of arsenic attenuation in acid mine drainage from Mount Bischoff, western Tasmania, Sci. Total Environ., 345(1-3), 219-228.
-

- 7. Gee, G.W. and Bauder, J.W., 1986, Particle-size analysis, Methods of Soil Analysis: Part 1, Physical and Mineralogical Methods, Soil Science Society of America Inc., Madison, WI, USA, 383-411.
- 8. Gimenez, J., Martinez, M., de Pablo, J., Rovira, M., and Duro, L., 2007, Arsenic sorption onto natural hematite, magnetite, and goe-thite, J. Hazard. Mater., 141(3), 575-580.
- 9. Jeong, S., Moon, H.S., Yang, W., and Nam, K., 2016, Applicability of Enhanced-phytoremediation for Arsenic-contaminated Soil, J. Soil Groundw., 21(1), 40-48.
-

- 10. Jeong, S., Yang, K., Jho, E.H., and Nam, K., 2017, Importance of chemical binding type between As and iron-oxide on bioaccessibil-ity in soil: Test with synthesized two line ferrihydrite, J. Hazard. Mater., 330, 157-164.
-

- 11. Mello, J.W.V.d., Gasparon, M., and Silva, J., 2018, Effectiveness of arsenic co-precipitation with Fe-Al hydroxides for treatment of contaminated water, Rev. Bras. Cienc. Solo., 42.
-

- 12. Mitsunobu, S., Muramatsu, C., Watanabe, K., and Sakata, M., 2013, Behavior of antimony (V) during the transformation of ferrihy-drite and its environmental implications, Environ. Sci. Technol., 47(17), 9660-9667.
-

- 13. Ravel, B. and Newville, M., 2005, ATHENA, ARTEMIS, HEPHAESTUS: data analysis for X-ray absorption spectroscopy using IFEFFIT, J. Synchrotron Radiat., 12(4), 537-541.
-

- 14. Regenspurg, S., Brand, A., and Peiffer, S., 2004, Formation and stability of schwertmannite in acidic mining lakes, Geochim. Cos-mochim. Acta, 68(6), 1185-1197.
-

- 15. Ruby, M.V., Schoof, R., Brattin, W., Goldade, M., Post, G., Harnois, M., Mosby, D., Casteel, S., Berti, W., and Carpenter, M., 1999, Advances in evaluating the oral bioavailability of inorganics in soil for use in human health risk assessment, Environ. Sci. Technol., 33(21), 3697-3705.
- 16. Sumner, M.E. and Miller, W., 1996, Cation exchange capacity and exchange coefficients. Methods of Soil Analysis: Part 3, Chemical Methods, Soil Science Society of America Inc., Madison, WI, USA, 1201-1229.
- 17. Tang, X.-Y., Zhu, Y.-G., Shan, X.-Q., McLaren, R., and Duan, J., 2007, The ageing effect on the bioaccessibility and fractionation of arsenic in soils from China, Chemosphere, 66(7), 1183-1190.
-

- 18. Thomas, G.W., 1996, Soil pH and soil acidity, Methods of Soil Analysis: Part 3, Chemical Methods, Soil Science Society of America Inc., Madison, WI, USA, 475-490.
- 19. USEPA, 1996, Method 3052-Microwave Assisted Acid Digestion of Siliceous and Organically Based Matrices.
- 20. Voegelin, A. and Hug, S.J., 2003, Catalyzed oxidation of arsenic (III) by hydrogen peroxide on the surface of ferrihydrite: an in situ ATR-FTIR study, Environ. Sci. Technol., 37(5), 972-978.
-

- 21. Walkley, A. and Black, I.A., 1934, An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method, Soil Sci., 37(1), 29-38.
-

- 22. Wang, J.W., Bejan, D., and Bunce, N.J., 2003, Removal of arsenic from synthetic acid mine drainage by electrochemical pH adjust-ment and coprecipitation with iron hydroxide, Environ. Sci. Technol., 37(19), 4500-4506.
-

- 23. Wang, Y., Zeng, X., Lu, Y., Bai, L., Su, S., and Wu, C., 2017, Dynamic arsenic aging processes and their mechanisms in nine types of Chinese soils, Chemosphere, 187, 404-412.
-

- 24. Wang, Y., Zeng, X., Lu, Y., Su, S., Bai, L., Li, L., and Wu, C., 2015, Effect of aging on the bioavailability and fractionation of arsenic in soils derived from five parent materials in a red soil region of Southern China, Environ. Pollut., 207, 79-87.
-

- 25. Wenzel, W.W., Kirchbaumer, N., Prohaska, T., Stingeder, G., Lombi, E., and Adriano, D.C., 2001, Arsenic fractionation in soils us-ing an improved sequential extraction procedure, Anal. Chim. Acta, 436(2), 309-323.
-

- 26. Yang, K., Jeong, S., Jho, E.H., and Nam, K., 2016, Effect of biogeochemical interactions on bioaccessibility of arsenic in soils of a former smelter site in Republic of Korea, Environ. Geochem. Health, 38(6), 1347-1354.
-

- 27. Yang, K., Kim, Y.-J., Im, J., and Nam, K., 2014, Determination of human health risk incorporated with arsenic bioaccessibility and remediation goals at the former Janghang smelter site, J. Soil Groundw., 19(4), 52-61.
-

 This Article
This Article
-
2020; 25(2): 9-15
Published on Jun 30, 2020
- 10.7857/JSGE.2020.25.2.009
- Received on Apr 30, 2020
- Revised on May 7, 2020
- Accepted on Jun 5, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kyoungphile Nam
-
Department of Civil & Environmental Engineering, Seoul National University, 1 Gwanak-ro, Gwanak-gu, Seoul 08826, Republic of Korea
- E-mail: kpnam@snu.ac.kr






