- The Effect of Geological Media on the Denitrification of Nitrate in Subsurface Environments
Ji-Hun Jeon·Woo-Chun Lee·Sang-Woo Lee·Soon-Oh Kim*
Department of Geology and Research Institute of Natural Science (RINS), Gyeongsang National University (GNU)
- 지중환경 내 지질 매체가 질산염의 탈질 반응에 미치는 영향에 대한 고찰
전지훈·이우춘·이상우·김순오*
경상대학교 지질과학과 및 기초과학연구소(RINS)
Nitrate contamination has received much attention at local as well as
regional scales. The domestic situation is not out of exception, and it has
been reported to be very serious, particularly within agricultural areas as a
result of excessive usage of nitrogen fertilizers. Meanwhile, nitrate can be
naturally attenuated by denitrification in subsurface environments. The
denitrification occurs through biotic (biological) and abiotic processes, and
numerous previous studies preferentially focused the former. However, abiotic
denitrification seems to be significant in specific environments. For this
reason, this study reviewed the previous studies that focused on abiotic
denitrification processes. Firstly, the current status of nitrate contamination
in global and domestic scales is presented, and then the effect of geological
media on denitrification is discussed while emphasizing the significance of
abiotic processes. Finally, the implications of the literature review are
presented, along with future research directions that warrant further
investigations. The results of previous studies demonstrated that several
geological agents could play a vital role in reducing nitrate. Iron-containing
minerals such as pyrite, green rust, magnetite, and dissolved ferrous ion are
known to be powerful electron donors triggering denitrification. In particular,
it was proven that the rate of denitrification by green rust was comparative to
that of biological denitrification. The results indicate that abiotic
denitrification should be taken into account for more accurate evaluation of
denitrification in subsurface environments.
Keywords: Nitrate, Denitrification, Geological media, Aquifer properties, Subsurface environment
지하수 내 질산염 오염은 최근 수십 년 동안 전 세계적으로 발생하는 일반적이면서도 심각한 문제로 대두되고 있다(Shao et
al., 2018; Zhang et al., 2015). 지하수의 질산염 오염은 주로 비료의 과다한 사용(Re et al., 2017;
Tong et al., 2013), 가축 분뇨, 가정 및 산업폐수, 강과 대수층의 상호 작용 등에 의하여 초래된다(Shalev et al.,
2015; Tindall and Chen, 2014). 지중환경 내 집적된 질산염은 주로 음전하를 띄는 토양표면에 흡착되지 않기 때문에 토양 공극수에
의하여 쉽게 이동될 수 있으며, 이를 통하여 지하수에 쉽게 축적된다(Bellini et al., 1996). 질산염으로 오염된 지하수를 식수로
장기간 섭취할 경우 유아는 청색증, 성인은 암을 유발할 수 있기 때문에 세계 보건기구(WHO)는 음용수 내 질산염의 농도를 50 mg/L 이내로
권고해 오고 있다(Koh et al., 2016; WHO, 2016). 최근 지중환경 내 질산염에 대한 연구는 질산염의 생성 및 오염경로를 이해하는
것뿐만 아니라, 질산염의 친환경적인 제거 기술을 개발하는 데 중점을 두고 있다(Warneke et al., 2011).
지중환경 내 질산염을 감소시킬 수 있는 자연적인 과정은 탈질 반응이다. 지중환경 내 질산염의 탈질 반응은 생물학적(biotic) 과정과
비생물학적(abiotic) 과정으로 구분할 수 있으며, 지질 매체 내 광물, 미생물, 조류 등과의 상호 작용으로 인하여 조절될 수 있다(Obiri-Nyarko
et al., 2014). 지중환경 내에서는 대게 생물학적 탈질 반응이 우세하게 일어나지만, 지중환경을 구성하는 지질 매체의 특성에 따라 비생물학적
과정이 중요하게 기여할 수 있다(Jessen et al., 2017). 그렇기 때문에 지중환경 내 질산염의 탈질 반응을 정확하게 예측하기 위해서는
생물학적 과정과 비생물학적 과정에 의한 탈질 반응을 모두 고려한 연구가 수행되어야 한다.
생물학적 탈질 반응은 무기 탄소원 및 황화합물과 같은 전자공여체를 이용한 독립영양 탈질 반응(autotrophic denitrification)과
유기 탄소원을 이용한 종속영양 탈질 반응(hetetrophic denitrification)으로 나눌 수 있으며, 유기 탄소, 용존산소, pH
등의 인자에 의하여 탈질 반응이 조절될 수 있다(Seiler et al., 2005). Van Rijin et al. (1996)은 질산염의 대표적인 탈질 세균 중 하나인 Pseudomonas stutzeri에 의한 질산염의 초기 탈질 반응속도가
가장 빠르게 나타나는 것을 확인하였다.
비생물학적 탈질 반응은 대표적으로 황철석, 용존 2가 철(Fe(II)) 등과 같은 전자공여체에 의하여 일어날 수 있으며, 이외 green rust, 능철석, 자철석 등의 철 (수)산화물, 버네사이트,
하우스먼나이트 등의 망간 산화물 등이 전자공여체 역할을 할 수 있다(Doane, 2017). Jessen et al.(2017)은 황철석에 의한
질산염이 자연 저감되는 것을 확인하였으며, Hansen et al.(2001)은 염화물을 함유한 green rust에 의한 질산염의 비생물학적
탈질이 빠르게 일어나는 것을 확인하였다. 뿐만 아니라, Rakshit et al.(2008)은 능철석에 의한 질산염의 탈질 반응은 일어나지 않지만,
아질산염의 탈질 반응은 빠르게 일어나는 것을 확인하였다.
이러한 선행연구 결과는 지중환경 내 황철석 등과 같은 철 화합물이 풍부한 지역에서는 비생물학적 반응이 활발하게 일어날 수 있음을 지시한다.
그러나, 이렇게 지중환경 내에서는 비생물학적 탈질 반응이 우세하게 일어날 수 있음에도 불구하고, 현재까지는 주로 생물학적 탈질 반응에 집중하여
연구가 수행되어 왔다. 뿐만 아니라, 비생물학적 탈질 반응은 지중환경 내 지질 매체와 대수층의 특성에 따라서 영향을 많이 받음에도 불구하고, 이러한
연구가 부족할 실정이다.
본 논문은 문헌 연구를 통해 지중환경 내 질산염의 탈질 반응에 대하여 현재까지 주로 수행되어온 생물학적 과정에 대하여 간단하게 설명하고,
생물학적 탈질 반응보다 상대적으로 덜 다루어져 온 비생물학적 과정의 중요성을 제시하고자 한다. 세부적으로는 (1) 국내외 질산염 오염현황을 조사하고,
(2) 질산염의 탈질 반응에 대한 지질 매체의 영향을 살펴보며, (3) 비생물학적 탈질 반응의 중요성을 제시하고, (4) 문헌 연구 결과로부터
도출된 시사점과 향후 연구가 필요한 부분에 대하여 제안하고자 한다.
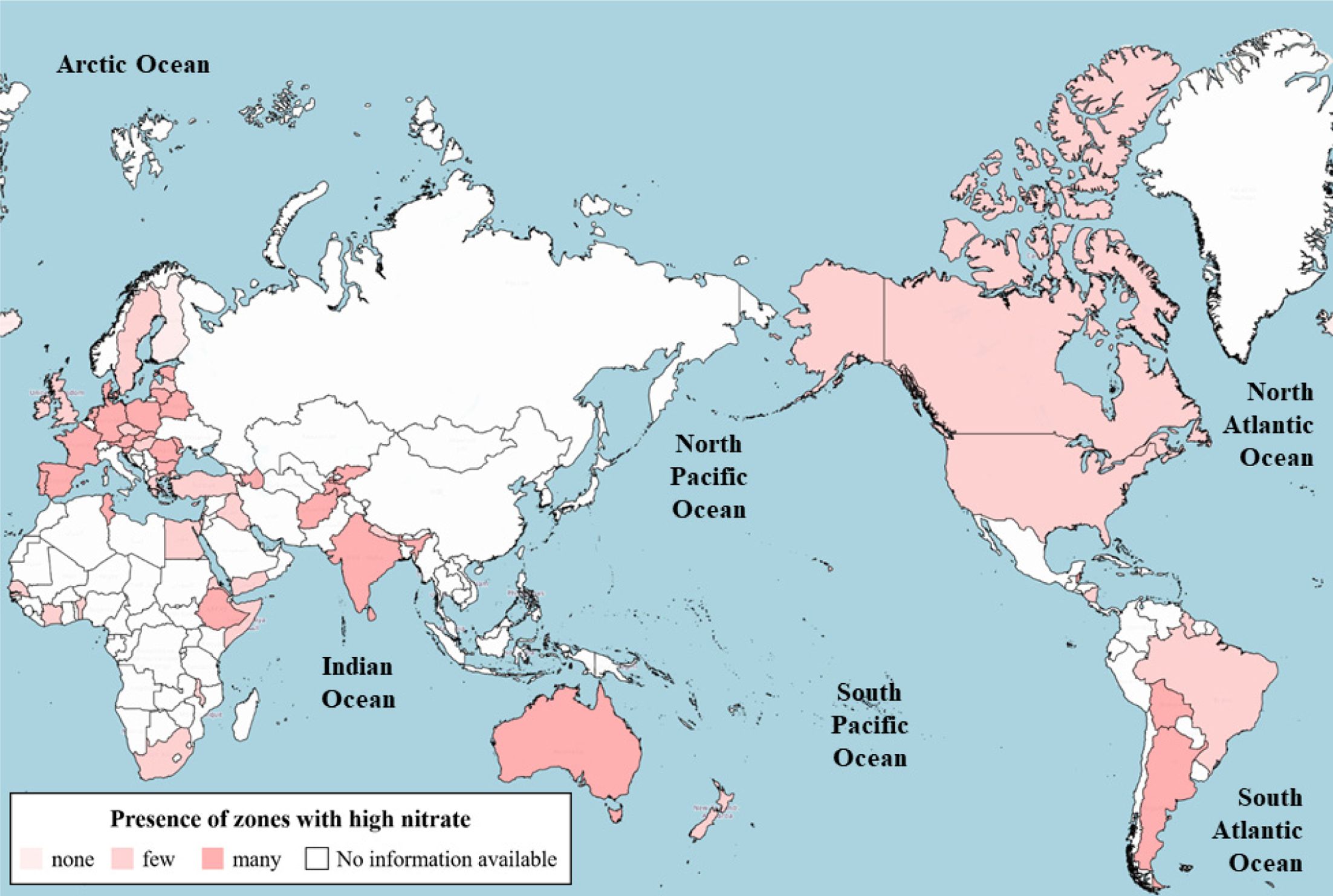
지중환경 내 질소 오염은 앞서 설명한 인위적 및 자연적 원인에 의하여 일어날 수 있다(Lapworth et al., 2017). 전
세계적인 지하수 내 질산염 오염현황을 International Groundwater Resource Assessment Centre
(IGRAC)의 Global ground water information system (GGIS)을 이용하여 살펴보았으며(IGRAC,
2019), 그 결과를 Fig. 1에 나타냈다. 이러한 질산염 오염은 주로 질소 비료의 과다 사용에 의하여 초래된다고 알려져 있다. 질소 비료의
사용량은 캐나다, 미국, 유럽, 인도, 중국에서 약 40-70 Kg/ha으로 나타났다. 그 외의 지역에서도 20-40 Kg/ha의 질소 비료를 사용하는 지역이
빈번히 나타나는 것을 확인하였으며, 질소 비료의 사용량이 높은 지역은 주로 인구의 밀집도가 높은 중위도 지역으로 나타났다(Potter et
al., 2010). 호주는 질산염의 오염도가 높은 편으로 나타났으며, 몇몇 지역에서는 WHO 가이드라인의 50 mg/L 농도보다 높은 농도로 관측되었다(Wilcock
et al., 2011). 미국의 경우에는 전 지역의 지하수를 채취하여 질산염 질소를 EPA에서 규정한 식수 최대 오염 기준(Drinking
Water Maximum Contaminant Levels)과 비교한 결과 1994년부터 2009년까지 최대 오염 기준을 넘은 농도가 증가하였으나,
2009년 이후 질산염 질소의 농도는 줄어들고 있다. 그러나, 2016년 이후에도 미국 서부 및 남부의 경우 규제치보다 높은 농도의 질산염이 나타나고
있다(Pennino et al., 2017). 유럽은 대부분 지역의 대수층에서 질산염의 농도가 WHO 가이드라인인 50 mg/L에 근접한 것으로 나타났으며(Otero et
al., 2009), 모로코의 경우 질산염의 농도가 높게 나타나는 지역의 지하수를 채취한 결과 약 36% 이상이 50 mg/L를 초과하는 것으로 조사되어서 오염원을 확인하기
위한 추가 조사가 필요하다고 보고하였다(Tagma et al., 2009). 아시아 지역은 중국 이외의 많은 지역에서 질소 비료의 사용량이 높음에도
불구하고 지하수 내 질산염 농도는 거의 관측되지 않은 것으로 나타났기 때문에 추가적인 조사가 필요한 실정이다(Ersoy, 2013, Lokesh., 2013).
국내 지하수 내 질산염 오염은 도심지역에서는 매립지, 낡은 하수도, 세탁소, 공장 등에서 배출되는 폐수로 인하여 초래되며,
농업지역에서는 과도한 비료 및 퇴비의 사용과 축산폐수 유출 등에 의하여 발생된다(Yun et al., 2014). 또한, 국내 지하수 질소 부하의
대다수는 농축산업에서 기인하는 것으로 보고되었다(Kim et al., 2019). 각 주요 도심지역에서의 지하수 내 질산염의 농도는 WHO 가이드라인의
50 mg/L 농도보다 낮은
10-25 mg/L 농도를 보였으나, 최대 농도는 50 mg/L를 초과하는 것으로
나타났다. 질산염의 주요 오염지역인 농경 지역의 질산염 농도는 도심지역보다 지하수 내 질산염의 평균 오염농도가 높은 수준(10-40 mg/L)으로 나타났으며,
질산염의 최대 농도는 모든 지역에서 50 mg/L를 초과하는 것으로 나타났다(Cheong et al., 2008; Jeon et al.,
2011; Kim et al., 2009; Kim et al., 2014; Lee and Choi, 2012; Yun et al.,
2017).
|
Fig. 1 The current status of nitrate contamination in groundwater worldwide (source: IGRAC, 2019). A high level of nitrate means more than a few tenths of mg/L. |
지중환경 내에서 질산염 농도를 저감 시킬 수 있는 자연적인 과정은 탈질 반응이다(Torrentó et al., 2010). 질산염의 탈질 반응은 생물학적 및 비생물학적
과정을 통하여 일어날 수 있으며, 질산염이 아질산염, 일산화질소, 아산화질소, 질소 가스의 형태로 환원되는 과정이다(Xu et al.,
2013). 질산염의 생물학적 탈질 반응은 전자공여체로서 유기 탄소 및 무기화합물을 이용하는 미생물에 의한 환원 반응에 의하여 일어나며(Devito
et al., 2000; Pabich et al., 2001), 비생물학적 탈질 반응은 미생물의 관여 없이 질산염과 무기화합물의 지구화학적 반응에
의하여 일어난다(Davidson et al., 2003). 질산염의 탈질 반응은 지질 매체의 다양한 특성에 따라 달라진다. 탈질 반응에 영향을
미치는 주요한 지질 매체 특성은 유기 탄소 농도, 혐기성 조건(용존산소 < 1.2 mg/L), 온도
(25-30oC), 중성의 pH에서 활발하게 일어난다(Robertson and Merkley, 2009; Xu et
al., 2009). Table 1에 제시된 환원력(reducing potential) 세기에서 알 수 있는 바와 같이, 지중환경에서
용존산소의 농도가 낮아지면 질산염이 전자수용체 역할을 할 수 있기 때문에 용존산소의 농도가 상대적으로 낮은 대수층(포화대)에서 불포화대보다 질산염의
환원이 잘 일어난다. 그러나, 지질 매체의 특성에 따라 공극이 큰 대수층이나 산소의 전달(공급)이 잘 일어날 수 있는 대수층에서는 질산염의 탈질
반응이 제어될 수 있다(Rivett et al., 2007). 또한, 질산염의 탈질 반응은 무엇보다도 지질 매체 내 함유된 광물에 의하여 영향을
받는데, 지금부터는 이러한 질산염의 탈질 반응에 관여하는 지질 매체 내 주요한 광물들에 대하여 논하고자 한다.
3.1. 황화광물에 의한 탈질 반응
질산염의 탈질 반응에서 전자공여체로 작용할 수 있는 대표적인 황화광물은 황철석으로서, 환원 환경의 퇴적층, 광산지역 등에서 많이 분포할
수 있다. 이러한 황철석에 의한 질산염의 탈질 반응은 생물학적 및 비생물학적 과정으로 구분될 수 있다(Doane, 2017). 생물학적 탈질 반응은
Pseudomonas stutzeri, Pseudomonas fluorscens, Paracoccus
denitrificans, Thiobacillus denitrificans, Thiosphaera
denitrificans 등과 같은 황화광물을 에너지원으로 이용한 독립영양 탈질이 일어나는 것으로써 탈질 미생물에 의한 초기 반응속도를
Table 2에 제시하였다(Archna et al., 2012; Matocha et al., 2012; Schwientek et al., 2008). 이와는 달리 비생물학적 탈질 반응은 탈질
미생물이 관여하지 않고 황철석과 질산염의 지구화학적 반응에 의하여 질산염의 환원이 일어난다(Yu and Shin, 2018). 황철석의 산화에
의한 질산염의 탈질 반응은 식(1)-(4)와 같은 과정으로 일어날 수 있다(Jessen et al., 2017; Sievert et al.,
2008; Torrentó et al.,
2010; Vaclavkova et al., 2015).
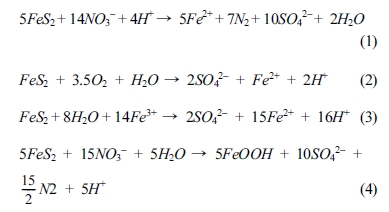
위의 반응과 같이 황철석에 의한 질산염의 탈질 반응 후 철은 2가 이온의 형태로 용해된 후 3가 이온으로 산화되면서 최종적으로 침철석의
형태로 침전될 수 있다. 또한, 위의 일련의 탈질 반응에 의해 수소이온이 다량 생성되기 때문에 지하수의 pH를 감소시킬 수 있다. 이로 인하여
광물상으로 존재하는 중금속이 용출되어 지하수 오염을 일으킬 수 있기 때문에 질산염의 탈질 반응에 의한 이차적인 오염에 대하여도 고려할 필요성이
있다(Bosch et al., 2012).
대수층 내 황철석은 퇴적물 및 기반암에 함유되어 있으며, 황철석의 분포 및 입자 크기는 기반암의 기원, 퇴적물 공극의 크기 등의 지질
매체 특성에 따라 달라진다. Jessen et al.(2017)은 질소 비료 및 퇴비로 인하여 질산염으로 오염된 지역에서 연구 수행 기간부터 질소
공급을 하지 않고 지중환경 내 존재하는 황철석과의 자연 저감에 대한 연구를 수행하였으며, 질산염이 황철석과의 탈질 반응을 통하여 자연 저감되는
것을 확인하였다.
지중환경 내 존재하는 황철석은 지질 매체 특성에 따라 황철석의 함량 및 입자 크기가 다르게 나타난다. 이러한 황철석의 함량 및 입자
크기가 질산염의 탈질 반응에 미치는 영향을 알아보기 위한 연구들이 수행되었다. Torrentó et al.(2010)는 황철석의 입자 크기를 25-50 μm와 100 μm 이상으로 구분하여 비교실험을
수행하였으며, 크기가 증가할 때 동일한 질산염의 농도를 제거하기 위한 시간이 약 4배 이상이 증가하는 것을 확인하였다. 이러한 결과는 황철석의
입자 크기가 증가하면 질산염과 반응할 수 있는 비표면적이 감소되기 때문에 입자 크기가 증가할수록 반응시간이 더 긴 것으로 나타났다. 이와 유사한
연구로 Tong et al.(2018)은 황철석의 투여량 및 입자 크기에 따른 실험을 수행하였으며, 황철석의 입자 크기가 감소할수록, 투여량이
증가할수록 탈질 반응이 증진되는 것을 확인하였다. Singireddy et al.(2012)은 황철석을 이용한 질산염의 탈질 반응에서 온도가 미치는
영향에 대하여 연구하였으며, 온도가 22oC에서 120oC로 증가하였을 때, 암모니아화(ammonification)되는
질산염이 약 9배 증가하는 것으로 나타났다. 이러한 결과는 지중환경 내 열수가 존재할 수 있는 지형에서 질산염의 환원이 더욱 빠르게 진행될 수
있음을 지시한다. 그러나, 이러한 연구들은 황철석과 질산염의 탈질 반응이 생물학적 또는 비생물학적 과정에 의하여 일어나는지를 구분하지 않고 실험하였기
때문에, 황철석의 입자 크기 및 함량, 온도 등의 인자가 어떤 과정에 더 큰 영향을 미치는지에 대하여는 판단할 수 없다. 또한, 질산염의 탈질
반응에 중요한 영향 인자인 pH, DO에 대한 연구는 수행하지 않았기 때문에 실제 지중환경에서 질산염의 탈질 반응을 정확하게 예측하기 위해서는
생물학적 및 비생물학적 과정에 대한 pH, DO의 영향을 파악하기 위한 추가적인 연구가 필요하다.
3.2. 철 (수)산화물에 의한 탈질 반응
지중환경에 존재하는 철 (수)산화물에 함유된 철은 2가 또는 3가 형태로 존재한다. 현재까지 수행된 철 (수)산화물을 이용한 질산염의
탈질 반응에 대한 연구에서는 2가/3가 철 (수)산화물 형태인 green rust, 능철석과 2가/3가 철이 공존하는 자철석 등이 주로 이용되어져
왔으며, 이러한 연구에서는 비생물학적 과정에 의한 탈질 반응이 고려되었다.
Green rust는 3가 철의 환원이 일어날 수 있는 지하수 환경에서 형성될 수 있는 층형의 Fe(II)-Fe(III) 철 (수)산화물이다(Christiansen
et al., 2009). Green rust는 황산염, 탄산염, 염화물을 포함하는 세 가지 유형으로 구분할 수 있으며, 열역학적으로 질산염을
탈질시킬 수 있음이 증명되었다(Hansen, 1989). Hansen et al.(1996)은 황산염을 포함하는 green rust를 이용한 질산염의
환원에 대한 연구를 수행하였으며, 식 (5)와 같은 반응으로 질산염을 환원시킴과 동시에 자철석으로 산화된 것을 확인하였다.
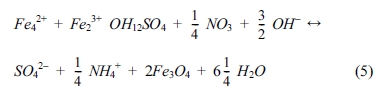
그러나, 질산염이 green rust의 층 사이에 존재하는 황산염과의 전하가가 다르기 때문에 Hansen et al.(2001)은 질산염과
같은 전하가를 가진 층 사이에 염화물을 함유한 green rust를 이용한 연구를 수행하였다. 유사한 조건에서 질산염의 초기 환원반응 속도는 황산염을
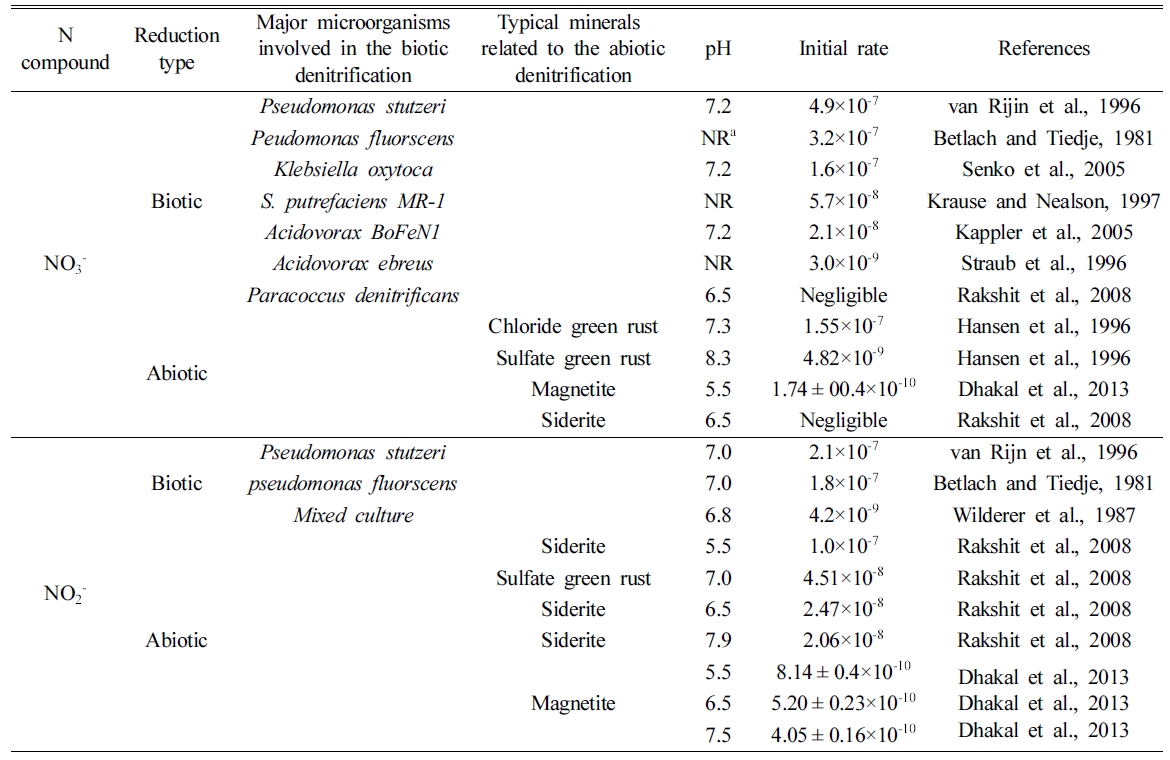
함유한 green rust보다 약 32배 높게 나타난 것을 확인하였으며, 이를 Table 2에 나타냈다. Table 2를 통하여 염화물 형태의
green rust에 의한 질산염의 비생물학적 탈질 반응의 초기 반응속도는 1.55×10-7으로 생물학적 탈질 반응의 초기
반응속도가 가장 빠르게 일어나는 대표적 미생물인 Pseudomonas stutzeri에 의한 4.9×10-7과
차이가 약 3배 정도 나는 것을 확인하였다(Zheng, 2018). 이러한 연구결과는 질산염의 종속영양 탈질을 일으킬 수 있는 미생물이 희박하면서
염화물 형태의 green rust가 풍부한 지역에서는 비생물학적 반응이 우세하게 일어날 수 있다. 따라서 실제 지중환경 내에서 질산염의 탈질 반응을
정확하게 예측하기 위해서는 생물학적 과정뿐만 아니라 비생물학적 과정에 의한 탈질 반응을 함께 고려하여야 한다.
능철석은 2가 철이 산화될 수 있는 혐기성 환경에서 자연적으로 형성 가능한 탄산염 철 광물이다. 능철석 형성을 위한 탄산염은 혐기성
조건에서 미생물의 호흡과 석회질 물질로부터 생성될 수 있다(McMillan and Schwertmann, 1998).
Rakshit et al.(2008)은 능철석을 이용한 질산염의 환원에 대한 연구를 수행하였으며, 연구결과로부터 질산염의 환원이 거의 일어나지
않음을 확인하였다(Table 2, Fig. 2(a)). 그러나, 아질산염의 경우 능철석에 의한 환원 반응이 빠르게 일어나는 것으로 나타났으며,
Fig. 2(b)에 나타낸 것과 같이 낮은 pH에서 반응이 빠르게 일어나는 것을 확인하였다. 이렇게 능철석에 의한 질산염과 아질산염의 환원 반응이 차이가
나는 이유는 두 질소 종의 N-O 결합 특성에 기인하는 것으로, 질산염은 능철석과 표면결합(surface complexation)이 발생하지
않아서, 능철석의 탄산기(CO32-)와의 전기적 척력에 의하여 전자를 수용하여 환원 반응이 일어날 정도로
충분히 근접하지 못하지만, 아질산염은 능철석과 표면결합이 가능하여 전자 교환에 의한 환원 반응이 일어나기 때문이다(Matocha
et al., 2012). Table 2에 제시된 아질산염의 생물학적 탈질 반응의 초기 반응속도가 가장 빠르게 일어나는 대표적 미생물인 Pseudomonas
stutzeri에 의한 2.1×10-7로서 pH 5.5에서 능철석에 의한 비생물학적 탈질 반응 초기 반응속도 1.0×10-7와
약 2배의 차이가 나는 것을 확인하였다. 이는 green rust와 마찬가지로 능철석이 풍부하게 나타날 수 있는 지질 매체에서는 질산염의 비생물학적
탈질 반응이 생물학적 탈질 반응과 비슷하게 일어날 수 있기 때문에, 질산염의 탈질 반응의 정확한 예측을 위해서는 생물학적 및 비생물학적 탈질 반응을
함께 고려하여야 한다.
자철석은 자연환경에서 Fe2+/Fe3+이 혼합된 대표적인 철 산화광물이다(Saheb et
al., 2010). Dhakal et al.(2013)은 자철석을 이용한 질산염 및 아질산염의 비생물학적 탈질 반응에 대한 연구를 수행하였으며,
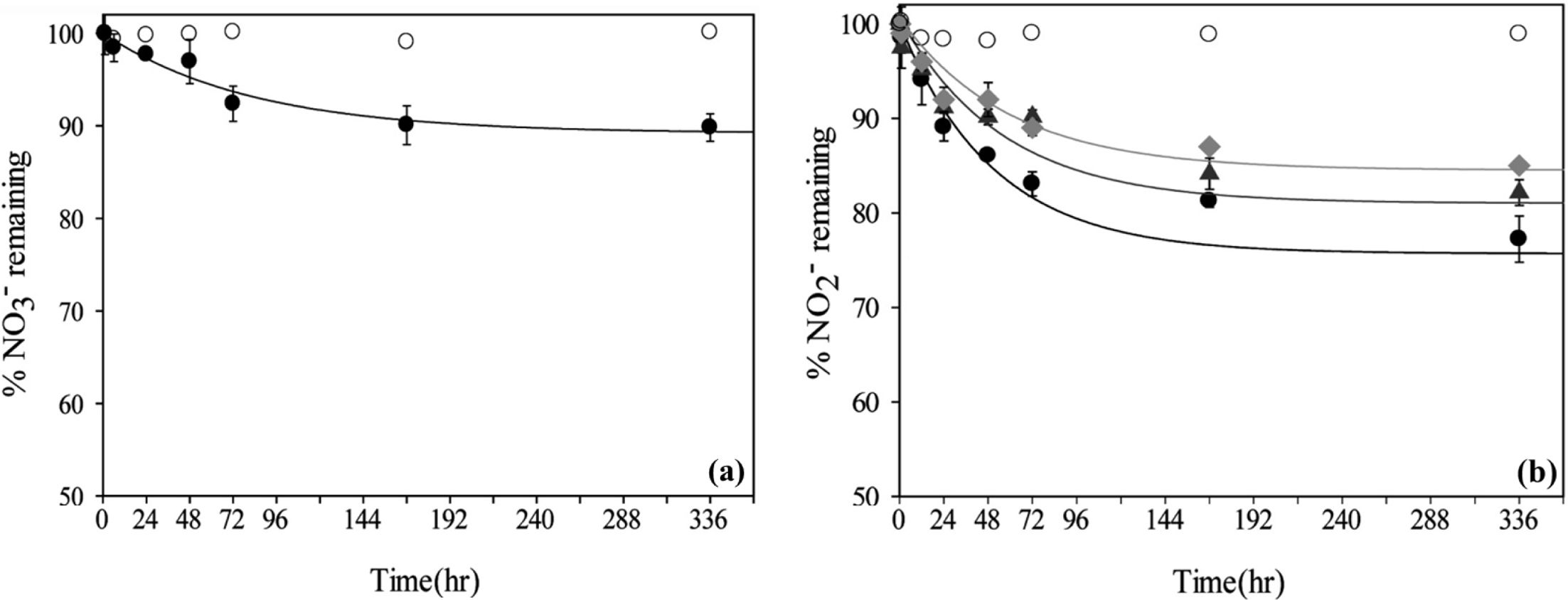
비생물학적 탈질 반응이 일어날 수 있음을 제시하였는데, 그 연구 결과를 Table 2와 Fig. 3에 나타냈다. 자철석에 의한 질산염의 비생물학적
탈질 반응은 낮은 pH에서 반응이 빠르게 일어나는 것으로 나타났다. Table 2에 제시된 염화물 형태의 green rust와의 초기 반응속도
비교 시, 약 900배 느린 초기 반응속도를 가지는 것으로 나타났다. 자철석을 이용한 pH 5.5에서 질산염의 탈질 반응은 Fig. 3(a)에서
보는 바와 같이 약 10%의 탈질율을 보이는 것으로 나타났다. 그러나, green rust와 자철석을 이용한 질산염의 탈질 반응은 서로 다른
pH에서 관찰된 결과로서, green rust를 이용한 질산염의 탈질 반응은 pH 7.3에서만 수행되었으며, 자철석을 이용한 질산염의 탈질 반응은
pH 5.5 이상에서 관측되지 않았기 때문에, 같은 pH 조건에서 정확한 질산염의 초기 탈질 반응속도를 비교하지 못하였다. 아질산염의 탈질 반응에
대한 능철석과 같은 pH 5.5에서 초기 반응속도를 비교하면, 약 123배 느린 것으로 나타났다. 그러나, 자철석은 지중환경
내 풍부한 철 산화 광물이기 때문에 실제 지중환경에서 비생물학적 탈질 반응에 보다 많은 영향을 미칠 것으로 생각된다.
3.3. 용존 2가 철에
의한 탈질 반응
지중환경 내 용존 2가 철(Fe2+)을 함유한 지하수에서는 질산염이 거의 존재하지 않는다고 보고되었는데(Ernstsen,
1996; Rivett et al., 2008), 이는 용존 철에 의한 질산염의 탈질 반응이 가능하다는 것을 간접적으로 지시한다. 지중환경 내
2가 철은 황화철의 산화 및 흑운모, 휘석, 각섬석과 같은 규산염 광물이 용해되어 생성될 수 있다(Korom., 1992). 이러한 2가 철에
의한 질산염의 독립영양 탈질 반응은 Gallionella ferruginea 또는 Ferrovibrio
denitrificans와 같은 혐기성 탈질 세균이 2가 철을 산화시키기 때문에 촉진될 수 있다(Ashok and Hait,
2015). 2가 철에 의한 질산염의 환원은 비생물학적 과정에 의하여 일어날 수 있으나, 이러한 탈질 반응을 생물학적 또는 비생물학적 과정으로
구분하여 연구한 바는 없다.
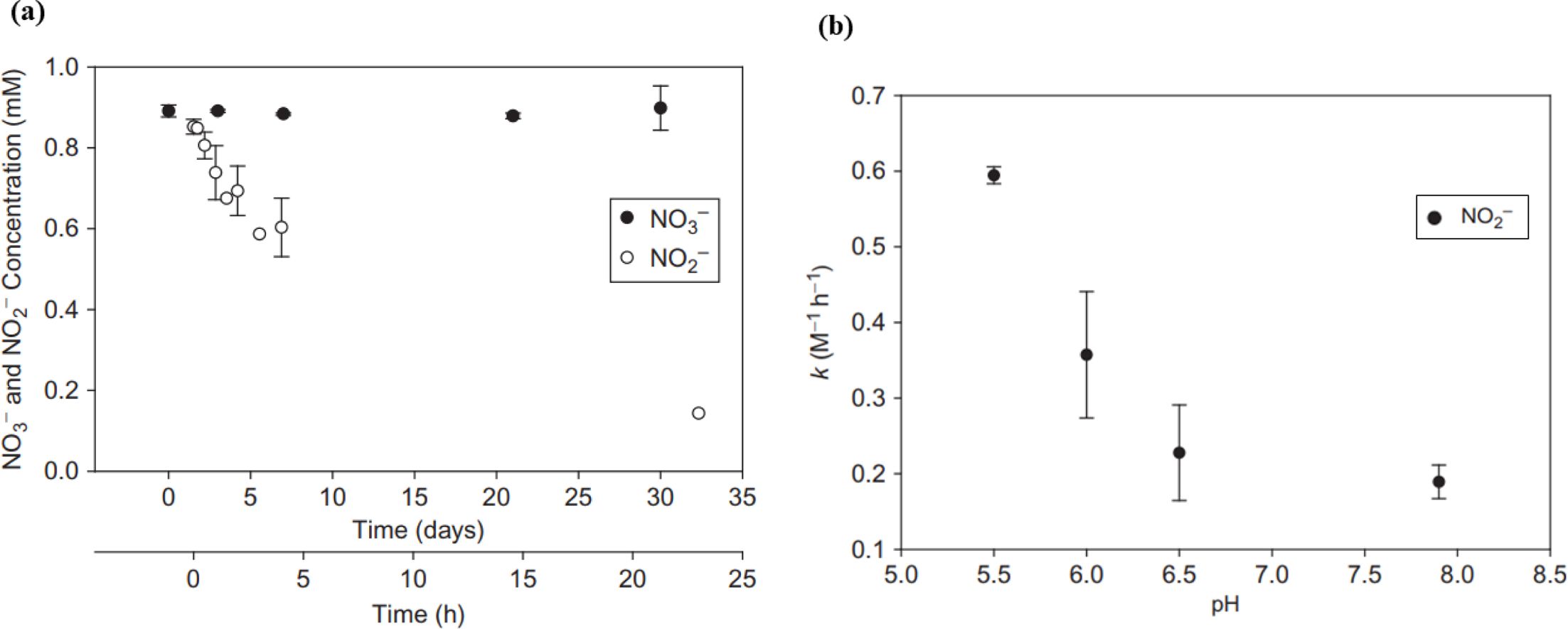
2가 철을 전자공여체로 이용한 탈질 반응은 식 (6)-(10)과 같은 과정으로 일어날 수 있으며, 이러한 과정은 생물학적 및 비생물학적
탈질 반응에 동일하게 적용할 수 있다(Boisson et al., 2013; Ottley et al., 1997; Rivett et al.,
2008; Torrentó et al.,
2011).
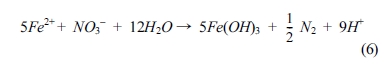
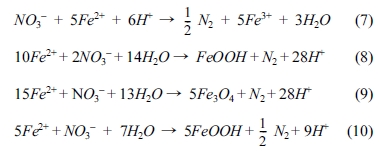
2가 철에 의한 질산염의 탈질 반응 후 2가 철은 일반적인 환경에서 비결정질의 페리하이드라이트를 생성할 수 있으며(식 6), 2가 철의
산화 속도가 느리게 일어나는 조건에서는 침철석을 형성할 수 있다(식 8, 10). 또한, 식 (9)와 같이 2가 철과 3가 철이 함께 존재하는
자철석의 형태로 침전될 수 있는데, 이는 자철석으로 바로 침전되는 것이 아닌 2가 철이 탄산염 형태의 green rust로 산화된 다음 질산염과의
반응 후 자철석으로 산화되는 것으로 나타났다.
앞서 언급했듯이, 2가 철에 의한 질산염의 탈질 반응은 동일한 과정으로 생물학적 또는 비생물학적으로 발생할 수 있다. 지중환경에서
2가 철에 의한 질산염의 탈질 반응을 정확하게 예측하기 위해서는 생물학적, 비생물학적 과정에 대한 정량적인 연구가 필요하고 지중환경에서 다양하게
변하는 pH, DO, 2가 철의 농도 등과 같은 영향 인자에 따른 초기 반응속도를 조사할 필요가 있다.
3.4. 대수층의 특성이 탈질 반응에 미치는 영향
지중환경 내 탈질 반응은 지하수 유동에 영향을 미치는 지질 매체 특성인 투수 계수, 수리전도도에 의하여 반응시간이 조절될 수 있다.
An et al.(2010)은 수리전도도의 변화에 따른 질산염의 생물학적 탈질 반응을 자연 토양을 이용하여 평가하였으며, 수리전도도가 감소하면
반응시간 및 체류 시간이 증가하여 탈질 반응이 증가하는 것을 확인하였다.
생물학적 탈질 반응에서 중요한 인자인 미생물 개체수는 공극의 크기에 비례하여 증가한다(Tecon and Or, 2017). 이러한 지질
매체 특성은 위에서 언급한 바와 같이 수리전도도가 감소되면 탈질 반응이 증가 될 수 있으나, 미생물 개체수 감소로 인한 생물학적 탈질 반응 감소를
일으킬 수 있다. 그러나, 이러한 영향들 중 어떠한 것이 더욱 영향을 크게 미치는지에 대한 연구는 수행되지 않았다. 또한, 지중환경 내 전자공여체
및 용존 산소의 농도는 미생물의 성장 속도에 영향을 미칠 수 있기 때문에 실제 지중환경에서 질산염의 탈질 반응을 정확하게 예측하기 위해서는 이러한
지질 매체의 다양한 특성이 탈질 반응에 미치는 영향을 보다 더 정량적으로 평가할 수 있는 연구가 필요한 실정이다.
지중환경 내 질산염의 탈질 반응을 예측하기 위한 모델식에는 밀도, 공극률, 공극수 흐름속도, 유량, 오염물질과 지질 매체와의 흡착 상수
및 반응 속도 상수 등과 같은 다양한 지질 매체의 특성들이 포함되어 있다(Noori et al., 2018). 기존에 수행된 많은 연구들에서는
미생물이 관여한 생물학적 과정에 의한 탈질 반응 속도 상수만을 이용하고 있다. 그러나, 실제 지중환경 내 질산염의 탈질 반응은 비생물학적 과정으로도
일어날 수 있기 때문에 앞서 제시한 비생물학적 과정에서 전자공여체로서 작용할 수 있는 다양한 매질에 대한 연구가 필요하다. 뿐만 아니라, 지중환경
내 탈질 반응의 정확한 예측을 위해서는 무엇보다도 그러한 비생물학적 과정에 의한 탈질 반응의 평형론적, 반응속도론적 정량화가 필수적이라고 생각된다.
|
Fig. 2 Time series of nitrate and nitrite reactivity with siderite (a). The initial nitrate and nitrite concentrations are 0.9 mM and the siderite concentration is 10 g/L. The x-axis for nitrate is days and nitrite is hours. Second order rate coefficients as a function of pH derived from kinetic studies of nitrite with siderite (b) (data from Rakshit et al., 2008; Matocha et al., 2012). |
|
Fig. 3 Removal of (a) NO33− (at pH 5.5), and (b) NO2− from solution by magnetite at pH 5.5 (●), 6.5 (gray ▲), and 7.5 (light gray ◆)). Open circles in (a) and (b) represent blank samples (without magnetite) at pH 5.5. (data from Dhakal et al., 2013). |
|
Table 1 Standard reduction potentials (E0h) of naturally occurring terminal electron accepting systems calculated for pH 7.0 (adapted from Matocha et al., 2012) |

지중환경 내 질산염의 탈질 반응에 대한 최근 연구는 생물학적 과정이 비생물학적 과정보다 우세하게 일어나기 때문에 비생물학적 탈질 반응을
고려하지 않은 연구가 수행되어왔다. 그러나, 질산염의 오염이 심각해지면서 질산염에 대한 최근 연구들이 생물학적 탈질 반응 외에 지질 매체 특성에
따른 비생물학적 탈질 반응이 충분히 일어날 수 있음을 앞서 언급하였다. Jessen et al.(2017)은 황철석에 의한 질산염의 자연 저감이
일어날 수 있음을 제시하였으며, Summers et al.(2012)은 황철석에 의한 일산화질소의 비생물학적 환원 반응을 통하여 암모니아화가 일어날
수 있음을 제시하였다. 또한, Schwientek et al.(2008)은
규산염 광물 내 2가 철에 의한 비생물학적 탈질 반응에 대한 연구 결과를 보고하였다. 뿐만 아니라, Hansen et al.(1996)은
green rust에 의한 비생물학적 탈질 반응이 생물학적 탈질 반응과 비교하여 약 3배의 차이밖에 나지 않음을 입증하였으며, 지중환경 내 다른
환원 물질인 크롬(Bond and Fendorf, 2003), 우라늄(O’Loughlin et al., 2003a), 수은(O’Loughlin
et al., 2003b) 등이 존재하면 탈질 반응이 증진되는 연구 결과가 보고되었다. Moraghan and
Buresh(1977)은 용존 2가 철에 의한 질산염의 비생물학적 탈질 반응이 일어남을 확인하였으며, 높은 pH, Cu2+와
같은 촉매작용을 할 수 있는 이온이 있을 때, 비생물학적 반응이 더욱 촉진되는 것을 입증하였다. 또한, Petersen(1979)은 용존 2가
철에 의한 질산염의 비생물학적 탈질 반응이 pH가 증가함에 따라 탈질 반응속도가 증가하는 것을 입증하였으며, Tai and
Dempsey(2009)은 비정질의 3가 철 (수)산화물이 같이 존재할 때, 탈질 반응이 증진되는 것을 확인하였다. Dhakal et
al.(2013)은 지중환경 내 풍부한 자철석이 질산염 및 아질산염의 탈질 반응을 일으킬 수 있음을 보고하였다.
이러한 자연상에서 발생되는 비생물학적 탈질 반응의 원리는 질산염 지하수 정화 기술로도 활용되고 있다. Xu et al.(2012)은
0가 철에 의한 질산염의 비생물학적 탈질 공정이 일어나는 것을 확인하였으며, 질산염 50 mg/L의 농도로 오염된
지하수 내 10 g/L의 0가 철이 존재하였을 때, 20%의 질산염이 제거되는 것을 입증하였다. 뿐만 아니라,
용존 2가 철과 철 산화물을 각각 50 mg/L 농도 투여하였을 때, 질산염의 제거율은 97%로 증진되는
것을 확인하였다. 또한, Ren et al.(2016)은 0가 철에 의한 질산염의 비생물학적 탈질 공정에서 2가 철 및 2가 구리를 투여하였을
때, 탈질 반응이 활성화되는 것을 확인하였으며, 질산염 50 mg/L의 농도로 오염된
지하수 내 0가 철과 용존 2가 철 및 구리를 60 g/L 농도 투여하였을 때,
질산염이 99% 제거되는 것을 입증하였다. Wu et al. (2015)은 아질산염으로
오염된 지하수에 철 (수)산화물을 이용한 비생물학적 탈질 공정을 이용하여 아질산염을 제거하였으며, Lu et al.(2016)은 아질산염
50 mg/L의 농도로 오염된 농업지역 폐수를 탄산염 형태의 green rust를 이용하여 97.1%의 아질산염을 제거하였다.
이러한 선행 연구들은 황철석, 철 (수)산화물, 2가 철 등이 풍부한 지중환경에서는 비생물학적 과정에 의한 탈질 반응이 질산염의 자연
저감 기작으로서 충분히 고려되어야 한다는 것을 시사한다. 하지만 이와 관련된 연구는 아직까지 매우 부족한 실정이다. 따라서 질산염의 비생물학적
자연 저감에 대한 정량적인 평가를 위한 노력들이 요구된다.
지중환경 내 질산염의 탈질 반응에 대한 많은 연구들이 수행되어 왔지만 대다수의 연구가 생물학적 과정에만 초점을 맞췄으며, 상대적으로
비생물학적 탈질 반응에 대한 연구는 매우 부족하다고 할 수 있다. 하지만, 지금까지 수행된 몇몇 연구들에 의하여 황화광물, 철 (수)산화물,
2가 철에 의한 비생물학적 탈질 반응이 지중환경 내에서 충분히 가능하다는 것이 입증되었으며, 특히 염화물 형태의 green rust에 의한 비생물학적
탈질 반응속도는 생물학적 탈질 반응속도와 크게 차이가 나지 않는 것이 확인되었다. 그러나 비생물학적 탈질
반응에 대한 정량적인 평가를 위한 연구는 매우 부족한 실정이며, 향후 지중환경 내 존재하는 황화광물, 철 (수)산화물 등과 같은 다양한 지질 매질에
의한 질산염의 비생물학적 탈질 반응에 대한 추가적인 연구가 필요하다. 또한, 이러한 지질 매질에 의한 질산염의 탈질 반응 결과로서 다량의 수소이온이
생성될 수 있기 때문에 이로 인한 2차적인 지하수 오염 등과 같은 수질 악화 문제에 대해서도 평가하는 연구가 필요하다.
본 연구는 환경부의 재원으로 한국환경산업기술원의 지중환경오염·위해관리기술개발사업의 지원을 받아 수행되었습니다(과제번호:
2018002440002).
- 1. Alefounder, P.R., Greenfield, A.J., McCarthy, J.E.G., and Ferguson, S.J., 1983, Selection and organization of denitrifying electron transfer pathways in paracoccus denitrificans, Biochim. Biophys. Acta., 724(1), 20-39.
-

- 2. An, S.W., Murray, C., and Park, J.W., 2010, Effect of various hydraulic conductivities for natural denitrification, Proceeding of Ko-rean Geo-Environmental Society Fall Conference, Koean Geo-Environmental Society., Seoul, Koera, 583-587.
- 3. Archna, A., Sharma, K.S., and Sobti, R.C., 2012, Nitrate removal from ground water: a review, E-J. Chem., 9(4), 1667-1675.
- 4. Ashok, V. and Hait, S., 2015, Remediation of nitrate-contaminated water by solid-phase denitrification process-a review, Environ. Sci. Pollut. Res., 22(11), 8075-8093.
-

- 5. Betlach, M.R. and Tiedje, J.M., 1981, Kinetic explanation for accumulation of nitrite, nitric oxide, and nitrous oxide during bacterial denitrification, Appl. Environ. Microbiol., 42(6), 1074-1084.
-

- 6. Bellini, G., Sumner, M.E., Radcliffe, D.E., and Qafoku, N.P., 1996, Anion transport through columns of highly weathered acid soil: Adsorption and retardation, Soil Sci. Soc. Am. J., 60(1), 132-137.
-

- 7. Boisson, A., Anna, P.d., Bour, O., Borgne, T.L., Labasque, T., and Aquilina, L., 2013, Reaction chain modeling of denitrification reactions during a push-pull test, J. Contam. Hydrol., 148, 1-11.
-

- 8. Bond, D.L. and Fendorf, S., 2003, Kinetics and structural constraints of chromate reduction by green rusts, Environ. Sci. Technol., 37(12), 2750-2757.
-

- 9. Bosch, J., Lee, K.Y., Jordan, G., Kim, K.W., and Meckenstock, R.U., 2012, Anaerobic, nitrate-dependent oxidation of pyrite nanopar-ticles by thiobacillus denitrificans, Environ. Sci. Technol., 46(4), 2095-2101.
-

- 10. Cheong, B.K., Chae, G.T., Koh, D.C., Ko, K.S., and Koo, M.H., 2008, A study of improvement for the prediction of groundwater pollution in rural area: application in keumsan, Korean J. Soil. Groundw. Environ., 13(4), 40-53.
- 11. Christiansen, B.C., Balic-Zunic, T., Dideriksen, K., and Stipp, S.L.S., 2009, Identification of green rust in groundwater, Environ. Sci. Technol., 43(10), 3436-3441.
-

- 12. Davidson, E.A., Chorover, J., and Dail, D.B., 2003, A mechanism of abiotic immobilization of nitrate in forest ecosystems: the fer-rous wheel hypothesis, Glob. Change biol., 9(2), 228-236.
-

- 13. Devito, K.J., Fitzgerald, D., Hill, A.R., and Aravena, R., 2000, Nitrate dynamics in relation to lithology and hydrologic flow path in a river riparian zone, J. Environ. Qual., 29(4), 1075-1084.
-

- 14. Dhakal, P., Matocha, C.J., Huggins, F.E., and Vandiviere, M.M., 2013, Nitrite reactivity with magnetite, Environ. Sci. Technol., 47(12), 6206-6213.
-

- 15. Doane, T.A., 2017, The Abiotic Nitrogen Cycle. ACS Earth Space Chem., 1(7), 411-421.
-

- 16. Ernstsen, V., 1996, Reduction of nitrate by Fe2+ in clay minerals, Clays Clay Miner., 44(5), 599-608.
-

- 17. Ersoy, A.F. and Gultekin, F., 2013, DRASTIC-based methodology for assessing groundwater vulnerability in the Gumushacikoy and Merzifon basin, Earth Science Research Journal, 17(1), 33-40.
- 18. Hansen, H.C.B., 1989, Composition, stabilization, and light absorption of Fe(II)Fe(III) hydroxy-carbonate (¡°green rust¡±), Clay Miner., 24(4), 663-669.
-

- 19. Hansen, H.C.B., Guldberg, S., Erbs, M., and Koch, C.B., 2001, Kinetics of nitrate reduction by green rusts-Effects of interlayer anion and Fe(II):Fe(III) ratio, Appl. Clay Sci., 18(1-2), 81-91.
-

- 20. Hansen, H.C.B., Koch, C.B., Nancke-Krogh, H., Borggaard, O.K., and Srensen, J., 1996, Abiotic nitrate reduction to ammonium: Key role of green rust, Environ. Sci. Technol., 30(6), 2053-2056.
-

- 21. IGRAC., 2019, Global groundwater information system. Retrieved from International Groundwater Resources Assessment Centre, https://apps.geodan.nl/igrac/ggis-viewer /viewer/go/public/default ¡æ Groundwater quality ¡æ Presence of zones with high nitrate.
- 22. Jeon, S.R., Park, S.J., Kim, H.S., Jung, S.K., Lee, Y.U., and Chung, J.I., 2011, Hydrogeochemical chracteristics and estimation of nitrate contamination sources of groundwater in the sunchang area, J. Geol. Soc. Korea, 47(2), 185-197.
-

- 23. Jessen, S., Postma, D., Thorling, L., Müller, S., Leskelä, J., and Engesgaard, P., 2017, Decadal variations in groundwater quality: A legacy from nitrate leaching and denitrification by pyrite in a sandy aquifer, Water Resour. Res., 53(1), 184-198.
-

- 24. Kappler, A., Schink, B., and Newman, D.K., 2005, Fe(III) mineral formation and cell encrustation by the nitrate-dependent Fe(II)-oxidizer strain BoFeN1, Geobiology, 3(4), 235-245.
-

- 25. Kim, H.J., Kim, N.H., Lee, J.H., and Jang, S., 2009, Characteristics of groundwater contamination caused by seawater intrusion and agricultural activity in sachen and hadong area, republic of Korea, Econ. Environ. Geol., 42(6), 575-589.
- 26. Kim, H.K., Park, S.H., Kim, M.S., Kim, H.J., Lee, M.K., Lee, G.M., Kim, S.H., Yang, J,H., and Kim, T.S., 2014, Contamination characteristics of agricultural groundwater around livestock burial areas in Korea, J. Eng. Geol., 24(2), 237-246.
-

- 27. Kim, H.K., Kim, K.H., Yun, S.T., Oh, J.S., Kim, H.R., Park, S.H., Kim, M.S., and Kim, T.S., 2019, Probabilistic assessment of po-tential leachate leakage from livestock mortality burial pits: a supervised classification approach using a gaussian mixture model (GMM) fitted to a groundwater quality monitoring dataset, Process. Saf. Environ. Prot., 129, 326-338.
-

- 28. Koh, E.H., Lee, E.H., and Lee, K.K., 2016, Impact of leaky wells on nitrate cross-contamination in a layered aquifer system: Method-ology for and demonstration of quantitative assessment and prediction, J. Hydrol., 541, 1133-1144.
-

- 29. Korom, S.F., 1992, Natural denitrification in the saturated zone: a review, Water Resour. Res., 28(6), 1657-1668.
-

- 30. Krause, B. and Nealson, K.H., 1997, Physiology and enzymology involved in denitrification by shewanella putrefaciens, Appl. Envi-ron. Microbiol., 63(7), 2613-2618.
-

- 31. Lapworth, D.J., Krishan, G., MacDonald, A.M., and Rao, M.S., 2017, Groundwater quality in the alluvial aquifer system of north-west India: new evidence of the extent of anthropogenic and geogenic contamination, Sci. Total Environ., 599-600, 1433-1444.
-

- 32. Lee, I.G. and Choi, S.H., 2012, Hydro-geochemical nature and nitrates contamination characters of groundwater in the youngdong, chungbuk province, Econ. Environ. Geol., 45(1), 23-30.
-

- 33. Lokesh, K., 2013, A study of nitrate contamination in groundwater of delhi, India, Asian. J. Water Envion. Pollut., 10(2), 91-94.
- 34. Lu, Y., Yang, X., Wu, Z., Xu, L., Xu, Y., and Qian, G., 2016, A novel control strategy for N2O formation by adjusting Eh in ni-trite/(FeII-III) carbonate green rust system, Chem. Eng. J., 304, 579-586.
-

- 35. Matocha, C.J., Dhakal, P., and Pyzola, S.M., 2012, The role of abiotic and coupled biotic/abiotic mineral controlled redox processes in nitrate reduction, Adv. Agronomy., 115, 181-214.
-

- 36. McMillan, S.G. and Schwertmann, U., 1998, Morphological and genetic relations between siderite, calcite, and goethite in a Low Moor Peat from southern Germany, Eur. J. Soil Sci., 49(2), 283-293.
-

- 37. Moraghan, J.T. and Buresh, R.J., 1977, Chemical reduction of nitrite and nitrous oxide by ferrous iron, Soil Sci. Soc. Am. J., 41(1), 47-50.
-

- 38. Noori, R., Dodangeh, M., Berndtsson, R., Hooshyaripor, F., Adamowski, J.F., Javadi, S., and Baghvand, A., 2018, A novel model for simulation of nitrate in aquifers, Hydrol. Earth Syst. Sci. Discuss., https://doi.org/10.5194/hess-2018-222.
-

- 39. Obiri-Nyarko, F., Grajales-Mesa, S.J., and Malina, G., 2014, An overview of permeable reactive barriers for in situ sustainable groundwater remediation, Chemosphere, 111(2), 243-259.
-

- 40. O¡¯Loughlin, E.J., Kelly, S.D., Cook, R.E., Csencsits, R., and Kemner, K. M., 2003a, Reduction of uranium(VI) by mixed iron(II)/iron(III) hydroxide(greenrust): Formation of UO2 nanoparticles, Environ. Sci. Technol., 37(4), 721-727.
-

- 41. O¡¯Loughlin, E.J., Kelly, S.D., Kemner, K.M., Csencsits, R., and Cook, R.E., 2003b. Reduction of Ag(I), Au(III), Cu(II), and Hg(II) by Fe(II)/Fe(III) hydroxysulfate green rust, Chemosphere, 53(5), 437-446.
-

- 42. Otero, N., Torrento, C.A., Soler, A., Mencio, A., and Mas-Pla, J., 2009, Monitoring groundwater nitrate attenuation in a regional system coupling hydrogeology with multi-isotopic methods: the case of Plana de Vic, Agric. Ecosyst. Environ., 133(1-2), 103-113.
-

- 43. Ottley, C.J., Davison, W., and Edmunds, W.M., 1997, Chemical catalysis of nitrate reduction by iron (II), Geochim. Cosmochim. Acta, 61(9), 1819-1828.
-

- 44. Pabich, W.J., Valiela, I., and Hemond, H.F., 2001, Relationship between DOC concentration and vadose zone thickness and depth below water table in groundwater of Cape Cod, USA, Biogeochemistry, 55(3), 247-268.
-

- 45. Pennino, M.J., Compton, J.E., and Leibowitz, S.G., 2017, Trends in drinking water nitrate violations across the united states, Environ. Sci. Technol., 51(22), 13450-13460.
-

- 46. Petersen, H.J.S., 1979, Reduction of nitrate by iron(II), Acta Chem. Scand., 33, 795-796.
-

- 47. Potter, P., Ramankutty, N., Bennett, E.M., and Donner, S.D., 2010, Characterizing the spatial patterns of global fertilizer application and manure production, Earth Interact., 14(2), 1-22.
-

- 48. Rakshit, S., Matocha, C.J., and Coyne, M.S., 2008, Nitrite reduction by siderite, Soil Sci. Soc. Am. J., 72(4), 1070-1077.
-

- 49. Re, V., Sacchi, E., Kammoun, S., Tringali, C., Zouari, K., and Daniele, S., 2017, Intergrated socio-hydrogeological approach to tackle nitrate contamination in groundwater resources. The chase of Grombalia Basin(Tunisia), Sci. Total Environ., 593, 664-676.
-

- 50. Ren, Y., Zhou, J., Lai, B., Tang, W., and Zeng, Y., 2016, Fe0 and Fe0 fully covered with Cu0(Fe0+Fe/Cu) in fixed bed reactor for nitrate removal, Rsc, Adv., 6(110), 108229-108239.
-

- 51. Rivett, M.O., Smith, J.W.N., Buss, S.R., and Morgan, P., 2007, Nitrate occurrence and attenuation in the major aquifers of England and Wales, Qutater. J. Eng. Geol. Hydrogeol., 40(4), 335-352.
-

- 52. Rivett, M.O., Buss, S.R., Morgan, P., Smith, J.W., and Bemment, C.D., 2008, Nitrate attenuation in groundwater: a review of bioge-ochemical controlling processes, Water Res., 42(16), 4215-4232.
-

- 53. Robertson, W.D., and Merkley, L.C., 2009, In-stream bioreactor for agricultural nitrate treatment, J. Environ. Qual., 38(1), 230-237.
-

- 54. Saheb, M., Descotes, M., Neff, D., Matthiesen, H., Michelin, A., and Dillmann, P., 2010, Iron corrosion in an anoxic soil: compari-son between thermodynamic modelling and ferrous archaeological artefacts characterised along with the local in situ geochemical con-ditions, Appl. Geochem., 25(12), 1937-1948
-

- 55. Schwientek, M., Einsiedl, F., Stichler, W., Stögbauer, A., Strauss., H., and Maloszewski, P., 2008, Evidence for denitrification regu-lated by pyrite oxidation in a heterogeneous porous groundwater system, Chem. Geol., 255(1-2), 60-67.
-

- 56. Seiler, K.-P., and Vomberg, I., 2005, Denitrification in a karst aquifer with matrix porosity. In: Razowska-Jaworek, L., Sadurski, A. (Eds.), Nitrates in Groundwater, International Association of Hydrogeologists, Selected Papers 5, Balkema, Leiden.
- 57. Senko, J.M., Dewers, T.A., and Krumholz, L.R., 2005, Effect of oxidation rate and Fe(II) state on microbial nitrate-dependent Fe(III) mineral formation, Appl. Environ. Microbiol., 71(11), 7172-7177.
-

- 58. Shalev, N., Burg, A., Gavrieli, I., and Lazar, B., 2015, Nitrate contamination sources in aquifers underlying cultivated fields in an arid region - the arava valley, israel, Appl. Geochem., 63, 322-332.
-

- 59. Shao, P., Tian, J., Yang, F., Duan, X., Gao, S., Shi, W., Luo, X., Cui, F., Luo, S., and Wang, S., 2018, Identification and regulation of active sites on nanodianonds: Establishing a highly efficient catalytic system for oxidation of organic contaminants, Adv. Funct. Mater., 28(13), 1705295.
-

- 60. Sievert, S.M., Scott, K.M., Klotz, M.G., Chain, P.S., Hauser, L.J., Hemp, J., Hügler, M., Land, M., Lapidus, A., Larimer, F.W., Lu-cas, S., Malfatti, S.A., Meyer, F., Paulsen, I.T., Ren, Q., and Simon, J., 2008, Genome of the epsilonproteobacterial chemolithoauto-troph Sulfurimonas denitrificans, Appl. Environ. Microbiol., 74(4), 1145-1156.
-

- 61. Singireddy, S., Gordon, A.D., Smirnov, A., Vance, M.A., Schoonen, M.A.A., Szilagyi, R.K., and Strongin, D.R., 2012, Reduction of nitrite and nitrate to ammonium on pyrite, Orig. Life Evol. Biosph., 42(4), 275-294.
-

- 62. Straub, K.L., Benz, M., Schink, B., and Widdel, F., 1996, Anaerobic, nitrate-dependent microbial oxidation of ferrous iron, Appl. Environ. Microbiol., 62(4), 1458-1460.
-

- 63. Summers, D.P., Basa, R.C.B., Khare, B., and Rodoni, D., 2012, Abiotic nitrogen fixation on terrestrial planets: Reduction of NO to ammonia by FeS, Astrobiology., 12(2), 107-114.
-

- 64. Tagma, T., Hsissou, Y., Bouchaou, L., Bouragba, L., and Boutaleb, S., 2009, Groundwater nitrate pollution in Souss-Massa basin (south-west Morocco), Afr. J. Environ. Sci. Technol., 3(10), 301-309.
- 65. Tai, Y.L., and Dempsey, B.A., 2009, Nitrite reduction with hydrous ferric oxide and Fe(II): stoichiometry, rate, and mechanism, Wa-ter Res., 43(2), 546-552.
-

- 66. Tecon, R., and Or, D., 2017, Biophysical processes supporting the diversity of microbial life in soil, FEMS Microbiology Reviews., 41(5), 599-623.
-

- 67. Tindall, J.A. and Chen, A., 2014, Variables that affect agricultural chemicals in groundwater in nebraska, Water. Air. Soil. Pollut., 225(2), 1862.
-

- 68. Tong, S., Zhang, B., Feng, C., Zhao, Y., Chen, N., Hao, C., Pu, J., and Zhao, L., 2013, Characteristics of hetero-trophic/biofilm-electrode autotrophic denitrification of for nitrate re-moval from groundwater, Bioresour. Tchnol., 148, 121-127.
-

- 69. Tong, S., Rodriguez-Gonzalez, L.C., Rayne, K.A., Stocks, J.L., Feng, C., and Ergas, S.J., 2018, Effect of pyrite pretreatment, particle size, dose, and biomass concentration on particulate pyrite autotrophic denitrification of nitrified domestic wastewater, Environ. Eng. Sci., 35(8), 875-886.
-

- 70. Torrentó, C., Cama, J., Urmeneta, J., Otero, N., and Soler, A., 2010, Denitrification of groundwater with pyrite and Thiobacillus deni-trificans, Chem. Geol., 278(1-2), 80-91.
-

- 71. Torrentó, C., Urmeneta, J., Otero, N., Soler, A., Viñas, M., and Cama, J., 2011, Enhanced denitrification in groundwater and sedi-ments from a nitrate-contaminated aquifer after addition of pyrite, Chem. Geol., 287(1-2), 90-101.
-

- 72. Vaclavkova, S., Schultz-Jensen, N., Jacobsen, O.S., Elberling, B., and Aamand, J., 2015, Nitrate-controlled anaerobic oxidation of pyrite by Thiobacullus cultures, Geomicrobiol. J., 32(5), 412-419.
-

- 73. Van Rijin, J., Tal, Y., and Barak, Y., 1996, Influence of volatile fatty acids on nitrite accumulation by a Pseudomonas stutzeri strain isolated from a denitrifying fluidized bed reactor, Appl. Environ. Microbiol., 62(7), 2615-2620.
-

- 74. Warneke, S., Schipper, L.A., Matiasek, M.G., Scow, K. M., Cameron, S., Bruesewitz, D.A., and McDonald, I.R., 2011, Nitrate re-moval, communities of denitrifiers and adverse effects in different carbon substrates for use in denitrification beds, Water Res., 45(17), 5463-5475.
-

- 75. Wilcock, R.J., Nash, D., Schmidt, J., Larned, S.T., Rivers, M.R., and Feehan, P., 2011, Inputs of nutrients and fecal bacteria to freshwaters from irrigated agriculture: Case studies in Australia and New Zealand, Environ. Manag., 48(1), 198-211.
-

- 76. Wilderer, P.A., Jones, W.L., and Dau, U., 1987, Competition in denitrification systems affecting reduction rate and accumulation of nitrite, Water Res., 21(2), 239-245.
-

- 77. World Health Organization (WHO), 2016, Nitrate and nitrite in drinking water WHO/FWC/WSH/16.52, World Hearth Organization, Geneva, Switzerland., p. 33.
- 78. Wu, D., Shao, B., Fu, M., Luo, C., and Liu, Z., 2015, Denitrification of nitrite by ferrous hydroxy complex: Effects on nitrous oxide and ammonium formation, Chem. Eng. J., 279, 149-155.
-

- 79. Xu, D., Li, Y., Howard, A., and Guan, Y., 2013, Effect of earthworm Eisenia fetida and wetland plants on nitrification and denitrifica-tion potentials in vertical flow constructed wetland, Chemosphere, 92(2), 201-206.
-

- 80. Xu, J., Hao, Z., Xie, C., Lv, X., Yang, Y., and Xu, X., 2012, Promotion effect of Fe2+ and Fe3O4 on nitrate reduction using zer-valent iron, Desalination, 284, 9-13.
-

- 81. Xu, Z.X., Shao, L., Yin, H.L., Chu, H.Q., and Yao, Y.J., 2009, Biological Denitrification Using Corncobs as a Carbon Source and Biofilm Carrier, Water Environ. Res., 81(3), 242-247.
-

- 82. Yu, H.M. and Shin, D.B., 2018, Mineralization and genetic environments of the central and main orebodies in the manhang deposit, goesan, J. Miner. Soc. Korea, 31(2), 87-101.
-

- 83. Yun, S.W., Choi, H.M., and Lee, J.Y., 2014, Comparison of groundwater levles and groundwater qulities in six megacities of Korea, J. Geol. Soc. Korea, 50(4), 517-528.
-

- 84. Yun, S.W., Jeon, W.H., and Lee, J.Y., 2017, Evaluation of hydrochemical characteristics of groundwater and stream water in a heavy agricultural region of the haean basin, J. Geol. Soc. Korea, 53(5), 727-742.
-

- 85. Zhang, X., Davidson, E.A., Mauzerall, D.L., Searchinger, T.D., Dumas, P., and Shen, Y., 2015, Managing nitrogen for sustainable development, Nature, 528, 51-59.
- 86. Zheng, M., 2018, Aerobic denitrification characteristics and mechanism of peudomonas stutzeri PCN-1, Nitrogen removal character-istics of aerobic denitrifying bacteria and their applications in nitrogen oxides emission mitigation, Springer. Singapore., 51-69. doi:10.1007/978-981-13-2432-1_3.
-

 This Article
This Article
-
2020; 25(S1): 16-27
Published on Jun 30, 2020
- 10.7857/JSGE.2020.25.s1.016
- Received on May 8, 2020
- Revised on May 15, 2020
- Accepted on May 25, 2020
 Services
Services
- Abstract
1.서 론
2.질산염 오염현황
3.지중환경 내 탈질 반응에 대한 지질 매체의 영향
4.비생물학적 탈질 반응의 중요성
5.시사점 및 제언
- 사사
- References
- Full Text PDF
Shared
 Correspondence to
Correspondence to
- Soon-Oh Kim
-
Department of Geology and Research Institute of Natural Science (RINS), Gyeongsang National University (GNU)
- E-mail: sokim@gnu.ac.kr