- Removal of Nitrate from Groundwater using Zero-valent Iron-modified Biochar
Eun-Yeong Han·Hye-Bin Kim·Jong-Gook Kim·Dong-Hun·Shin·Kitae Baek*
Department of Environmental & Energy and Soil Environment Research Center, Jeonbuk National University, Jeonju, Jeollabukdo 57896, Republic of Korea
- 영가철 개질 바이오차를 이용한 지하수의 질산성 질소 제거
한은영·김혜빈·김종국·신동훈·백기태*
전북대학교 환경에너지융합학과 및 토양환경연구센터
Nitrate released from chemical fertilizer, animal wastes, and synthetic
detergents can cause methemoglobinemia to infants, thus the standard in
drinking water is set to 10 mg/L as World
Health Organization recommended. In this study, zero-valent iron-modified rice
straw biochar was used to reduce and remove nitrate in the aqueous phase. The
rice straw biochar was prepared by pyrolyzing the biomass at 700oC for 3 hours,
and the biochar was modified using 1 M Fe(III), and
the Fe(III) on the biochar was reduced to zero-valent iron using sodium
borohydride. The modified biochar removed nitrate effectively, which removed
more than 91% of nitrate. For the synthetic groundwater, the nitrate removal
was lowered to 82% due to the presence of other anions.
Keywords: Nitrate; Reduction; Adsorption; Zero-valent Iron; Biochar
질산성 질소(NO3-)는 화학비료, 가축 배설물, 합성세제로부터 발생하는 오염물질로, 지하수를 포함한 수계의 질산성
질소 오염이 지속적으로 악화되고 있다. 질산성질소는 체내에서 아질산성 질소(NO2-)로 환원되어 헤모글로빈의 산소전달능력을 저하시키고 심각할 경우 혼수상태나 사망에 이르게 할
수 있고(Ward et al., 2018), 특히 유아에게 청색증을
일으킨다. 우리나라에서 질산성 질소는 지하수에서 기준을 가장 많이 초과하는 항목이며, 질산성질소에 의한 지하수 오염은 대표적인 환경문제 중 하나이다(Song et al., 2014). 따라서 우리나라에서는 질산성 질소의 먹는 물 수질기준을 10 mg/L로 규제하고 있다(Sadeq et al., 2008).
지하수의 질산성 질소는 생물학적 탈질, 이온교환법, 역삼투법, 전기투석, 화학적 환원 등의 기술들에 의해 처리되고 있다(Amit et al., 2011). 역삼투와 전기투석 공정에서는 질산성 질소의 제거율은 높으나 유지관리
비용이 많이 소요되며, 이온교환 공정은 고농도의 폐액이 발생하여 부가적인 처리가 필요하고, 생물학적 탈질은 대량의 슬러지가 발생하고 유지관리가
까다로운 단점이 있다. 이에 비해 화학적 환원 공정은 비용 효과적이고 운전이 간편하여 질산성 질소 제거에 널리 쓰이는 기술이다(Hwang et al., 2011). 하지만, 화학적 환원은 다른 형태의 질소화합물로 전환시키기만 할 뿐 근본적인
총 질소는 제거하지 못한다. 본 연구에서는 지하수에서 총질소를 저감할 수 있는 공정을 우선적으로 고려하였다.
화학적 환원에서 질산성 질소(NO3-)는 환원제에 의해 질소기체(N2)나 암모니아(NH3)와
같은 질소화합물의 형태로 환원될 수 있다(Yang and
Lee, 2005). N2로의 전환이 가장 이상적인 반응이기는 하나 백금과 같은 고가의 촉매가 필요하여 그에 따른 비용이 증가하고(Kim et al., 2013), NH3는 악취를 일으키는 2차 오염물질로 추가적인
처리 공정이 필요하다. 용존 암모니아는 pH에 따라서 암모늄 이온(NH4+)형태로 존재할 수 있으며,
NH4+은 비교적 흡착에 용이하기 때문에 질산성 질소를 NH4+의
형태로 환원시켜 흡착 제거하고자 하였다.
질산성 질소를 암모니아성 질소로 전환하는 환원제로는 영가철(Zero-valent iron, ZVI)이 널리 사용되고 있으며, ZVI는
환원력이 크고 비용도 비교적 저렴하여 지하수 내의 여러 오염물질들을 환원하여 처리하는데 적용되어 왔다(Fu et al., 2014). 질산성 질소는 ZVI에 의해 암모니아로 환원되고, pH에 따라
NH4+의 형태로 이온화 될 수 있고, 결과적으로 영가철은 산화철로 산화된다. ZVI는 질산성 질소의 환원에
널리 사용되고 있지만, 다른 물질과의 반응성이 크고 뭉침현상이 일어나기 때문에 NH4+의 흡착 사이트가
적고 ZVI 만으로는 질산성 질소의 제거가 용이하지 않다(Xu et al.,
2012; Qian et al., 2017). 따라서, 흡착사이트를 증가시키고 질산성 질소의 제거율을 향상시키고자 바이오차를 ZVI로 개질하여
질산성 질소 제거에 적용하였다.
바이오차는 산소가 제한된 조건에서 biomass를 열분해하여 얻은 물질로, 탄소가 풍부한 물질이다. 바이오차는 표면적이 넓고 다양한
작용기를 가지고 있는 흡착능이 우수한 다공성 물질로 염료물질이나 중금속의 흡착제로 많이 사용되고 있다(Tan et al., 2016). ZVI로 개질된 바이오차는 ZVI의 응집현상을 막아주고 비표면적인
큰 바이오차는 ZVI에 의해 환원된 NH4+에 대한 흡착 사이트를 제공할 수 있을 것이라고 기대하였다.
따라서, ZVI로 개질된 바이오차는 질산성 질소를 NH4+으로 환원시키고, 동시에 NH4+은
바이오차나 산화철에 흡착되어 제거될 것이라고 가설을 설정하였다. 본 연구에서는 ZVI으로 개질된 바이오차를 통한 질산성 질소의 제거 효율 및 그
특성을 파악하고자 하였다. ZVI으로 개질된 바이오차의 pH에 따른 질산성 질소의 제거효율을 비교하였고, 실제 지하수 조건에서의 질산성 질소 제거
효율을 평가하고자 하였다.
2.1. 바이오차 제조
바이오차는 매년 약 5 백만톤 발생하는 농업부산물인 볏짚(rice straw, RS)을 사용하여 제조하였고, 경기도 김포 지역 농경지의
볏짚을 사용하였다. 건조된 RS는 Muffle Furnace(MF-32GF, JEIO TECH)에서 700oC로 3시간 동안 N2 가스로 퍼징(purging)하여 무산소 환경에서 열분해 하였다(승온속도=7oC/m). 제조한 볏짚 바이오차(rice
straw biochar, RB)는 균질성을 확보하기 위해 100 mesh(<150 μm)로
체거름하여 사용하였다.
2.2. 영가철로 개질한 바이오차 제조
RB는 1 M FeCl3·6H2O(97%, KANTO
CHEMICAL, Japan)용액에 1:10(100 g/L)의 비율로 4시간 동안 400 rpm으로 교반하여
RB에 Fe(III)을 함침시킨 후 고액분리 하여 105oC에서 4시간 동안 건조하였다. 건조된
RB는 1 M sodium borohydride(NaBH4, 98%, JUNSEI,
Japan) 용액에 1:20 (50 g/L)의 비율로 1시간
동안 400 rpm으로 교반하여 식(1)과 같이 RB에 함침된 Fe(III)를 ZVI로 환원시켰다. 사용된
증류수(Deionized water)는 영가철이 용존 산소에 의해 산화되는 것을 방지하기 위하여 N2로 purging하여 용존산소를
제거한 후 사용하였다. Fe(III)를 함침시킨 후 NaBH4로 반응시켜 영가철로 개질한 볏짚 바이오차(RBZVI-1)와
Fe(III)를 함침시키지 않고 NaBH4로만 반응시킨 볏짚 바이오차(RBZVI-2)는 ZVI가 공기 중에서 산화되는 것을
방지하기 위해 N2로 purging한 데시케이터에서 보관하였다.
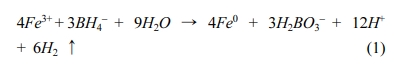
2.3. 질산성 질소 제거
질산성 질소 용액은 KNO3(≥99%, Sigma-Aldrich, USA)를 사용하여 제조하였고, 초기 농도는 지하수에서의
질산성 질소 농도를 고려하여 25 mg N/L로 설정하였다. 바이오차와 NO3- 용액은 1 g : 20 ml(50 g/L)의 비율로 8시간
교반하였다. 바이오차의 pH에 따른 NO3- 제거 효율을 평가하기 위해 1 M HCl(35%, OCI
Company, Korea)용액으로 바이오차의 pH를 5, 6, 7로 조절하여 실험하였다. 바이오차의 양에 따른 질산성 질소의 제거
효율을 평가하기 위해 1 g : 40 ml(25 g/L), 1 g : 200 ml(5 g/L), 1 g : 1000 ml(1 g/L)의 비율로 실험을
수행하였고, 시간에 따른 질산성 질소의 제거율을 평가하기 위해 교반 시간을 5분, 10분, 30분, 1시간,
2시간으로 진행하였다. 실제 지하수 환경에서 질산성 질소의 제거율을 평가하기 위해 인공지하수를 제조하여 질산성 질소 제거 실험을 수행하였다. 인공지하수는
한국의 377개 지점에서 채취한 지하수의 평균 이온농도를 참고하여 제조하였다(Table 1) (Chae et al., 2007). 실험은 상온에서 30 rpm(Rotator,
FINEPCR, Korea)으로 교반하였고, 모든 실험결과는 2 회 반복 실험하였다.
2.4. 분석방법
질산성 질소는 220 nm에서 Spectrophotometer(HS-3700,
HUMAS, Korea)로 측정하였고, 총 질소는 Total Organic Carbon Analyzer(TOC-L CPH, SHIMADZU,
Japan)를 사용하여 측정하였다. 바이오차의 pH는 바이오차와 증류수를 1 g : 10 ml의 비율로 혼합하여
1시간 정치 후 pH-meter(K2200-pH, ISTEK, Korea)로 측정하였다. 바이오차를 왕수(염산:질산=3:1) 추출하여
ICP-OES(720-OES, Agilent Technologies, USA)로 금속 함량을 분석하였고, 바이오차의 원소 분석은
Elemental Analyzer(IT/Flash 2000, Thermo Fisher Scientific, Germany)를 사용하였다. 바이오차 표면의 작용기는
Fourier Transform Infrared Spectrometer(FT-IR)(Frontier, Perkin Elmer, USA)를 통해
분석하였다. 바이오차 표면의 결정구조는 Multi-Purpose High Performance X-ray Diffractometer (X’pert
Pro
Powder, Malvern Panalytical, Germany)로 분석하였고, Specific Surface Area
Analyzer(BET, micro- meritics,
USA)으로 바이오차의 비표면적을 분석하였다.
3.1. 바이오차의 특성
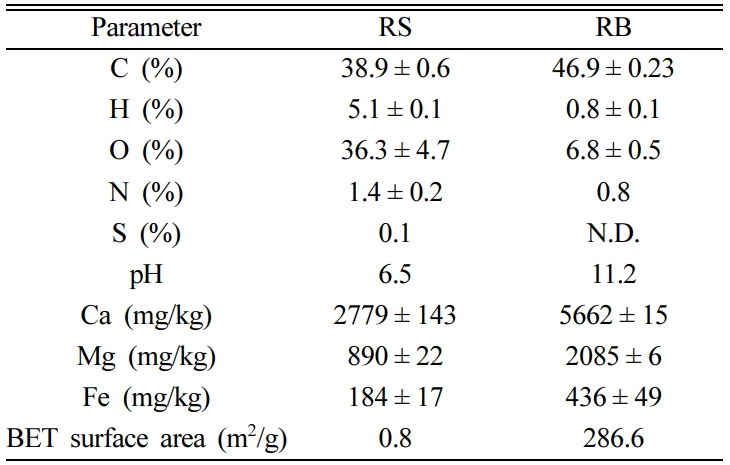
바이오차의 물리화학적 특성을 확인하기 위해 RS와 RB의 원소 분석, 왕수 추출, pH, BET 비표면적 분석결과는 표로 나타내었다(Table
2). RS와 RB의 탄소 함량은 각각 38.9와, 46.9%로 열분해 후 탄소 함량이 증가하였고, 나머지 원소 H, O, N, S 함량은 모두
감소하였다. RS와 RB의 pH는 각각 6.5와 11.2로 열분해 후 pH가 증가하였고, 알칼리 토금속인 Ca와 Mg의 함량도 증가하였다. 철
함량은 RS와 RB에서 각각 184과 436 mg/kg, BET 비표면적은
각각 0.8과 286.6 m2/g으로 측정되었다.
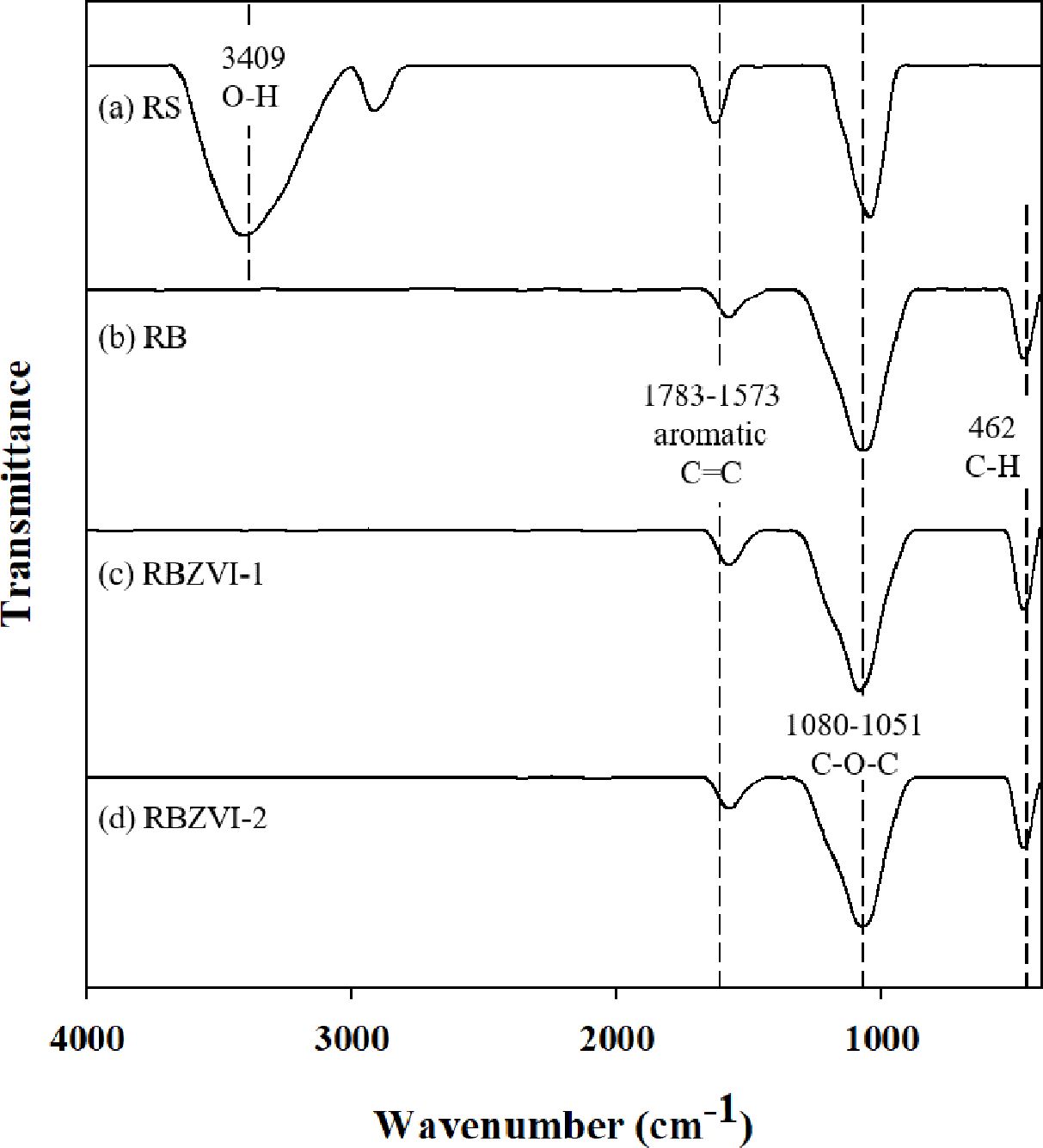
RS, RB, RBZVI-1와 RBZVI-2의 표면 작용기 분석결과는 Fig. 1에 나타내었다. RS는 3660-3000 cm-1에서 O-H
stretching, 1700-1550 cm-1에서 aromatic
C=C 및 1200-950 cm-1 에서 C-O-C 등의
peak를 가지고 있었다(Xu et al., 2020). RB, RBZVI-1와
RBZVI-2는 1700-1550 cm-1에서 aromatic
C=C, 1200-950 cm-1에서 C-O-C 및
520-410 cm-1에서 aromatic
C-H가 관찰되었다. RB, RBZVI-1와 RBZVI-2는 RS와 달리 O-H streching peak가 관찰되지 않았고, aromatic
C-H가 생성되었다. 열분해를 통해 산소의 함량이 감소하였기 때문에 바이오차 표면에 산소를 포함한 hydroxyl group 작용기가 없어진 것을
확인할 수 있다. 또한 열분해를 통해 aromatic 작용기가 새롭게 생성된 것을 확인할 수 있다.
3.2. 바이오차의 pH에 따른 질산성
질소 제거
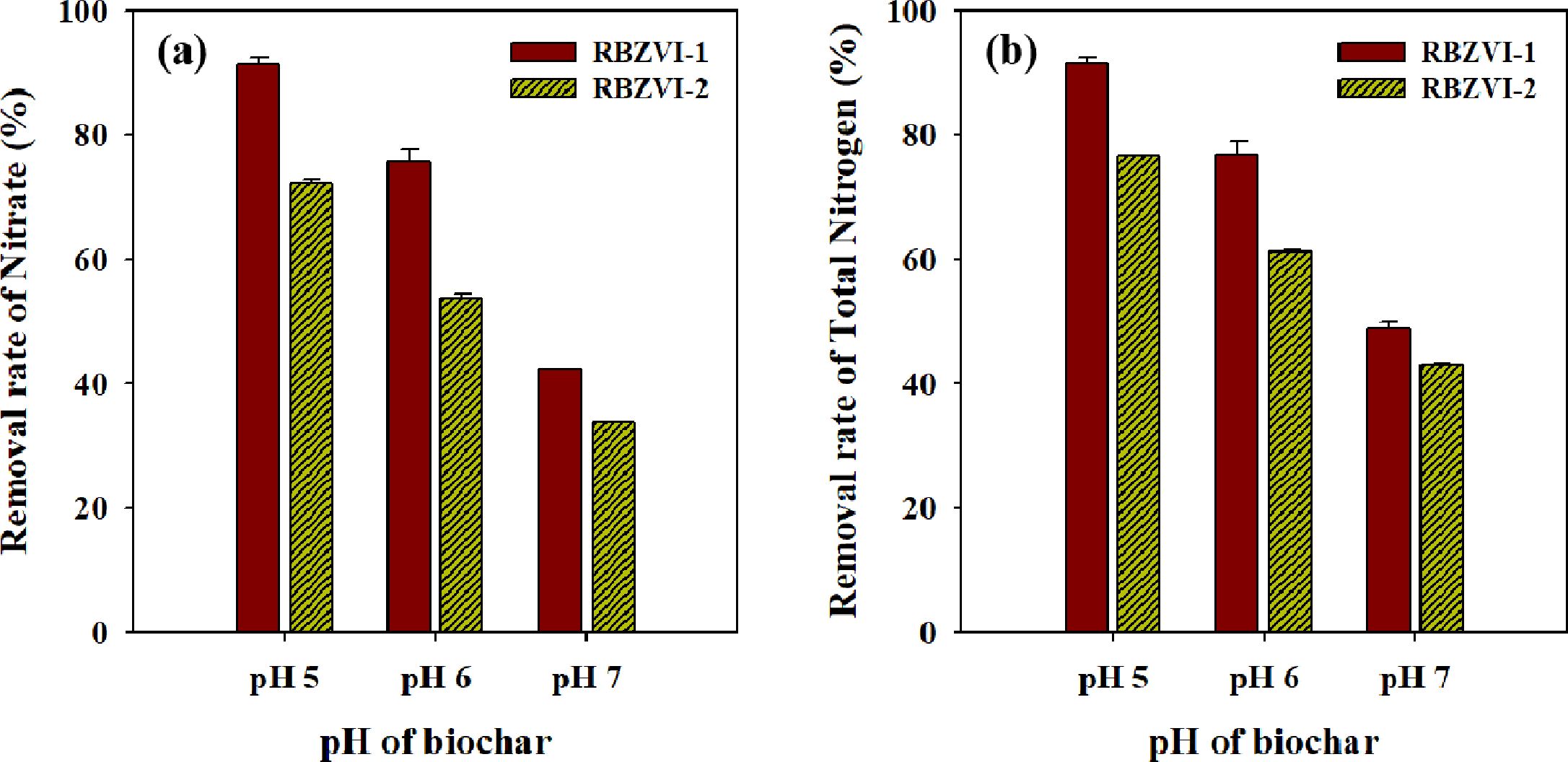
각각 pH 5, 6, 7로 조절한 RBZVI-1와 RBZVI-2를 질산성 질소 용액과 교반시킨 후 여과액의 질산성 질소와 총 질소 농도를
분석하여 그림으로 나타내었다(Fig. 2). pH 5, 6, 7의 RBZVI-1는 질산성 질소를 초기 농도 25.6 mg/L에서 각각
2.1, 6.1, 14.4 mg/L로 감소하였고, RBZVI-2는 각각 6.9, 11.6, 16.5 mg/L로 낮아졌다. 질산성 질소 제거율과 총 질소의
제거 경향은 동일 하였으며, 바이오차의 pH가 낮을수록 제거율이 높았고, RBZVI-2보다 RBZVI-1의 제거율이 더 높았다. 특히
pH 5로 조절한 RBZVI-1의 경우에는 질산성 질소 제거율이 91%로 최대 제거 효율을 보였다. 왕수 분석 결과 RBZVI-1의 철 함량은
2,618 mg/kg로, 인공적으로 철을 함침시켰을 경우(RBZVI-1) 철의 함량이 그렇지 않은 경우(RBZVI-2) 보다 약 6 배 높았다. 즉, RBZVI-1은 RBZVI-2보다 철의
함량이 높아 질산성질소를 환원시킬수 있는 능력이 더 큰 것으로 보인다. RBZVI-2는 볏짚에 내재된 철 만으로 질산성 질소와 반응하여
RBZVI-1보다는 제거 효율이 낮았지만, pH 5에서 약 71%의 질산성질소를 제거하였다. 질산성 질소의 감소뿐 만 아니라 총 질소까지 제거된
것으로 보아 질산성 질소가 환원되어 환원된 형태의 질소화합물이 제거되었거나, 또는 질산성 질소가 직접 흡착되어 제거되었을 것으로 예상된다. 영가철에
의한 질산성 질소의 최종 환원 산물은 일반적으로 암모니아성 질소(NH3-N)이다(Wei et al., 2018). 암모니아성 질소는 pH에 따라 암모니아와 암모늄 이온으로 존재할
수 있다.
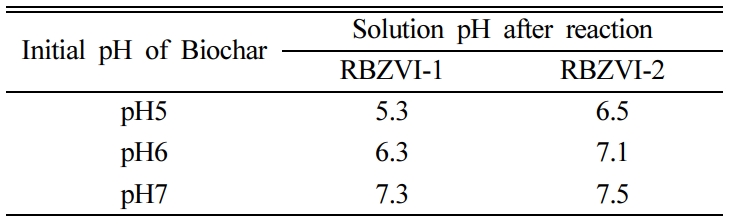
RBZVI-1, RBZVI-2와 반응 후 질산성 질소 용액의 pH는 모두 증가하였다(Table 3). 질산성 질소의 환원 반응이 진행되는
동안 H+를 소모하며 암모니아성 질소로 환원되었기 때문에 pH가 증가한 것으로 보인다. 그에 대한 반응식은 표에 나타내었다(Table
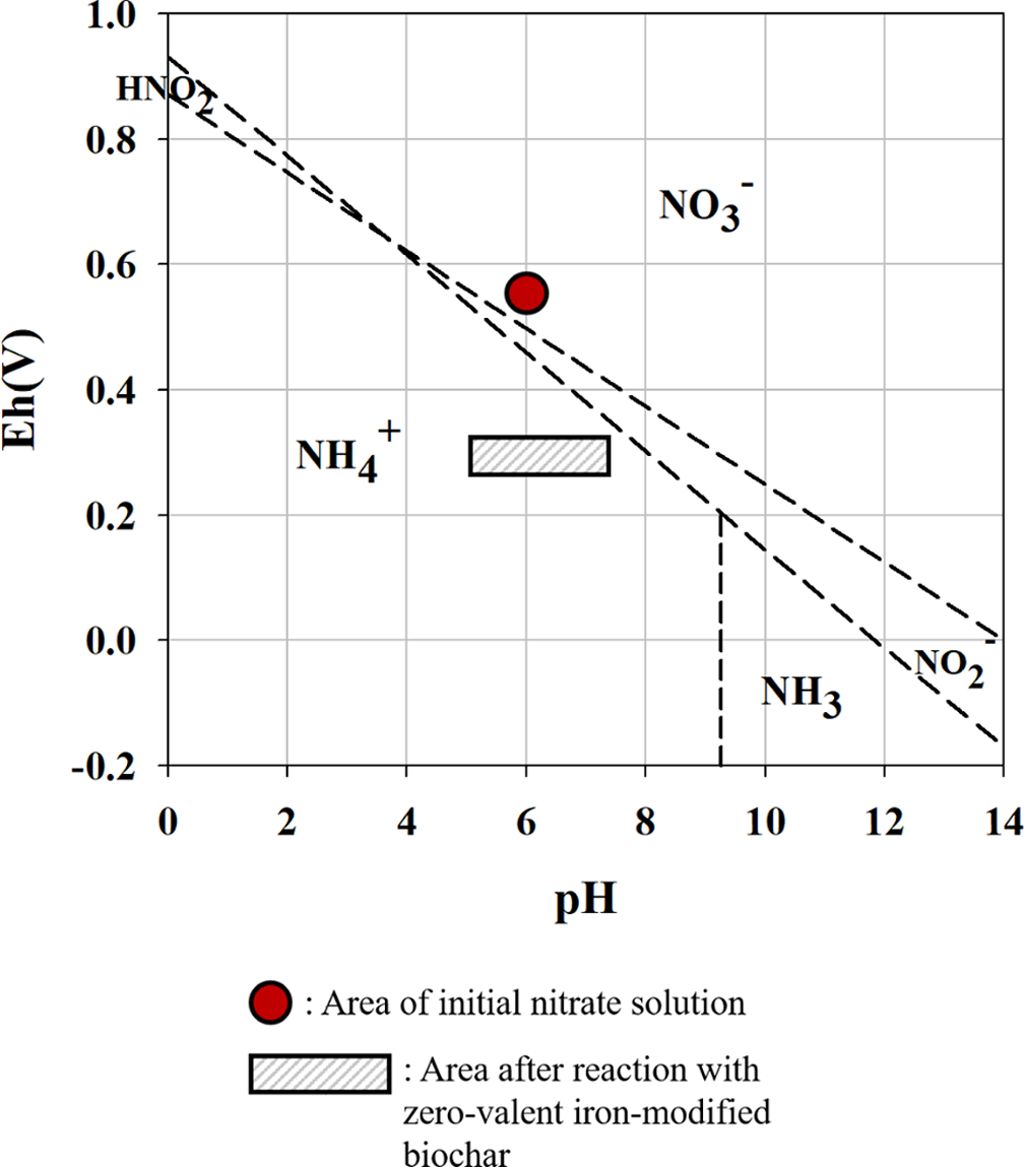
4). 질산성 질소의 최종 환원 산물을 파악하기 위해 반응 후 여과한 질산성 질소 용액의 pH와 ORP를 측정하여 Pourbiax
diagram에서 비교하였다(Fig. 3). NH3는 pH 10 이상의 염기성 상태에서 훨씬 많은 양이 존재하며 pH 8이하에서는 NH4+의
형태로 존재한다. 질산성 질소 용액의 pH와 ORP를 분석한 결과, 반응 전의 ORP는 약 0.55, pH는 약 5.9로 측정되었고, 반응 후의
ORP는 0.29-0.34, pH는 5.3-7.5로 측정되었다. Pourbiax diagram상에서 질산성 질소가 NH4+으로
환원된 것을 확인하였고(Fig. 3), 반응 후의 pH는 최대 7,5로 용존 암모니아로 전환은 거의 일어나지 않을 것으로 예상된다. 따라서, 질산성
질소는 H+를 소모하면서 영가철에 의해 암모늄 이온으로 환원되었으며 개질된 바이오차에 흡착되어 총 질소까지 제거되었거나, 질산성
질소가 직접적으로 흡착된 것으로 추정된다. 그러나, 질산성 질소의 흡착은 매우 낮은 pH에서 일어나는 것으로 알려져 있어 환원에 의해 제거 가능성이
더 큰 것으로 판단된다.
3.3. 인공지하수 조건에서의 질산성
질소 제거
실제 지하수에는 질산성 질소 외에도 염소, 중탄산, 탄산, 나트륨, 칼슘 등과 같은 다양한 음이온 및 양이온이 존재한다. 이러한 이온
및 용존유기물은 영가철과 바이오차에 의한 질산성 질소의 환원과 흡착에 영향을 미칠 수 있으며, 이러한 이온들은 질산성 질소의 제거 효율과 제거
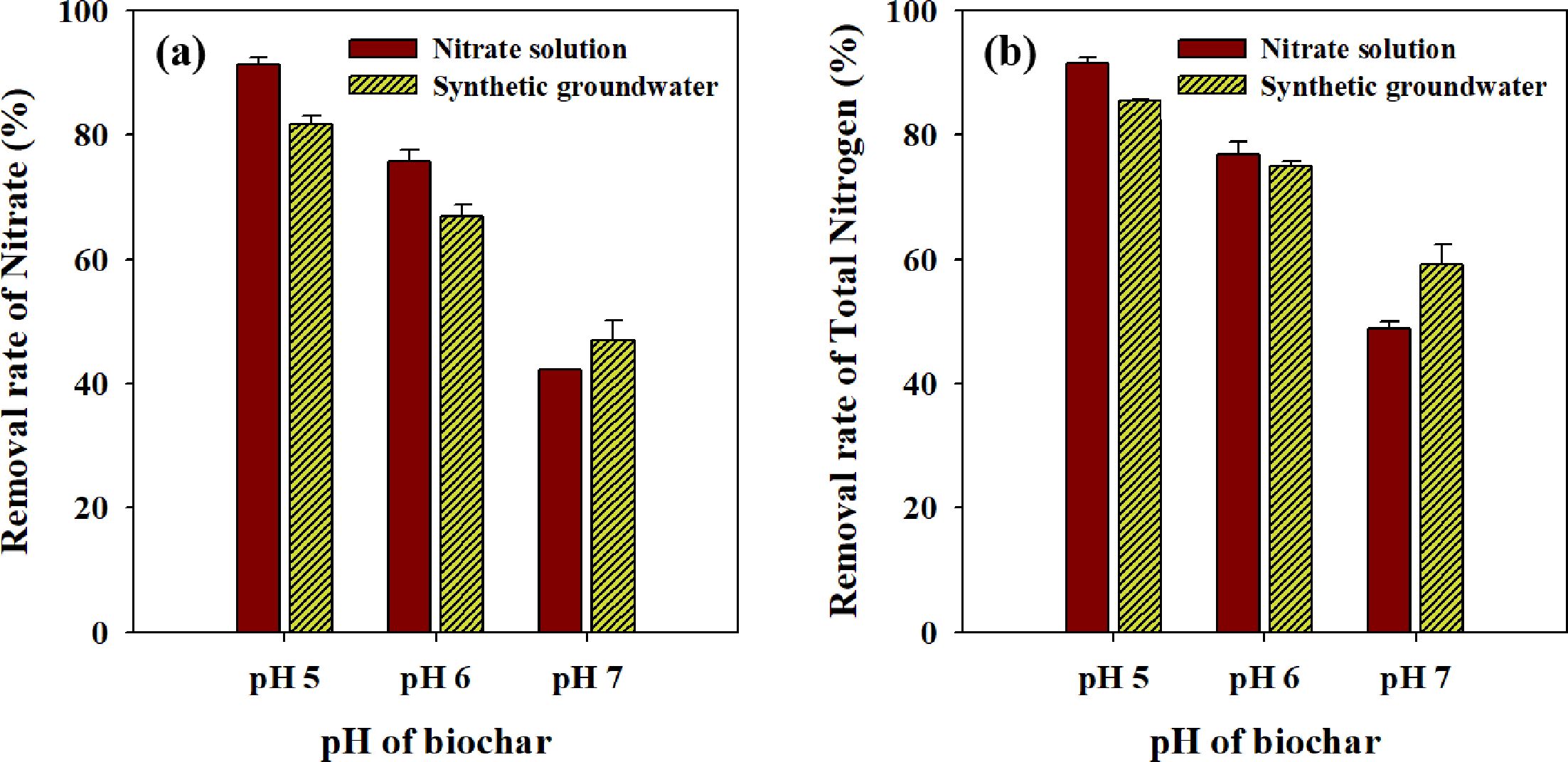
속도에 영향을 미칠 수 있다. pH 5, 6, 7로 조절한 RBZVI-1를 인공지하수 조건과 순수한 질산성 질소 용액에 적용하여 질산성 질소와
총 질소의 제거효율을 비교하였고 그에 대한 실험 결과는 Fig. 4에 나타내었다.
pH 5, 6, 7의 RBZVI-1에 의해 질산성 질소를 초기 농도 25.6 mg/L에서 각각
4.6, 8.5, 13.6 mg/L로 감소하였고, 총질소는 각각 3.7, 6.4, 10.4 mg/L로 감소하였다. 질산성
질소 제거율과 총 질소의 제거 경향은 동일 하였으며, 바이오차의 pH가 낮을수록 높은 제거율을 확인할 수 있었다. 특히 pH 5에서의 질산성 질소
제거율은 82%로 가장 높은 효율을 보였다. 인공지하수 조건에서의 질산성 질소 제거는 순수한 질산성 질소의 제거 보다 최대 10%의 제거율이 감소하였다.
다양한 음이온 및 양이온이 질산성 질소의 환원 또는 흡착에 방해 요인으로 작용하여 제거율이 다소 감소한 것으로 판단된다. 하지만, 여전히 pH
5, 6의 RBZVI-1는 지하수 생활용수 및 먹는 물 수질기준(10 mg N/L)을 모두 충족하였고,
pH 7의 RBZVI-1는 생활용수 기준(20 mg N/L) 이하로 질산성
질소를 제거하였다. 따라서, 실제 지하수 조건에서도 영가철로 개질한 바이오차를 질산성 질소 제거에 적용할 수 있을 것으로 기대된다.
3.4. 바이오차의 투여량에 따른
질산성 질소 제거
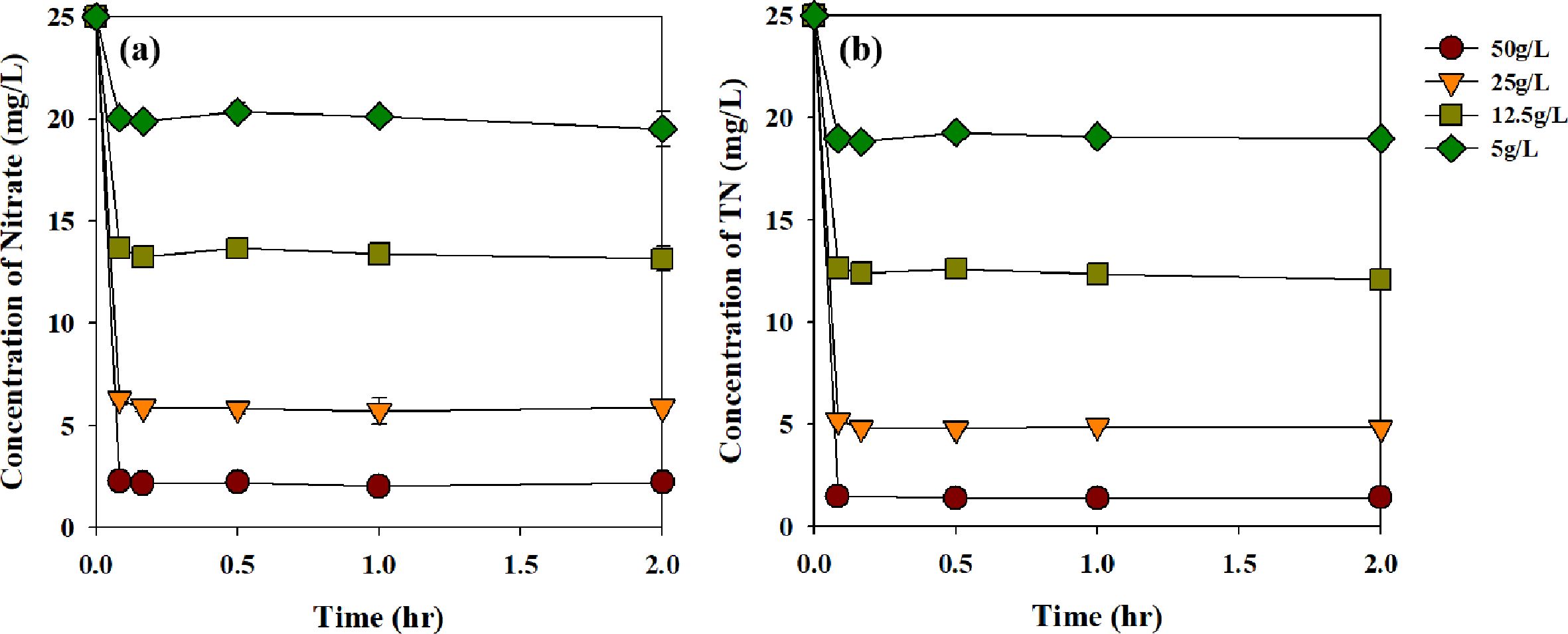
바이오차의 투여량에 따른 질산성 질소의 제거 효율과 평형에 도달하는 시간을 알기 위해 진행한 kinetic 실험의 결과는 Fig.
5에 나타내었다. RBZVI-1은 50, 25, 12.5, 5 g/L 의 비율로 질산성
질소 제거 실험에 적용되었고, 질산성 질소의 제거율은 각각 91, 77, 48, 20%, 총 질소의 제거율은 94, 81, 52, 25%로 질산성
질소 제거와 총 질소의 제거 경향은 동일하였다. 바이오차의 투여량이 증가할수록 질산성 질소와 총 질소의 제거율이 증가하는 것을 알 수 있었고,
반응 후 10분 이내로 평형에 도달하는 것을 알 수 있었다. RBZVI-1의 투여량이 12.5 g/L일 경우 생활용수 기준(20 mg N/L) 이하로 질산성
질소를 처리할 수 있을 것으로 판단되었고, 평형에 빠르게 도달 하는 것으로 보아 짧은 시간안에 지하수 내의 질산성 질소를 제거할 수 있을 것으로
기대된다.
|
Fig. 1 FTIR spectra of biomass (RS), biochar (RB), and ZVIimpregnated biochars (RBZVI-1 & RBZVI-2) |
|
Fig. 2 (a) Removal of Nitrate and (b) Removal of Total Nitrogen (Initial concentration of nitrate was 25 mg/L, and 50 g/L of RBZVI was
used) |
|
Fig. 3 Pourbiax diagram of nitrogen. |
|
Fig. 4 (a) Removal rate of Nitrate, (b) Removal rate of Total Nitrogen (Initial concentration of Nitrate solution = 25 mg/L). |
|
Fig. 5 (a) Removal rate of Nitrate, (b) Removal rate of Total Nitrogen (Initial pH of Nitrate solution = 5). |
지하수의 질산성 질소를 제거하기 위해 볏짚 바이오차를 영가철로 개질하여 적용하였다. 영가철 개질 바이오차는 HCl로 전처리 하여 적용하였고,
낮은 pH의 바이오차가 질산성 질소에 대한 더 높은 제거율을 보였다. Pourbiax diagram을 통해 영가철 개질 바이오차와 반응 후에 질산성
질소가 암모늄 이온 형태로 환원된 것을 확인하였고, 질산성 질소가 제거되면서 총질소도 제거된 것으로 보아 환원된 암모늄이 흡착되어 제거된것으로
보인다. 순수한 질산성 질소 용액에서는 영가철 개질 바이오차는 최대 91%의 질산성 질소 제거 효율을 보였고, 인공지하수 조건에서는 최대
82%의 제거 효율을 보였다. 결과적으로, 본 연구에서 합성한 영가철 개질 바이오차는 실제 지하수 내의 질산성 질소를 효과적으로 제거할 수 있을
것으로 판단된다.
본 연구는 한국철도기술연구원의 연구비 지원으로 수행되었음.
- 1. Amit, B. and Mika, S., 2011, A review of emerging adsorbents for nitrate removal from water, Chem. Eng. J., 168(2), 493-504.
- 2. Chae, G.T., Yun, S.T., Mayer, B., Kim, K.H., Kim, S.Y., Kwon, J.S., Kim, K., and Koh, Y.K., 2007, Fluorine geochemistry in bed-rock groundwater of South Korea, Sci. Total Environ., 385(1-3), 272-283.
-

- 3. Fu, F.L., Dionysiou, D.D., and Liu, H., 2014, The use of zero-valent iron for groundwater remediation and wastewater treatment: A review, J. Hazard. Mater., 267, 194-205.
-

- 4. Hwang, Y.H., Kim, D.G., and Shin, H.S., 2011, Mechanism study of nitrate reduction by nano zero valent iron, J. Hazard. Mater., 185(2-3), 1513-1521.
-

- 5. Kim, M.S., Chung, S.H., Yoo, C.J., Lee, M.S., Cho, I.H., Lee, D.W., and Lee, K.Y., 2013, Catalytic reduction of nitrate in water over Pd-Cu/TiO2 catalyst: Effect of the strong metal-support interaction (SMSI) on the catalytic activity, Appl. Catal., B, 142-143, 354-361.
-

- 6. Qian, L.B., Zhang, W.Y., Yan, J.C., Han, L., Chen, Y., Ouyang, D., and Chen, M.F., 2017, Nanoscale zero-valent iron supported by biochars produced at different temperatures: Synthesis mechanism and effect on Cr(VI) removal, Environ. Pollut., 223, 153-160.
-

- 7. Sadeq, M., Moe, C.L., Attarassi, B., Cherkaoui, I., ElAouad, R., and Idrissi, L., 2008, Drinking water nitrate and prevalence of me-themoglobinemia among infants and children aged 1-7 years in Moroccan areas, Int. J. Hyg. Environ. Health., 211(5-6), 546-554.
-

- 8. Song, H., Jeon, B.-H., and Cho, D.-W., 2014, Nitrate reduction by Fe(0)/iron oxide mineral systems: A comparative study using dif-ferent iron oxides, J. Soil Groundwater Environ., 19(1), 63-69.
-

- 9. Suzuki, T., Moribe, M., Oyama, Y., and Niinae, M., 2012, Mechanism of nitrate reduction by zero-valent iron: Equilibrium and kinet-ics studies, Chem. Eng. J., 183, 271-277.
-

- 10. Tan, X.F., Liu, Y.G., Gu, Y.L., Xu, Y., Zeng, G.M., Hu, X.J., Liu, S.B., Wang, X., Liu, S.M., and Li, J., 2016, Biochar-based nano-composites for the decontamination of wastewater: A review, Bioresour. Technol., 212, 318-333.
-

- 11. Ward, M.H., Jones, R.R., Brender, J.D., de Kok, T.M., Weyer, P.J., Nolan, B.T., Villanueva, C.M., and van Breda, S.G., 2018, Drinking Water Nitrate and Human Health: An Updated Review, Int. J. Environ. Res. Public Health, 15(7), 1557
-

- 12. Wei, A.L., Ma, J., Chen, J.J., Zhang, Y., Song, J.X., and Yu, X.Y., 2018, Enhanced nitrate removal and high selectivity towards dini-trogen for groundwater remediation using biochar-supported nano zero-valent iron, Chem. Eng. J., 353, 595-605.
-

- 13. Xu, J., Hao, Z.W., Xie, C.S., Lv, X.S., Yang, Y.P., and Xu, X.H., 2012, Promotion effect of Fe2+ and Fe3O4 on nitrate reduction using zero-valent iron, Desalination, 284, 9-13.
-

- 14. Xu, Z.B., Xu, X.Y., Zhang, Y., Yu, Y.L., and Cao, X.D., 2020, Pyrolysis-temperature depended electron donating and mediating mechanisms of biochar for Cr(VI) reduction, J. Hazard. Mater., 388 121794.
-

- 15. Yang, G.C.C. and Lee, H.L., 2005, Chemical reduction of nitrate by nanosized iron: Kinetics and pathways, Water Res., 39(5), 884-894.
-

 This Article
This Article
-
2020; 25(4): 28-34
Published on Dec 31, 2020
- 10.7857/JSGE.2020.25.4.028
- Received on Oct 15, 2020
- Revised on Oct 20, 2020
- Accepted on Nov 10, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Shin·Kitae Baek
-
Department of Environmental & Energy and Soil Environment Research Center, Jeonbuk National University, Jeonju, Jeollabukdo 57896, Republic of Korea
- E-mail: kbaek@jbnu.ac.kr