- Persulfate Oxidation of 2,4-D: Effect of Hydroxylamine and Chelating Agent
Jiyeon Choi·Na Kyeong Yoon·Won Sik Shin*
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- 과황산을 이용한 2,4-D의 산화: 하이드록실아민, 킬레이트제의 영향
최지연·윤나경·신원식*
경북대학교 건설환경에너지공학부
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The chemical warfare agents (CWAs) have been developed for offensive or defensive purposes and used as chemical weapons in war and terrorism. The CWAs are exposed to the natural environment, transported through the water system and then eventually contaminate soil and groundwater. Therefore, effective decontamination technology to remediate CWAs are needed. The CWAs are extremely dangerous and prodution is strictly prohibited, therefore, it is difficult to use CWAs even in experimental purpose. In this study, 2,4-dichlorophenoxyacetic acid (2,4-D) was chosen as a model representative CWA because it is a simulant of anti-plant CWAs and one of the major component of agent orange. The optimum degradation conditions such as oxidant:activator ratio were determined. The effects of hydroxylamine and chelating agents such as citric acid (CA), oxalic acid (OA), malic acid (MA), and EDTA addition to increase Fe2+ activation were also investigated. Scavenger experiments using tert-butyl alcohol (TBA) and ethanol confirmed that although both sulfate (SO4•−) and hydroxyl radical (•OH) existed in Fe2+-persulfate system, sulfate radical was the predominant radical. To promote the Fe2+ activator effect, the effect of hydroxylamine as a reducing agent was investigated. In chelating agents assisted Fe2+-persulfate oxidation, the addition of 2 mM of CA and MA enhanced 2,4-D degradation. In contrast, EDTA and OA inhibited the 2,4-D removal due to steric hindrance effect.
Keywords: Persulfate, Pesticide, Hydroxlyamine, Chelating agent, Chemical warfare agents
화학작용제(CWAs, chemical warfare agents)는 생물에 직접적인 독성효과를 주기 위해 사용하는 화학물질로 정의되며(Chauhan et al., 2008), 방사능 및 생물학무기를 포함한 대량살상무기 중 하나로 분류된다(Kim, 2007). 화학작용제 사용의 시초는 제1차 세계대전으로, 이때 독일군이 살포한 염소가스로 인해 약 9만 명의 사상자가 발생했다. 이후 1997년 4월 화학무기금지협약이 발효되면서 화학작용제의 사용을 제한하려는 국제적인 노력이 있었으나(Bartelt-Hunt et al., 2006), 최근 국제적인 테러 및 전쟁에 다시 사용됨으로써 인류는 다시금 보이지 않는 위협에 노출되고 있다. 미 국방부는 ‘화학 및 생물무기 방어계획 연례 보고서’(2007년)에서 한국을 생물·화학·핵무기의 공격을 당할 위험지역으로 분류한 바 있고, 북한과 분단체제를 유지하고 있는 한 테러리즘의 위협에서 안전하다고 보기 어려워 이로 인한 위험이 존재하고 있는 것으로 판단되어, 화학테러로 인한 오염 문제를 우려하지 않을 수 없다. 북한은 약 5,000톤의 화학무기를 보유하고 있는 것으로 추정되나 화학무기 금지협약에도 가입하지 않고 있다. 북한 정부 붕괴 이후 리비아와 마찬가지로 화학무기 보유를 포기할 경우 북한이 보유한 화학무기 폐기를 한국정부에서 감당할 확률이 매우 높을 것으로 판단되므로 폐기공정에 수반되는 2차 환경오염에 대비하여야 한다(KRICT, 2002; Jung, 2004). 화학작용제(CWAs)는 수계를 비롯한 다양한 종류의 물질(페인트, 플라스틱, 고무) 등에 매우 쉽게 용해되거나 섞이는 성질이 있고, 장시간 안정한 상태로 지속될 수 있어 자연적인 분해가 어렵기 때문에 효과적인 처리기술을 개발할 필요가 있다. 화학작용제는 물질 자체의 독성, 불안정성뿐만이 아니라 일반적인 구매나 사용이 금지되어 있어 실험에 이용하기에 어려움이 있어 본 실험에서는 베트남 전쟁에서 많이 사용된 agent orange의 구성성분 중 하나인 2,4-dichlorophenoxyacetic acid(2,4-D)(Hart, 2009)를 선정하여 연구를 수행하였다. 또한, 2,4-D는 anti-plant chemical warfare의 대표적인 모사물질(simulant)로 알려져 있다(Chen et al., 1991; Meselson, 2017). 2,4-D는 페녹시계 제초제로서 내분비계 교란물질인 것으로 알려져 있으며, 세계보건기구(WHO, World Health Organization)에서 인체 발암가능성 물질로 분류하고 있고(IARC, 2015), 국내에서도 수질 감시 대상 물질로 분류하고 있는(MOE, 2019) 잠재적 위험 물질이다.
화학작용제를 무해화하는 방법으로는 screen-off 하거나 대체하는 분리 방법(“Omni block”으로 코팅하는 방법(Kwon et al., 2020)), mesoporous silica nanoparticles (Candel et al., 2015), MOFs(metal organic frameworks) (Lee et al., 2017; Moon et al., 2015; Ploskonka and DeCoste, 2019), porous silicon(Sohn et al., 2000) 등 촉매를 이용한 hydrolysis 방법, TiO2/GO(graphene oxide)를 이용한 초음파 처리(Giannakoudakis et al., 2020), PIM/PAN/MOF(polymers of intrinsic microporo- sity fiber/polyacrylonitrile/metal organic frameworks)(Wang et al., 2020), ZrOxHy aerogel(Long et al., 2020)을 이용한 흡착, 고도산화 기술(Gutch et al., 2016; Osovsky et al., 2014; Smolkin et al., 2018; Wagner and Yang, 2002), 효소 촉매 작용(Bigley et al., 2013) 등으로 나눌 수 있다(Nawata et al., 2019). 최근 들어 점차 단시간에 효과적으로 처리 가능하며 2차 오염이 적은 고도 산화 기술(과산화수소(H2O2), 과망간산(permanganate), 오존(O3), 과황산(persulfate) 등)에 대한 처리 방법이 연구되고 있다. 이 가운데 과황산(persulfate)이 기존의 산화제(과산화수소, 과망간산, 오존 등)과 비교하여 효과적인 산화제로 주목받고 있다. 과황산 산화제는 Fe2+로 활성화되어 과황산염라디칼(sulfate radical, SO4•−)과 수산화라디칼(hydroxyl radical, •OH)을 발생시키면서 펜톤 못지않은 산화력을 지니며(Zhao et al., 2016), 산화 지속시간이 펜톤에 비해 길기 때문에 지하수내 오염물질 처리를 위한 산화제로 적합하다. 과황산은 전이금속(Fe2+, Zn2+, Co2+ 등)과 반응하면 활성화되어 SO4•− 라디칼을 생성하여 높은 산화력을 보인다. 전이금속 중 자연계에 풍부하게 존재하면서 독성이 없으며 처리효율이 높은 Fe2+이 많이 이용된다(Kim et al., 2012). 철 이온 활성효과를 높히기 위하여 하이드록실아민을 주입하여 Fe3+를 Fe2+로 환원시킴으로써 철의 이용성을 증가시킬 수 있다(Zou et al., 2013). 또는 킬레이트제(chelating agent)를 주입함으로써 pH 4 이상의 조건에서 활성화제로 사용된 철 이온의 수산화 화합물 형태로의 침전을 방지하고, 과량의 Fe2+가 SO4•− 라디칼의 scavenging 역할로 산화 반응을 저해하는 것을 방지하여 산화제 활성을 가속화하는 효과를 기대할 수 있다(Dulova et al., 2017; Škarohlíd et al., 2020). 주로 사용되는 킬레이트제로는 polycarboxylate 계열: oxalic acid(OA), tartaric acid, citric acid(CA), malic acid(MA), amino- carboxylate 계열: ethylenediaminetetraacetic acid(EDTA), ethylenediaminedisuccinate(EDDS)과 phosphate ligand 계열: pyrophsphate(PPP), tetrapolyphosphate(TPP) 등이 있다(De Luca et al., 2014; Han et al., 2014; Wang et al., 2019).
본 연구에서는 수계내 2,4-D의 처리를 위해 Fe2+로 활성화된 과황산 산화시 과황산 농도, Fe2+ 농도의 영향을 살펴보고, 주요 라디칼을 확인하였다. 과황산 산화 효율을 높이기 위하여 하이드록실아민 및 킬레이트제(OA, CA, MA, EDTA) 첨가에 따른 영향을 평가하였다.
2.1. 실험 재료
본 실험에서는 대상오염물질로 2,4-dichlorophenoxyacetic acid(2,4-D, C8H6Cl2O3, Sigma-Aldrich, 98.0%)를 사용하였다. Table 1에 2,4-D의 물리화학적 특성을 정리하여 나타내었다. 모든 용액은 ultrapure water(MilliporeSigmaTM SynergyTM Ultrapure Water Purification System, Thermo Fisher Scientific, USA)에 용해하여 제조·사용하였다. 산화제로는 과황산나트륨(sodium persulfate, PS, Na2S2O8, Duksan, 95-100%)을 사용하였으며, 철 활성화제로 황산제일철(ferrous sulfate heptahydrate, FeSO4, Duksan, 98~ 102%), 산화 반응 중지를 위하여 사용된 시약으로는 1-butanol(CH3(CH2)CH2OH, Yakuri, 98.0%)을 구입하여 사용하였다(Chan et al., 2017). 킬레이트제로 ethylenedi-aminetetraacetic acid(EDTA, C10H16N2O8, Ducksan, 99.5%), 옥살산(oxalic acid dihydrate, (COOH)2· 2H2O, Kanto, 99.5-100.2%), 구연산(citric acid anhydrous, C3H4(OH) (COOH)3, Duksan, 99.5%), malic acid(C4H6O5, Duksan, 99.0%), Fe3+ 환원제로 염화하이드록실아민(hydroxylamine hydrochloride, hydroxylmine, HA, NH2OH· HCl, Duksan, >95%)을 사용하였다. Scavenger 실험에는 에탄올(ethyl alcohol, C2H5OH, Duksan, 94%), tert-butanol(TBA, C4H10O, Daejung, 99.5%)을 사용하였다. Fe2+ 이온 측정시 사용된 아세트산 완충용액은 1 M 아세트산(acetic acid, CH3COOH, DC chemical, 99.5%) 28.82 mL과 0.3 M 아세트산나트륨(sodium acetate, CH3COONa, Duksan, 98.5%) 273.3 mL를 혼합 제조였다.
2.2. 산화 실험 방법
모든 산화 실험은 테프론 재질의 실리콘 septa가 부착된 40 mL의 암갈색 유리 바이알(Fisher Scientific)을 이용하여 회분식으로 3회 반복 수행하였으며, 총 반응용액의 부피가 20 mL가 되도록 하였다. PS 산화시 활성화제 첨가에 따른 2,4-D의 산화 효율을 평가하기 위하여 Fe(II)를 활성화제로 사용하여 산화 실험을 수행하였다. 선행 실험으로 0.1 M HCl과 NaCl로 초기 pH를 2, 7, 11로 조절한 산화 실험을 수행한 결과 pH에 따른 산화 효율에 차이가 없는 것으로 나타나 이후 실험에서 pH는 조절하지 않았다. 2,4-D의 초기농도는 0.1 mM, PS(0 - 20 mM), Fe2+(0 - 10 mM) 순으로 주입하였으며, Fe2+ 시약을 주입한 시점부터 산화 실험 시작으로 하였다. 실험용액이 담긴 바이알을 진탕배양기(Lab Tech, LSI-3016R, Korea)로 25±0.2oC, 175 rpm에서 진탕하였고, 시간에 따라 바이알을 꺼내 2 mL의 1 M n-butanol을 넣어 quenching 하였다(Chen et al., 2017). 산화 반응이 중지된 시료를 0.45-μm 시린지 필터(PTFE, Ф= 25 mm, Whatman, USA)로 여과 후 HPLC(high-performance liquid chromato- graphy, 2695 Alliance, Waters, USA)를 이용하여 2,4-D 농도를 분석하였다.
Fe(II)를 활성화제로 한 PS 산화 실험의 라디칼 규명을 위하여 scavenger 실험을 수행하였으며, 에탄올은 황산염라디칼(SO4•−), 수산화라디칼(•OH)에 모두 적합한 scavenger로, tert-butanol(TBA)은 hydroxyl radical(•OH)의 scavenger로 선정하여 실험하였다(Liang and Su, 2009). 2,4-D 초기농도는 0.1 mM, PS 농도 10 mM, Fe(II) 농도 2 mM로 고정하고, scavenger 주입 농도는 5 - 9 mM로 변화하여 실험하였다. Scavenger 실험 진행 후 2,4-D, Fe(II)의 농도를 분석하였다. 킬레이트제 및 하이드록실아민 첨가를 통한 PS 산화 효율 증가 효과를 확인하기 위한 실험을 수행하였으며, 킬레이트제로 EDTA, citric acid(CA), oxalic acid(OA), malic acid(MA)를 주입하였다. 킬레이트제 주입 영향 실험에서는 2,4-D 초기농도는 0.2 mM, PS 농도 10 mM, Fe(II) 농도 2 mM로 고정하고, 킬레이트제의 주입농도는 0 - 20 mM로 변화하여 실험하였다. 하이드록실아민(HA) 첨가 영향 실험에서는 2,4-D 초기농도는 0.1 mM, PS 농도 10 mM, Fe(II) 농도 2 mM로 고정하고, 하이드록실아민 주입 농도는 0 - 20 mM로 변화하여 실험하였다. 반응 후 2,4-D와 Fe(II) 농도를 측정하였다.
초기 pH 조절 여부와 관계없이 모든 산화 실험 후 pH는 2-3으로 감소되는 것을 확인하였으며, 이는 2,4-D와 SO4•− 라디칼이 반응하면서 수소 이온이 발생함에 따라 pH가 감소하는 것으로 설명할 수 있다(Liang et al., 2007).

2.3. 분석 방법
2,4-D 농도는 HPLC(2695 Alliance, Waters, USA)를 이용하여 분석하였으며, 검출기는 UV(2487 Dual absor- bance detector, Waters, USA)를 사용하였다. 컬럼은 SunFire® C18(4.6 × 250 mm, 5 μm particle size, Waters, USA), 이동상 조건은 2상(two phase) 농도 구배로 acetonitirile(CH3CN, Merck, 99.9%)과 10% 아세트산 함유 HPLC water(Merck, HPLC grade)의 비율을 75 : 25로 하였다. 유속은 0.7 mL/min, 시료 주입량은 20 μL, 파장 284 nm에서 측정하였다(Chen et al., 2017). PS와 Fe2+ 이온 농도는 각각 Liang et al.(2008)과 Kambhu et al.(2012)의 실험 방법을 따라 분광학적 분석법으로 측정하였다. PS 이온은 40 mL 암갈색 유리 바이알에 시료 0.5 mL와 0.2 g 탄산수소나트륨(sodium bicarbonate, NaHCO3, Duksan, 99.5%), 4 g 요오드화칼륨(Potassium iodide, KI, Duksan, 99.5%)를 넣고 총 40 mL로 하여 6시간 이상 발색 후 UV-Vis spectrophotometer(Agilent 8453, Agilent, USA)를 이용하여 400 nm에서 측정하였다. Fe2+ 이온은 50 mL 코니칼 튜브(polypropylene, #50050, SPL)에 시료 1 mL, 10 mL 0.01 M 1,10-phenanthroline (C12H8N2·H2O, Daejung, 99%)(in 50% ethanol), 5 mL 10% 염화하이드록실아민, 5 mL 아세트산 완충용액(pH 5)를 주입하여 혼합하고 2시간 이상 발색하여 UV-Vis spectrophotometer로 510 nm에서 측정하였다.
3.1. PS 및 Fe(II) 초기 농도 영향
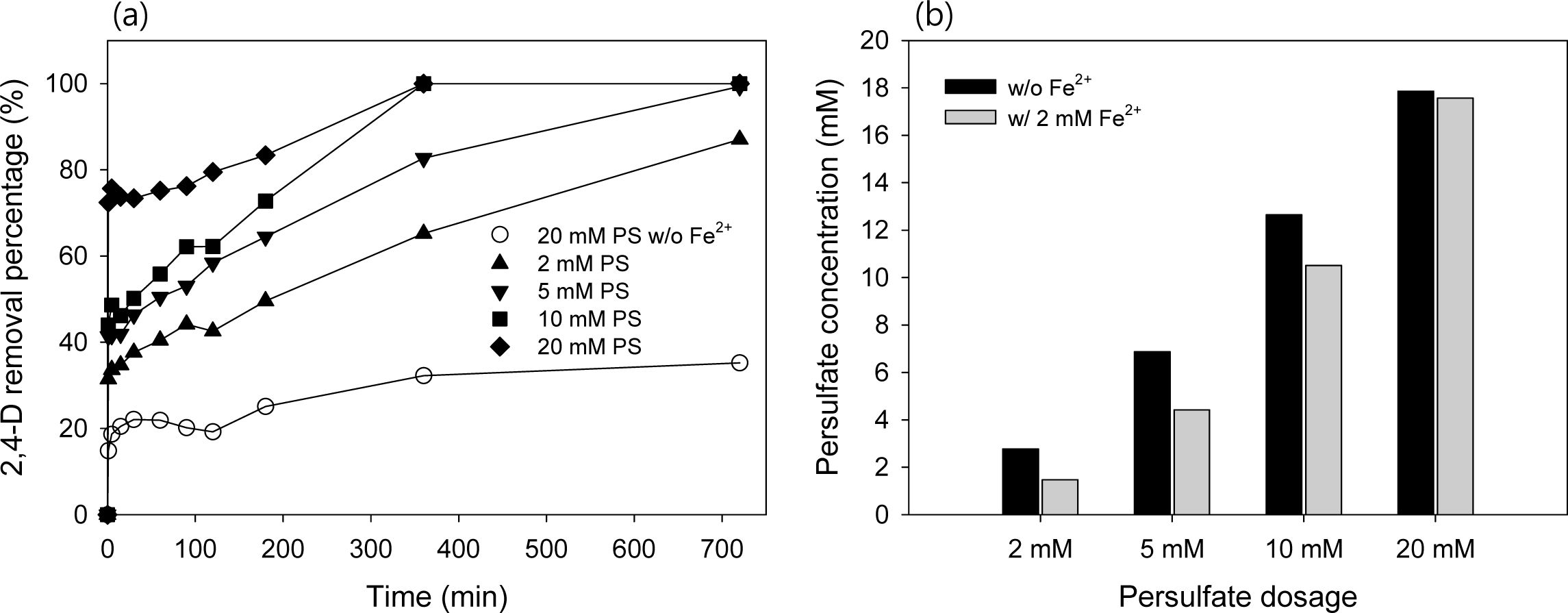
2,4-D 초기농도는 0.1 mM, Fe2+ 농도를 2 mM로 고정하고, PS 초기 농도를 2, 5, 10, 20 mM로 변화하여 2,4-D의 제거효율을 확인하였다(Fig. 1(a)). 20 mM PS만 주입했을 경우 35% 제거효율을 보였으나 Fe2+를 활성화제로 함께 주입하였을 때의 2,4-D의 제거효율은 PS 주입 농도가 증가할수록 87, 99, 100, 100%로 증가하였다. 이는 Fe2+에 의한 PS의 활성화 효과로 볼 수 있으며(식 (2) 참조)(Killian et al., 2007), PS만 주입된 경우보다 활성화제로 Fe2+가 함께 주입되었을 때 PS의 농도 소모가 더 큰 것으로 확인하였다(Fig. 1(b)). 이러한 결과는 Li et al.(2004)와 Liang et al.(2008)의 연구에서도 확인할 수 있으며, PS의 농도가 높아질수록 발생하는 SO4•− 라디칼의 양이 많아지게 되어 처리 효율이 증가한다.
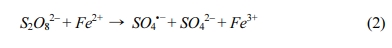
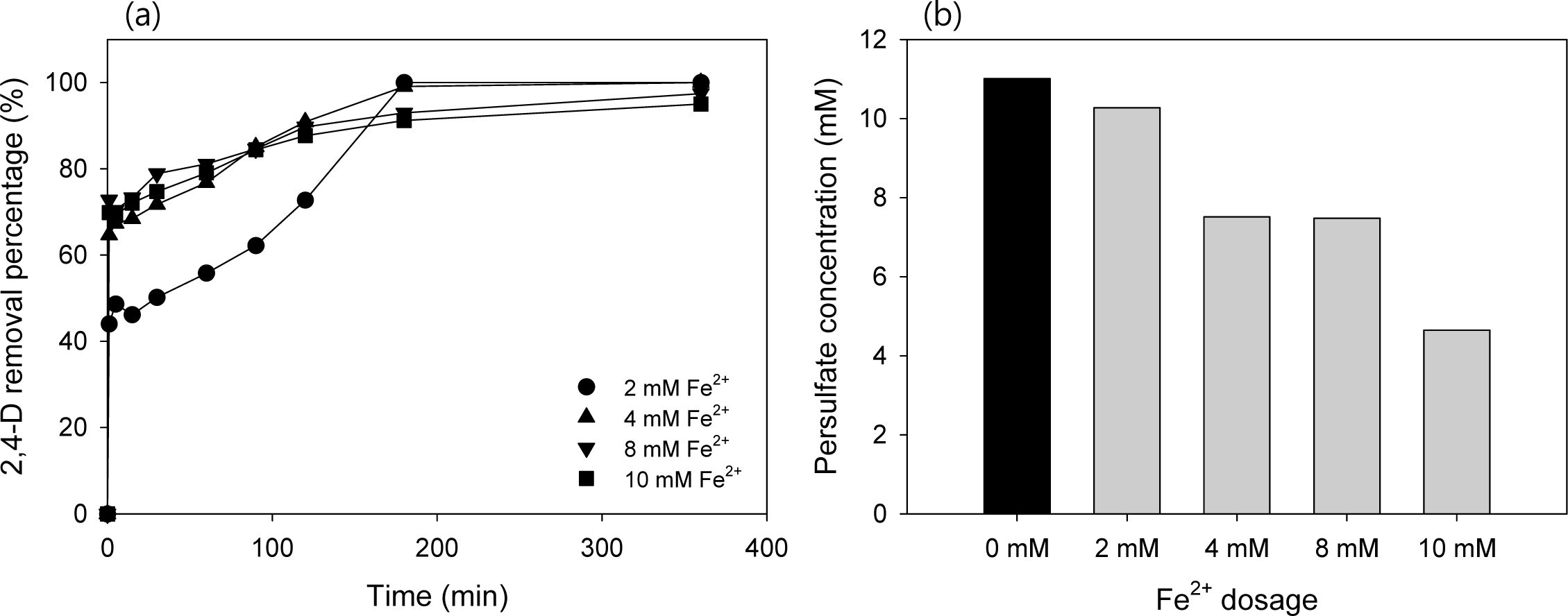
PS 농도 변화 실험 결과에서 5 mM, 10 mM, 20 mM PS의 최종 2,4-D 제거효율은 모두 100% 제거되어 큰 차이가 없는 것으로 나타났으나 5 mM은 720분, 10 mM과 20 mM은 반응 360분에서 최고 제거효율에 도달하는 것으로 나타나 최적 PS 농도는 10 mM로 하였다. 2,4-D 초기농도는 0.1 mM, PS 농도를 10 mM로 고정하고, Fe2+ 농도 변화(2, 4, 8, 10 mM)에 따른 2,4-D의 제거효율을 Fig. 2(a)에 나타내었다. 앞선 실험에서 반응시간은 360분으로 충분할 것으로 판단되어 이후 실험에서는 360분 동안 산화 실험을 수행하였다. Fe2+ 농도 2, 4 mM의 경우 반응시간 180분에서 최대 제거효율 100%에 도달하였으며, 8, 10 mM의 경우 360분 후 각각 제거효율 97, 95%로 나타났다. Fig. 2(b)의 Fe2+ 농도에 따른 PS 농도 변화를 보면, Fe2+가 주입되지 않은 경우 PS가 거의 소모되지 않는 것을 볼 수 있으며, 2 mM 주입시 0.7%, 4, 8 mM 주입시 31-32%, 10 mM 주입시 58% 소모되는 것을 알 수 있다. 이는 Fe2+의 주입 농도가 증가함에 따라 PS와의 반응이 증가하였고, PS가 Fe2+와 반응하여 PS 농도가 감소하면서 SO4•− 라디칼을 생성한 것으로 판단된다(Fig. 2(b)). 10 mM의 경우 PS 소모량은 가장 높으나 4 mM에 비해 낮은 제거효율을 보였으며, 2 mM과 4 mM의 경우 제거효율은 비슷하게 나타났으나 PS 소모량이 4 mM이 더 높게 나타나 최적 조건은 PS 10 mM, Fe2+ 4 mM이었다.
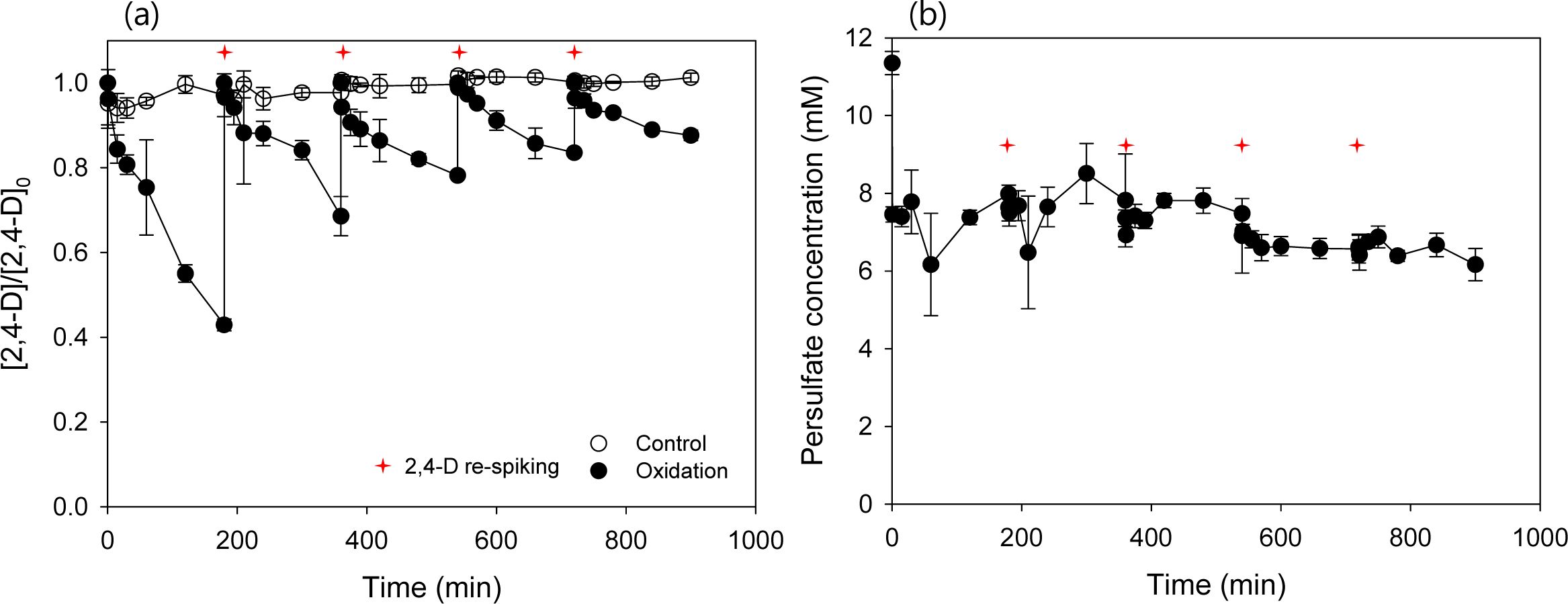
Fig. 2의 결과를 보면, 360분 산화반응 후 2,4-D가 100% 제거되었으나(Fig. 2(a)) PS는 남아있는 것을 볼 수 있으며(Fig. 2(b)), PS의 지속력을 확인하기 위한 실험을 수행하였다. 앞선 실험에서 도출한 최적 조건인 10 mM PS, 4 mM Fe2+ 조건 하에서 180분마다 0.1 mM의 2,4-D를 4회 추가 주입하여 2,4-D 농도를 측정하여 산화 효율을 평가하였으며 실험 결과는 Fig. 3에 나타내었다. 제거효율은 초기 제거효율 57%, 1회 재주입 31%, 2회 재주입 22%, 3회 재주입 16%, 4회 12%로 2,4-D의 주입 횟수가 늘어날수록 제거효율은 감소하나 2,4-D의 제거는 계속 일어났으며, PS 농도도 초반에 빠른 속도로 60% 가량 소모되고, 그 이후에는 조금씩 소모되는 것을 알 수 있었다. Amasha et al.(2018)의 연구에서도 동일한 결과가 나타난 것을 알 수 있으며, PS의 활성화에 이용 가능한 Fe2+ 농도가 PS 활성화에 주요한 영향 인자임을 알 수 있다.
3.2. 반응 라디칼 규명
Zhao et al.(2016)에 따르면, Fe2+에 의한 PS 활성화 반응에서 SO4•− 라디칼과 •OH 라디칼이 생성되어 산화 반응에 작용하는 것으로 알려져 있으며(식 (3)-(4)), 2,4-D 제거에서 주요한 반응 라디칼을 규명하기 위한 실험을 수행하였다. Table 2에 실험에 사용된 scavenger(에탄올, TBA)와 SO4•−, •OH 라디칼 간의 반응속도 상수를 나타내었다. 에탄올은 SO4•−, •OH 라디칼 모두에 적합한 scavenger이며, TBA는 •OH 라디칼과 더 높은 반응성을 나타내어 본 연구에서 scavenger로 선정하였다(식 (5)-(8) 참조)(Buxton et al., 1988; Anipsitakis and Dionysiou, 2004; Ji et al., 2014; Liang and Su, 2009; Monteagudo et al., 2011).

실험결과는 Table 2에 나타내었으며, scavenger인 에탄올과 TBA의 농도를 5 M로 하여 실험하였다. 반응시간 180분 후, scavenger를 주입하지 않은 경우 2,4-D의 제거효율은 73%로 나타났으며, 에탄올을 주입한 경우 2,4-D의 제거효율은 30%, TBA를 주입한 경우 39%로 감소하였다. TBA를 주입하여 •OH 라디칼을 scavenging한 결과 2,4-D의 제거효율이 39%로 나타난 것으로 보아 SO4•− 라디칼에 의한 제거효율이 34%, 에탄올 주입 결과에 SO4•− 라디칼, •OH 라디칼에 의한 제거효율이 43%임을 확인하였다. Scavenger에 의한 inhibition ratio를 식 (9)에 따라 계산해보면 에탄올에 의한 inhibition 효과가 59%, TBA에 의한 inhibition 효과가 46%로 나타났다(Fan et al., 2018). 이 결과를 통하여 SO4•− 라디칼에 의한 제거효율이 43%, •OH 라디칼에 의한 제거효율이 9% 차지한다고 볼 수 있으므로 SO4•− 라디칼이 주요 라디칼(predominant radical)임을 알 수 있다.
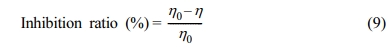
여기서 η0는 scavenger를 주입하지 않은 2,4-D 제거율(%), η는 scavenger를 주입한 2,4-D의 제거율(%)을 의미한다.
3.3. 하이드록실아민 주입의 영향
하이드록실아민 주입시 하이드록실아민이 Fe3+를 Fe2+로 환원시킴으로써 철의 이용성을 증가시키는 효과가 있다(Zou et al., 2013). 본 연구에서는 하이드록실아민을 실험 초기와 180분 산화반응 후 각각 주입하여 재활성(reactivation) 효과를 확인하였다. PS 산화 반응에서 하이드록실아민이 Fe3+가 축적되는 것을 막고, Fe2+로 빠르게 회복시키는 역할을 하여 산화 반응을 촉진한다(식 (10)-(13))(Liu et al., 2017; Wu et al., 2016).
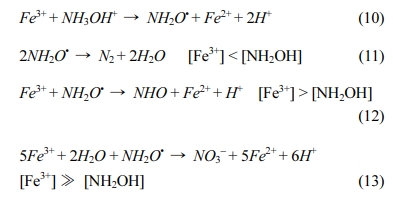
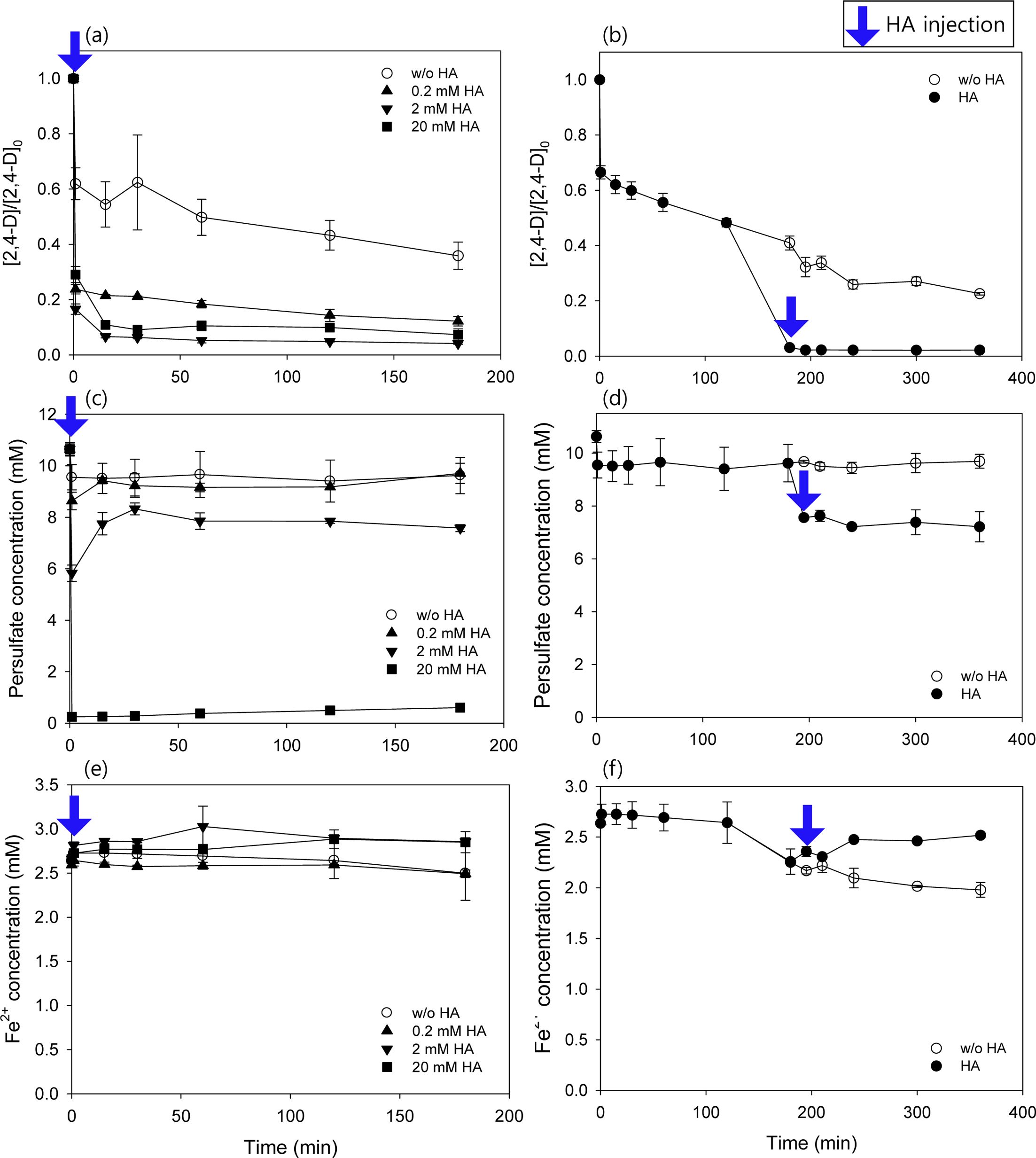
실험조건은 [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, [Fe2+]0 = 2 mM로 고정하고, 산화 시작 전 하이드록실아민 농도를 0.2, 2, 20 mM로 함께 주입하였다. Fe2+ 농도는 하이드록실아민 첨가 영향을 확인하기 위하여 최적 조건인 4 mM보다 적은 2 mM로 실험하였고, 실험결과를 Fig. 4(a), (c), (e)에 나타내었다. Fig. 4(a)를 보면 PS와 Fe2+의 첨가만으로는 2,4-D의 제거율이 64%였고, 첨가된 하이드록실아민 농도 0.2 mM에서 88%, 2 mM에서 96%, 20 mM에서 93%로 나타나 하이드록실아민이 첨가됨으로써 2,4-D의 제거효율이 25 – 30% 이상 증가한 것을 볼 수 있었다. Zou et al.(2013)은 Fe2+/PMS 공정에서 benzoic acid가 분해되는 동안 하이드록실아민의 첨가가 Fe3+에서 Fe2+로의 변환을 촉진할 수 있다고 보고하였으며, Watts and Teel(2006)을 비롯한 다수의 연구에서도 동일한 결과를 보였다(Oh et al., 2009; Huang et al., 2005; Yang et al., 2010; Gu et al., 2013). 그러나 20 mM의 하이드록실아민을 첨가하였을 때 오히려 2,4-D 제거효율이 감소한 것은 과량의 하이드록실아민이 PS를 환원시키고, SO4•− 라디칼과 반응하여 2,4-D 산화 반응을 방해하였기 때문이다. 이는 PS의 소모량이 급격히 증가한 실험 결과로도 확인할 수 있다(Fig. 4(c)). 또한 환원반응을 통해 생성된 •OH 라디칼이 서로 반응하여 소모되면서 Fe3+의 환원이 효과적으로 이루어지지 않기 때문이다(Han et al., 2014; Neta and Huie, 1988).
산화 실험 180분 후 하이드록실아민을 주입하여 산화 반응에서 산화되어 소모된 Fe2+의 재활성화 효과를 확인하기 위한 실험을 수행하였다. 실험 조건은 [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, [Fe2+]0 = 2 mM로 고정하고, 산화 실험 180분 후 하이드록실아민을 주입하였다. 하이드록실아민 주입 농도는 앞선 하이드록실아민 실험에서 가장 효과가 좋았던 2 mM로 하여 주입하였고, 실험결과를 Fig. 4(b), (d), (f)에 나타내었다. 2,4-D는 하이드록실아민을 주입한 180분에서 제거효율이 97%로 급격하게 증가하고(Fig. 4(b)), PS 농도 또한, 하이드록실아민을 주입한 시점에서 급격히 소모되며(Fig. 4(d)). Fe2+ 농도도 하이드록실아민이 주입된 후 증가하는 것을 확인할 수 있다(Fig. 4(f)). 본 실험결과를 통하여 하이드록실아민 첨가가 Fe3+에서 Fe2+로의 변환을 촉진하는 것을 확인하였다(Gu et al., 2013; Watts and Teel, 2006; Yang et al., 2010).
3.4. 킬레이트제 주입 영향
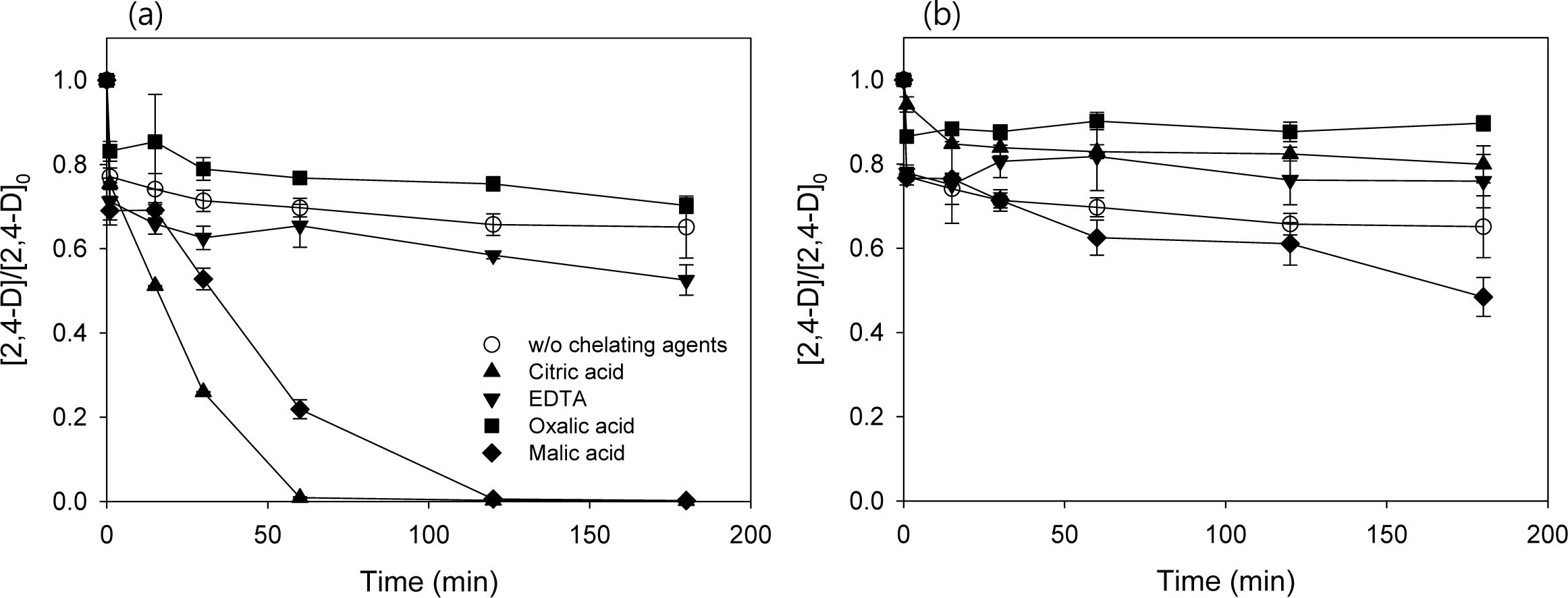
철 이온을 이용한 PS의 활성화 반응을 향상시키기 위하여 킬레이트제를 사용할 수 있으며, 본 연구에서는 PS 산화시 킬레이트제/유기산의 첨가가 Fe2+-EDTA 킬레이트와 Fe2+-유기산 착물(complex) 형성과 그에 따른 PS 산화에의 영향을 살펴보고자 하였다. 산화 실험 조건은 [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, [Fe2+]0 = 2 mM로 고정하고 킬레이트제를 첨가하여 수행하였으며, 실험 결과를 Fig. 5에 나타내었다. PS와 Fe2+만 첨가한 경우는 2,4-D의 제거효율이 40%였으나 Fig. 5(a)를 보면 2 mM CA, MA 주입시 반응시간 180분 경과 후 99% 제거되는 것으로 나타났다. 이는 CA와 MA의 첨가가 2,4-D의 제거에 대한 Fe2+/PS 산화의 산화 능력을 향상시킨 것을 나타낸다. 킬레이트제 첨가가 2,4-D의 제거효율을 향상시키는 이유는 수용액에서 착물화된 Fe3+의 안정성 증가와 관련이 있다. 유기산의 첨가는 철이 침전되는 것을 방지하고 가용성 Fe3+의 농도를 증가시켜서 Fe2+와 •OH 라디칼의 연속 생성을 일으킨다(Miao et al., 2015). 20 mM의 CA가 주입되었을 때 제거효율 20%로 제거효율이 감소하였고 이는 과량의 킬레이트 효과의 영향으로 볼 수 있으며, 수산화라디칼을 빠르게 소진함으로써 유기 화합물의 분해를 억제하였다고 판단할 수 있다(Xue et al., 2009). 이러한 결과는 OA 주입에서도 볼 수 있는데 2 mM OA 주입시 30%, 20 mM 주입시 10%로 과량의 킬레이트 효과로 라디칼이 소진되어 2,4-D 제거를 저해하였다.
킬레이트제로 EDTA를 첨가 실험 결과 2 mM을 첨가한 경우 47%, 20 mM 첨가한 경우 24%로 나타나 PS와 Fe2+만 주입한 경우 보다 EDTA 주입시 2,4-D의 제거효율 증가 효과가 거의 없거나 오히려 감소된 것을 볼 수 있었다(Chen et al., 2009). PS 산화 시 과량의 EDTA가 2,4-D와 경쟁하여 2,4-D의 산화 처리를 방해하기 때문이다(Venny et al., 2012; Dong et al., 2017). Aminocar- boxylate 계열인 EDTA와 결합한 Fe2+의 경우 과량의 EDTA가 Fe2+와 부피가 큰(bulky) 6배위(hexacoordinated) 화합물을 형성하여 PS 활성을 저해한다(Han et al., 2015). CA, OA와 같이 짧은 탄소 체인을 가진 작은 분자 크기의 킬레이트제는 EDTA보다 PS와 Fe2+ 활성을 방해하는 효과가 적으므로 같은 비율로 주입하였을 때 2,4-D 제거효율 증가 효과가 더 높은 것으로 나타났다(Wang et al., 2019).
|
Fig. 1 Effect of PS dosage on (a) 2,4-D degradation and (b) PS degradation (after 720 min). Conditions: [2,4-D]0= 0.1 mM, [PS]0= 2, 5, 10, 20 mM, and [Fe2+]0= 2 mM. |
|
Fig. 2 Effect of Fe2+ dosage on (a) 2,4-D degradation and (b) PS degradation (after 360 min). Conditions: [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, and [Fe2+]0 = 2, 4, 8, 10 mM. |
|
Fig. 3 Effect of 2,4-D re-spiking on the Fe2+ activated PS oxidation (a) 2,4-D degradation, (b) PS degradation. Conditions: [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, and [Fe2+]0 = 4 mM. |
|
Fig. 4 Effects of the hydroxylamine (HA) adding times on (a)(b) 2,4-D degradation, (c)(d) persulfate degradation, (e)(f) Fe2+ degradation. Conditions: [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, [Fe2+]0 = 2 mM, and [HA]0 = 0.2, 2, 20 mM. |
|
Fig. 5 2,4-D degradation for Fe2+ activated persulfate oxidation in the presence of chelating agents (CA. EDTA. OA, and MA) (a) 2 mM chelating agents, (b) 20 mM chelating agents. Conditions: [2,4-D]0 = 0.1 mM; [PS]0 = 10 mM; [Fe2+]0 = 2 mM and [chelating agent]0= 0.2, 2, 20 mM. |
|
Table 2 The removal percentage of 2,4-D by Fe2+ activated PS oxidation in the presence and absence of radical scavengers |
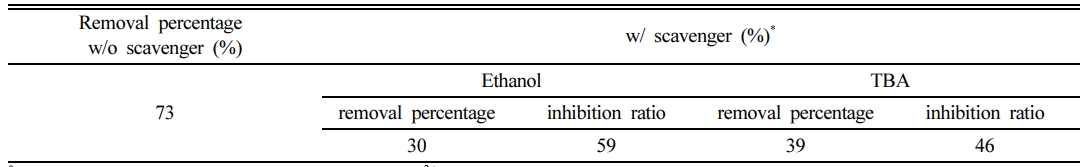
* Conditions: [2,4-D]0 = 0.1 mM, [PS]0 = 10 mM, [Fe2+]0 = 4 mM and [scavenger]0= 5 M. |
본 연구는 화학작용제에 의한 수계 오염 처리를 위하여, Fe2+를 활성화제로 한 PS 산화시 하이드록실아민과 킬레이트제의 첨가에의 영향을 평가하였으며, 다음과 같은 결론을 도출하였다.
1) 수계내 2,4-D의 처리를 위하여, Fe2+를 활성화제로 한 PS 산화시 PS 농도 2, 5, 10, 20 mM로 수행한 결과 농도가 높을수록 제거효율이 높게 나타났다. Fe2+ 농도 변화 실험의 경우 Fe2+ 농도 2, 4, 8, 10 mM로 실험한 결과 최종 360분 후 제거효율의 차이는 없었으나 Fe2+ 농도가 증가할수록 PS 소모량이 증가하여 SO4•- 라디칼이 더 많이 생성되는 것을 확인하였다. PS 지속력을 확인하기 위하여 2,4-D를 4회 재주입한 결과, 주입횟수가 증가할수록 제거 효율은 크지 않았으나 제거는 계속되는 것을 알 수 있었으며, PS 소모량의 변화가 없는 것으로 보아 활성화제인 Fe2+의 농도가 중요한 인자임을 알 수 있었다.
2) Fe2+를 활성화제로 한 PS 산화시 라디칼의 반응 메커니즘을 규명하기 위하여 에탄올과 TBA를 scavenger로 사용한 실험을 수행하였다. 에탄올은 SO4•− 라디칼과 •OH 라디칼 모두에 작용하는 scavenger이고, TBA는 •OH 라디칼과 더 높은 반응성을 나타내는 scavenger로 이용한 실험결과 PS 산화시 SO4•− 라디칼과 •OH 라디칼이 모두 작용하며, SO4•− 라디칼이 더 주요한 라디칼임을 확인하였다.
3) 하이드록실아민의 Fe2+ 재생(regeration) 효과를 확인하였다. PS와 Fe2+의 산화에서 2,4-D의 제거효율이 64%였으나, 하이드록실아민 주입 농도가 증가할수록 0.2 mM에서는 88%, 2 mM에서는 96%, 20 mM에서는 93%로 증가하여 하이드록실아민이 첨가로 산화효율이 25-30% 이상 증가하였다. PS 산화에 Fe2+와 킬레이트제의 결합이 산화에 미치는 영향에 대한 실험을 수행한 결과, 킬레이트제(CA, EDTA, OA, MA)의 종류에 따라 다른 결과를 보였으며, CA와 MA의 경우 2 mM 주입시 산화효율을 증가시켰으나 20 mM 주입시 산화 효율이 저해되었고, EDTA와 OA는 모든 실험 조건에서 거의 효과가 없거나 저해되는 결과를 보였다. 이는 킬레이트제가 과량으로 존재할 경우 2,4-D와 킬레이트제가 경쟁하거나 라디칼을 소모하여 산화 효율을 저해시킨 결과로 판단된다.
이 논문은 2019학년도 경북대학교 연구년 교수 연구비에 의하여 연구되었음.
- 1. Amasha, M., Baalbaki, A., and Ghauch, A., 2018, A comparative study of the common persulfate activation techniques for the complete degradation of an NSAID: The case of ketoprofen, Chem. Eng. J., 350, 395-410.
-

- 2. Anipsitakis, G.P. and Dionysiou, D.D., 2004, Radical generation by the interaction of trasition metals with common oxidants, Environ. Sci. Technol., 38(13), 3705-3712.
-

- 3. Bartelt-Hunt, S.L., Barlaz, M.A., Knappe, D.R., and Kjeldsen, P., 2006, Fate of chemical warfare agents and toxic industrial chemicals in landfills, Environ. Sci. Technol., 40(13), 4219-4225.
-

- 4. Bigley, A.N., Xu, C., Henderson, T.J., Harvey, S.P., and Raushel, F.M., 2013, Enzymatic neutralization of the chemical warfare agent VX: Envolution of phosphotriesterase for phosphorithiolate hydrolysis, J. Am. Chem. Soc., 135(28), 10426-10432.
-

- 5. Buxton, G.V., Greenstock, C.L., Helman, W.P., and Ross, A.B., 1988, Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (•OH/•O-) in aqueous solution, J. Phys. Chem., 17, 513-531.
-

- 6. Candel, I., Marcos, M.D., Martínez-MáÁñez, R., Sancenón, F., Costero, A.M., Parra, M., Gil, S., Guillem, C., Pérez-Plá, F., and Amorós, P., 2015, Hydrolysis of DCNP (a Tabun mimic) catalysed by mesoporous silica nanoparticles, Microporous Mesoporous Mater., 217, 30-38.
-

- 7. Chauhan, S., Chauhan, S., D¡¯Cruz, R., Faruqi, S., Singh, K.K., Varma, S., Singh, M., and Karthik, V., 2008, Chemical warfare agents, Environ. Toxicol. Pharmcol., 26(2), 113-122.
-

- 8. Chen, F., Li, Y., Guo, L., and Zhang, J., 2009, Strategies comparison of eliminating the passivation of non-aromatic intermediates in degradation of Orange II by Fe3+/H2O2, J. Hazard. Mater., 169(1-3), 711-718.
-

- 9. Chen, H., Zhang, Z., Feng, M., Liu, W., Wang, W., Yang, Q., and Hu, Y., 2017, Degradation of 2,4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite), Chem. Eng. J., 313, 498-507.
-

- 10. Chen, P.K., Polatnick, M., and Leather, G., 1991, Comparative study on artemisinin, 2,4-D, and glyphosate, J. Agrlc. Food Chem., 39(5), 991-994.
-

- 11. De Luca, A., Dantas, R.F., and Esplugas, S., 2014, Assessment of iron chelates efficiency for photo-Fenton at neutral pH, Water Res., 61, 232-242.
-

- 12. Dong, H., He, Q., Zeng, G., Tang, L., Zhang, L., Xie, Y., Zeng, Y., and Zhao, F., 2017, Degradation of trichloroethene by nanoscale zero-valent iron (nZVI) and nZVI activated persulfate in the absence and presence of EDTA, Chem. Eng. J., 316, 410-418.
-

- 13. Dulova, N., Kattel, E., and Trapido, M., 2017, Degradation of naproxen by ferrous ion-activated hydrogen peroxide, persulfate and combined hydrogen peroxide/persulfate processes: The effect of citric acid addition, Chem. Eng. J., 318, 254-263.
-

- 14. Fan, J., Gu, L., Wu, D., and Liu, Z., 2018, Mackinawite (FeS) activation of persulfate for the degradation of p-chloroaniline: Surface reaction mechanism and sulfur-mediated cycling of iron species, Chem. Eng. J., 333, 657-664.
-

- 15. Giannakoudakis, D.A., Farahmand, N., ¨©omot, D., Sobczak, K., Bandosz, T.J., and Colmenares, J.C., 2020, Ultrasound-activated TiO2/GO-based bifunctional photoreactive adsorbents for detoxification of chemical warfare agent surrogate vapors, Chem. Eng. J., 395, 125099.
-

- 16. Gu, X.G., Lu, S.G., Li, L., Qiu, Z.F., Sui, Q., and Lin, K.F., 2011, Oxidation of 1,1,1-trichloroethane stimulated by thermally activated persulfate, Ind. Eng. Chem. Res., 50(19), 11029-11036.
-

- 17. Gutch, P.K., Mazumder, A., and Raviraju, G., 2016, Oxidative decontamination of chemical warfare agent VX and its simulant using N,N-dichlorovaleramide, RCS Adv., 6, 2295-2301.
-

- 18. Han, D., Wan, J., Ma, Y., Wang, Y., Huang, M., Chen, Y., Li, D., Guan, Z., and Li, Y., 2014, Enhanced decolorization of orange G in a Fe(II)-EDDS activated persulfate process by accelerating the regeneration of ferrous iron with hydroxylamine, Chem. Eng. J., 256, 316-323.
-

- 19. Hart, J., 2009, Backgroud to selected environmental and human health effects of chemical warfare agents, T.A. Kassim, D. Barceló(ed.), Environmental Consequences of War and Aftermanth. The handbook of Environmental Chemistry, vol. 3U. Springer, pp. 1-19.
-

- 20. Huang, K.C., Zhao, Z.Q., Hoag, G.E., Dahmania, A., and Block, P.A., 2005, Degradation of volatile organic compounds with thermally activated persulfate oxidation, Chemosphere, 61(4), 551-560.
-

- 21. IARC (International Agency for Research on Cancer), 2015. World Health Organization, Press Release No 236. IARC Monographs evaluate DDT, lindane, and 2,4-D, www.iarc.fr/en/media-centre/pr/2015/pdfs/pr236_E.pdf.
- 22. Ji, Y., Ferronato, C., Salvador, A., Yang, X., and Chovelon, J.-M., 2014, Degradation of ciprofloxacin and sulfamethoxazole by ferrous-activated persulfate: Implications for remediation of groundwater contaminated by antibiotics, Sci. Total Environ., 472, 800-808.
-

- 23. Jung, W.Y., 2004, A study on the verification and disposal of chemical weapons declaration by North Korea, Defense policy research report 04-09, Korea Research Institute for Strategy, pp.2-108.
- 24. Killian, P.F., Bruell, C.J., Liang, C., and Marley, M.C., 2007, Iron(II) activated persulfate oxidation of MGP contaminated soil, Soil Sediment Contam., 16(6), 523-537.
-

- 25. Kim, K., 2007, Weapons of Mass Destruction, Ministry of Defense, Seoul, Korea.
- 26. Kim, H.-S., Do, S.-H., Park, K.-M., Jo, Y.-H., and Kong, S.-H., 2012, Degradation of TCE by persulfate oxidation with various activation methods (heat, Fe2+, and UV) for ex-situ chemical oxidation processes, J. Soil Groundwater Env., 17(6), 43-51.
-

- 27. KRICT (Korea Research Institute of Chemical Technology), 2002, Research Planning Report on Confrontation to Chemical and Biological Terror, M102EA000001-02E010000100, Ministry of Science and ICT, Sejong, Korea.
- 28. Kwon, J., Jung, H., Jung, H., and Lee, J., 2020, Micro/nanostructured coating for cotton textiles that repel oil, water, and chemical warfare agents, Polymers, 12(8), 1826.
-

- 29. Lee, D.T., Zhao, J., Oldham, C.J., Peterson, G.W., and Parsons, G.N., 2017, UiO-66-NH2 metal-organic framework (MOF) nucleation on TiO2, ZnO, and Al2O3 atomic layer deposition-treated polymer fibers: role of metal oxide on MOF growth and catalytic hydrolysis of chemical warfare agent simulants, ACS Appl. Mater. Interfaces, 9(51), 44847-44855.
-

- 30. Li, K., Stefan, M.I., and Crittenden, J.C., 2004, UV photolysis of trichloroethylene: product study and kinetic modeling, Environ. Sci. Technol., 38(24), 6685-6693.
-

- 31. Liang, C., Huang, C.F., and Chen, Y.J., 2008, Potential for activated persulfate degradation of BTEX contamination, Water Res., 42(15), 4091-4100.
-

- 32. Liang, C. and Su, H.W., 2009, Identification of sulfate and hydroxyl radicals in thermally activated persulfate, Ind. Eng. Chem. Res., 48(11), 5558-5562.
-

- 33. Liu, G., Li, X., Han, B., Chen, L., Zhu, L., and Campos, L.C., 2017, Efficient degradation of sulfamethoxazole by the Fe(II)/HSO5− process enhanced by hydroxylamine: Efficiency and mechanism, J. Hazard. Mater., 322(Part B), 461-468.
-

- 34. Long, J.W., Chervin, C.N., Balow, R.B., Jeon, S., Miller, J.B., Helms, M.E., Owrutsky, J.C. Rolison, D.R., and Fears, K.P., 2020, Zirconia-based aerogels for sorption and degradation of dimethyl methylphosphonate, Ind. Eng. Chem. Res., 59(44), 19584-19592.
-

- 35. Meselson, M., 2017, From Charles and Francis Darwin to Richard Nixon: The origin and termination of anti-plant chemical warfare in Vietnam, B. Friedrich, D. Hoffmann, J. Renn, F. Schmaltz, M. Wolf(ed.), One Hundred Years of chemical Warfare: Research, Deployment, Consequences, Springer Nature, pp. 335-348.
-

- 36. Miao, Z., Gu, X., Lu, S., Brusseau, M.L., Zhang, X., Fu, X., Danish, M., Qiu, Z., and Sui, Q., 2015, Enhancement effects of chelating agents on the degradation of tetrachloroethene in Fe(III) catalyzed percarbonate system, Chem. Eng. J., 281, 286-294.
-

- 37. MOE (Ministry of Environment), 2019, Framework Act on Water Management, Sejong, Korea.
- 38. Monteagudo, J.M., Duran, A., Martin, I.S., and Carnicer, A., 2011, Role of different intermediate active species in the mineralization reactions of phenolic pollutants under a UV-A/C photo-Fenton process, Appl. Catal. B Environ., 106(1-2), 242-249.
-

- 39. Moon, S.-Y., Wagner, G.W., Mondloch, J.E., Peterson, G.W., DeCoste, J.B. Hupp, J.T., and Farha, O.K., 2015, Effective, facile, and selective hydrolysis of the chemical warfare agent VX using Zr6-based metal-organic frameworks, Inorg. Chem., 54(22), 10829-10833.
-

- 40. Nawata, J., Zóźwik, P., and Popiel, S., 2019, Thermal and catalytic methods used for destruction of chemical warfare agents, Int. J. Environ. Sci. Techol., 16, 3899-3912.
-

- 41. Neta, P. and Huie, R.E., 1998, Rate constants for reactions of inorganic radicals in aqueous solution, J. Phys. Chem. Ref. Data, 17, 1027-1284.
-

- 42. Oh, S.-Y., Kim, H.-W., Park, J.-M., Park, H.-S., and Yoon, C., 2009, Oxidation of polyvinyl by persulfate activated with heat, Fe2+ and zero-valent iron, J. Hazard. Mater., 168(1), 346-351.
-

- 43. Osovsky, R., Kaplan, D., Nir, I., Rotter, H., Elisha, S., and Columbus, I., 2014, Decontamination of adsorbed chemical warfare agents on activated carbon using hydrogen peroxide solutions, Environ. Sci. Technol., 48(18), 10912-10918.
-

- 44. Smolkin, B., Levi, N., Karton-Lifshin, N., Yehezkel, L., Zafrani, Y., and Columbus, I., 2018, Oxidative detoxificiation of sulfur-containing chemical warfare agents by electrophilic iodine, J. Org. Chem., 83(22), 13949-13955.
-

- 45. Ploskonka, A.M. and DeCoste, J.B., 2019, Insight into organophosphate chemical warfare agent simulant hydrolysis in metal-organic frameworks, J. Hazard. Mater., 375, 191-197.
-

- 46. Škarohlíd, R., McGachy, L., Martinec, M., and Rošková, Z., 2020, Removal of PCE/TCE from groundwater by peroxydisulfate activated with citric acid chelated ferrous iron at 13¡ÆC, Environ. Technol. Innov., 19, 101004.
-

- 47. Sohn, H., Létant, S., Sailor, M.J., and Trogler, W.C., 2000, Detection fluorophosphonate chemical warfare agents by catalytic hydrolysis with a porous silicon interferometer, J. Am. Chem. Soc., 122(22), 5399-5400.
-

- 48. Wang, S., Pomerantz, N.L., Dai, Z., Xie, W., Anderson, E.E., Miller, T., Khan, S.A., and Parsons, G.N., 2020, Polymer of intrinsic microporosity (PIM) based fibrous mat: combining particle filtration and rapid catalytic hydrolysis of chemical warfare agent simulants into a highly sorptive, breathable, and mechanically robust fiber matrix, Mater. Today Adv., 8, 100085.
-

- 49. Venny, Gan, S., and Ng, H.K., 2012, Inorganic chelated modified-Fenton treatment of polycyclic aromatic hydrocarbon(PAH)-contaminated soils. Chem. Eng. J., 180, 1-8.
-

- 50. Wagner, G.W. and Yang, Y.C., 2002, Rapid nucleophilic/oxidative decontamination of chemical warfare agents, Ind. Eng. Chem. Res., 41(8), 1925-1928.
-

- 51. Wang, Z., Qiu, W., Pang, S., and Jiang, J., 2019, Effect of chelators on the production and nature of the reactive intermediates formed in Fe(II) activated peroxydisulfate and hydrogen peroxide processes, Water Res., 164, 114957.
-

- 52. Watts, R.J. and Teel, A.L., 2006, Treatment of contaminated soils and groudnwater using ISCO, Pract. Period. Hazard. Toxic Radioact. Waste Manag., 10(1), 2-9.
-

- 53. Wu, X., Gu, X., Lu, S., Qiu, Z., Sui, Q., Zang, X., Miao, Z., Xu, M., and Danish, M., 2016, Accelerated degradation of tetrachloroethylene by Fe(II) activated persulfate process with hydroxylamine for enhancing Fe(II) regeneration, J. Chem. Technol. Biotechnol., 91(5), 1280-1289.
-

- 54. Yang, S.Y., Wang, P., Yang, X., Shan, L., Zhang, W.Y., Shao, X.T., and Niu, R., 2010, Degradation efficiencies of azo dye Acid Orange 7 by the interaction of heat, UV and anions with common oxidants: persulfate, peroxymonosulfate and hydrogen peroxide, J. Hazard. Mater., 179(1-3), 552-558.
-

- 55. Zhao, L., Ji, Y., Kong, D., Lu, J., Zhou, Q., and Yin, X., 2016, Simultaneous removal of bisphenol A and phosphate in zero-valent iron activated persulfate oxidation process, Chem. Eng. J., 303, 458-466.
-

- 56. Zou, J., Ma, J., Chen, L., Li, X., Guan, Y., Xie, P., and Pan, C., 2013, Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine, Environ. Sci. Technol., 47(20), 11685-11691.
-

 This Article
This Article
-
2021; 26(1): 54-64
Published on Feb 28, 2021
- 10.7857/JSGE.2021.26.1.054
- Received on Feb 2, 2021
- Revised on Feb 3, 2021
- Accepted on Feb 9, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Won Sik Shin
-
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- E-mail: wshin@knu.ac.kr






