- Assessment on Zn Treatment Characteristics of Alum Sludge-based Adsorbent
Dae-Gyu Im1, Duk-Min Kim2*, Hye-Lim Kwon2, Ki-Rim Lee2, Joon-Hak Lee3, and Seong-Taek Yun1
1Department of Earth and Environmental Sciences, Korea University, Seoul 02841, Republic of Korea
2Department of New Energy and Mining Engineering, Sangji University, Wonju 26339, Republic of Korea
3Korea Mine Rehabilitation and Mineral Resources Corporation (KOMIR), Wonju 26464, Republic of Korea- 알럼 슬러지 기반 흡착제의 Zn 처리 특성 평가
임대규1ㆍ김덕민2*ㆍ권혜림2ㆍ이기림2ㆍ이준학3ㆍ윤성택1
1고려대학교 지구환경과학과
2상지대학교 신에너지·자원공학과
3한국광해광업공단This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Zinc present in mine drainage, wastewater, and contaminated groundwater is difficult to treat using conventional passive treatment technologies. This study evaluated an alum sludge-based adsorbent through column and batch experiments, including adsorption kinetics, isotherms, and pH edge analysis. Over 341 days, the column experiment reduced Zn concentrations (4.6 – 6.4 mg/L) to below 1 mg/L within a 4-hour residence time, meeting effluent standards. The breakthrough point was observed at approximately 1,432 bed volumes, corresponding to 9 months of operation. The adsorbent increased pH, likely due to the adsorption of H+ ions, and facilitated the precipitation of Zn as hydroxides on its surface. Even if the surface precipitation effect was excluded, the maximum adsorption capacity was calculated to be 5.5 mg/g. Therefore, this adsorbent, recycled from alum sludge, is expected to efficiently treat Zn in adsorption reactors and permeable reactive barriers.
Keywords: Zinc removal, Adsorption kinetics, Breakthrough point, pH adsorption edge, Surface precipitation
아연은 광산 개발, 강철 생산, 석탄 연소와 같은 산업활동으로 인해 환경으로 유입된다. 아연은 색소, 살충제, 화장품, 의약품, 아연도금, 페인트 등에 고농도로 존재하며, 이의 제조 및 처리 과정과 자원 개발 등에 의해 아연으로 오염된 지표수와 지하수는 환경과 생물의 건강에 악영향을 미친다(Bhattacharya et al., 2006; Wan Ngah et al., 2008; Wang and Peng, 2010; Fu and Wang, 2011; Kiran and Thanasekaran, 2011; Jangyasuthiwong et al., 2015). 아연은 인체에 필수적인 원소이며 미량 영양소로 작용하지만(Sun et al., 2017), 고농도의 아연 섭취는 메스꺼움, 구토, 무기력, 경구통 등을 유발할 수 있다(Fosmire, 1990).
용존 아연은 수산화물 석출을 위하여 약 8.5 이상의 pH 조건이 필요하나, 석회석 반응을 이용하여 pH를 8 이상 증가시키기 어려우므로 석회석을 이용한 자연정화공법으로 제거하기 어렵다. 최근 적용되고 있는 또다른 광산배수 자연정화 공법인 생물반응조에서는 황산염 환원균을 활용하는데, 이는 혐기성 조건에서 황산이온을 황화수소로 환원시키는 미생물로서(Lens and Kuenen, 2001; Liang and Zhao, 2013; Janyasuthiwong et al., 2015), 생성된 황화수소가 용액 중의 중금속 이온과 반응하여 침전 제거한다. 따라서, 아연을 포함하여 구리, 니켈, 철, 카드뮴 등의 생물반응조 처리에 대한 연구가 다수 진행되어 왔다(Yoo et al., 2006; Kim et al., 2018). 그러나, 이러한 공법은 동절기에 효율이 크게 저감되는 단점이 있어, 이를 대체하는 비교적 단순하고 경제적인 자연정화방식 흡착처리 공법이 필요하다. 게다가, 제련소 부지 등에서 유출 가능한 오염지하수를 지중에서 정화하기 위한 투수성반응벽체(PRB; permeable reactive barrier) 매질의 개발 필요성이 있다.
한편, 정수장에서 응집제로 사용되는 알루미늄염(Al2(SO4)3, 황산알루미늄)은 물속의 OH-와 반응하여 Al(OH)3(알루미늄 수산화물)을 형성하며, 이는 알럼 기반 슬러지의 주요 성분이 된다. 이 과정에서 유기물, 부식질 입자, 콜로이드성 부유 물질 등이 결합하여 알럼 슬러지가 생성된다(Ippolito et al., 2011; Kim et al., 2012; Hua et al., 2018; Kumar et al., 2020; Jo et al., 2021). 이로부터 생성된 알루미늄 수산화물은 영전하점(point of zero charge, PZC)이 낮지 않아 표면이 음전하로 대전된 점토를 비교적 용이하게 응집시킬 수 있다. 또한, Zn은 알루미놀(aluminol) 사이트에서 철 하이드록실(iron hydroxyl) 사이트보다 더 잘 흡착되는 것으로 나타났으며(Coston et al., 1995), 이는 Al(OH)3가 Zn의 흡착에 있어 주요 활성 사이트로 작용할 가능성을 시사한다. 게다가, 알럼 기반 슬러지는 정수 과정에서 대량으로 발생하는 폐기물로, 이에 대한 효과적인 재활용 방안의 개발이 요구되고 있다. 이에 따라, 본 연구에서는 정수장에서 발생한 알럼 기반 슬러지를 활용하여 제작한 흡착제를 이용해 용존 아연 제거 효율 및 기작을 평가하였다.
2.1. 흡착제 및 시약
㈜태성공영에서 공급받은 알럼 기반 흡착제는 정수처리시설에서 채취한 알럼 기반 슬러지를 타 원료와 배합하여 수열합성 과정을 거친 후에 대기중에서 500oC로 열처리하여 제조하였으며, 입경은 약 3 mm인 황갈색이다(Fig. 1). WD-XRF 분석 결과 주성분은 알루미늄인 것으로 나타났으며, 영전하점을 분석한 결과 5.25인 것으로 나타났다(KOMIR, 2021). 그리고 흡착제의 흡착능에 큰 영향을 미치는 요인 중 하나인 비표면적(BET)은 136.34 m2/g으로 측정되었다(KOMIR, 2021). 흡착제의 밀도는 1.29 g/mL이었다.
원수 내 Zn은 ZnSO4·7H2O(EP grade, 대정화금), 순도 99% 시약을 증류수에 용해시켜 실험에 따라 다양한 농도로 조성하였는데, 광산배수의 조성을 모사하기 위하여 황산염 시약을 적용하였다.
2.2. 흡착반응속도 실험
Zn 흡착 실험은 흡열 반응 특성(Paj¹k, 2023)을 고려하여 온도 증가에 따른 흡착 능력의 과대 및 과소 평가를 방지하기 위해, 모든 회분식 실험을 25oC의 항온 진탕기(창신과학, C-SKI-4)에서 교반하여 진행하였다. Zn 농도 15.7 mg/L 용액 50 mL와 흡착제 4 g을 각각 현대마이크로사의 50 mL 코니컬 튜브에 투입한 뒤, 뚜껑을 닫고 주변을 파라필름으로 밀봉하여 반응 중 대기와의 접촉을 최소화하였다. 이 튜브는 항온 진탕기에서 100 rpm으로 교반시켰으며, 1, 3, 5, 8, 15, 25, 50, 105, 180분 후에 채수하여 분석하였다.
Zn 흡착량 도출 결과에 대하여 유사 1차 반응속도 모델(pseudo-first-order kinetic model)과 유사 2차 반응속도 모델(pseudo-second-order kinetic model)을 사용하여 반응속도를 평가하였다.
유사 1차 반응속도식은 흡착제와 흡착질 간 반응속도와 평형 흡착량의 관계를 설명하기 위해 제안되었다. 식 (1)과 (2)에서 k1은 1차 반응속도 상수(L/min), t 는 반응시간(min), qe는 평형 흡착량(mg/g), qt는 반응시간 t에서의 흡착량(mg/g)을 의미한다(Lagergren, 1898).

한편, 유사 2차 반응속도식은 식 (3) 및 (4)와 같이 나타낼 수 있다. 여기에서 k2는 2차 반응속도 상수(g/mg·min)를 의미한다(Ho and Mckay, 1998).

2.3. Zn 농도 조건에 따른 pH 증가 및 제거 효율 실험
알럼 슬러지 기반 흡착제의 pH 증가 및 아연 제거 특성을 평가하기 위해 다양한 Zn 농도 조건에서 실험을 수행하였으며, 반응기는 유리 재질의 삼각플라스크(동성과학, 250 mL)를 사용하였다. 고액비는 200:1(흡착제 0.225 g, 용액 45 mL)로 설정하였으며, 초기 Zn 농도는 0, 11.6, 22.2, 25.4, 51.6, 285.6, 438.0, 542.0, 1000, 1250 mg/L로 조정하였다. 반응 전 용액의 초기 pH는 0.06 M HCl(대정화금, 35~37%)을 사용하여 6.3으로 설정하였으며, 실험은 25oC에서 100 rpm으로 24시간 동안 교반 후 채수하여 분석하였다.
2.4. 등온흡착 실험
Zn 농도를 13.3, 22.3, 34.2, 44.6, 54.1, 77.2, 105.1 mg/L로 조제한 용액 200 mL와 흡착제 0.2 g을 25oC의 항온진탕기에서 7일간 100 rpm으로 교반하였으며, 반응기는 유리 재질의 삼각플라스크를 사용하였다. 아연이 수산화물로 침전하는 것을 방지하기 위해 반응 전에 0.6 M HCl(대정화금, 35~37%)을 사용하여 pH를 5.3으로 조정하였으며, 실험 결과를 Langmuir 흡착모델과 Freundlich 흡착모델에 적용하여 평가하였다.
Langmuir 등온흡착모델은 흡착이 단분자층에서 제한적으로 발생하며 흡착제 표면에서 흡착부위 간의 결합 에너지가 동일하다는 가정에 기반하여 유도된 모델으로서, 식 (5)로 표현되었다.

식 (5)에서 Ce와 qe는 반응 후 평형농도(mg/L) 및 평형흡착량(mg/g)이며, qmax는 최대흡착량(mg/g)을 의미한다. 또한, Kads는 Langmuir 상수(L/mg)이며, 흡착제에 대한 흡착질의 친화도를 나타낸다(Wu et al., 2010).
Freundlich 등온흡착모델은 흡착제가 비균질 표면 에너지를 가지며, 흡착질이 다중층으로 흡착될 수 있다고 가정하는 모델이다(식 (6)).

식 (6)에서 kf 는 Freundlich 상수(L/mg), n은 흡착동력을 나타내는 상수로써 그 값이 클수록 흡착이 용이하다(Kim et al., 2019).
2.5. pH adsorption edge 실험
용액의 초기 pH를 4, 5, 6, 7, 8로 조정하면서 아연의 흡착 효율을 평가하였다. 이를 위해 총 5개의 삼각플라스크를 준비하여 각 반응기마다 초기 pH를 NaOH(삼전순약, 98%)와 0.6 M의 HCl을 사용하여 4 ± 0.1 ~ 8 ± 0.1로 조정하였다. 흡착제 0.225 g을 Zn 432.3 mg/L의 용액 225 mL와 함께 각각의 반응기에서 25oC, 100 rpm 조건에서 24시간 동안 반응시켰다. 각 반응기의 pH 조건에 따른 흡착 효율 차이를 비교하였다.
2.6. 컬럼 실험
직경 5 cm의 아크릴 컬럼에 증류수로 세척한 흡착제 299 g(부피 373 mL, 가비중 0.80 g/mL)을 충진하였다 (Fig. 2). 이때 공극 체적은 141 mL로, 공극률은 약 38%로 계산되었다. 아연을 함유한 원수를 상향류 방식으로 유입시켜 총 341일간 평가하였으며, 모니터링은 7일 간격으로 수행하여 채수 후 분석하였다. 또한 체류시간을 조절하면서 처리효율을 평가하였는데, 방류수의 Zn 농도가 배출허용기준(청정지역, 1 mg/L)을 초과할 경우 체류시간을 늘리고, 기준을 충족할 경우 체류시간을 줄이는 방식으로 진행하였다. 또한, 컬럼 내 흡착제의 성능 및 처리 지속성을 평가하기 위해 Bed Volume(BV)을 평가하였는데, 이는 컬럼에 충진된 흡착제의 전체 부피를 기준으로 컬럼을 통과한 용액의 부피를 나타내는 지표이다.
2.7. 분석 방법
채수한 시료는 0.45 mm 여과지로 여과한 후 양이온 및 음이온 분석용 시료를 50 mL conical tube에 각각 채수하고, 이중 양이온 분석용 시료는 질산을 넣어 pH를 2 미만으로 낮추었다. 분석용 시료들은 파라필름(parafilm, elastic laboratory film)으로 봉인 후 분석 전까지 냉장 보관하였다.
pH, ORP, 수온은 Hach사 HQ40D 및 HQ4200 multi portable meter, 알칼리도는 Hach 16900 Digital Titrator로 측정하였다. Zn 농도는 한양대학교 자원환경공학과 바이오에너지 & 환경복원 실험실에서 Thermo Fisher Scientific 사의 iCAP 7000 series ICP-AES(inductively coupled plasma atomic emission spectroscopy)로 분석하였다. 음이온인 Cl-, SO42- 농도는 서울대학교 농생명과학공동기기원에서 Dionex사의 ICS-3000 IC(ion chromatograph)로 분석하였다.
본 연구에 사용한 알럼 기반 흡착제를 대상으로 SEM-EDS 분석에는 한국광해광업공단 기술연구원의 SUPRA 40(Carl Zeiss社)을 사용하였다. 또한, WD-XRF(wavelength dispersive X-ray fluorescence spectrometer)분석은 한양대학교 공동기기원에서 Rigaku 사의 ZSX Primuss IV 모델을 이용하여 X-선관 출력은 60 kV, 기기 내부 온도는 36.5oC로 유지하며 24.3 Pa로 진공상태를 유지하여 분석하였다. 흡착제의 비표면적은 한양대학교 공동기기원에서 Micromeritics사의 ASAP 2460M 비표면적 분석기(BET specific surface area analyzer)로 분석하였다. 표면의 전하가 0인 지점의 pH 값인 영전하점(point of zero charge; PZC)을 측정하기 위하여 Mohan and Gandhimathi (2009)와 Oladoja and Aliu(2009)의 분석법을 이용하여 PZC를 분석하였다(KOMIR, 2021, Fig. S1).
포화지수(SI, saturation index) 산출을 위한 지구화학적 모델링은 USGS의 PHREEQC ver. 3.7을 사용하여 양이온 및 음이온 농도 등의 자료를 기반으로 수행하였다(Parkhurst and Appelo, 2013).

|
Fig. 1 Photo of alum sludge-based adsorbent (diameter: 3 mm). |

|
Fig. 2 Bench-scale adsorption reactor with alum sludge-based adsorbent used in this study. |
3.1. 흡착속도 및 Zn 농도에 따른 pH 변화와 제거 효율 평가
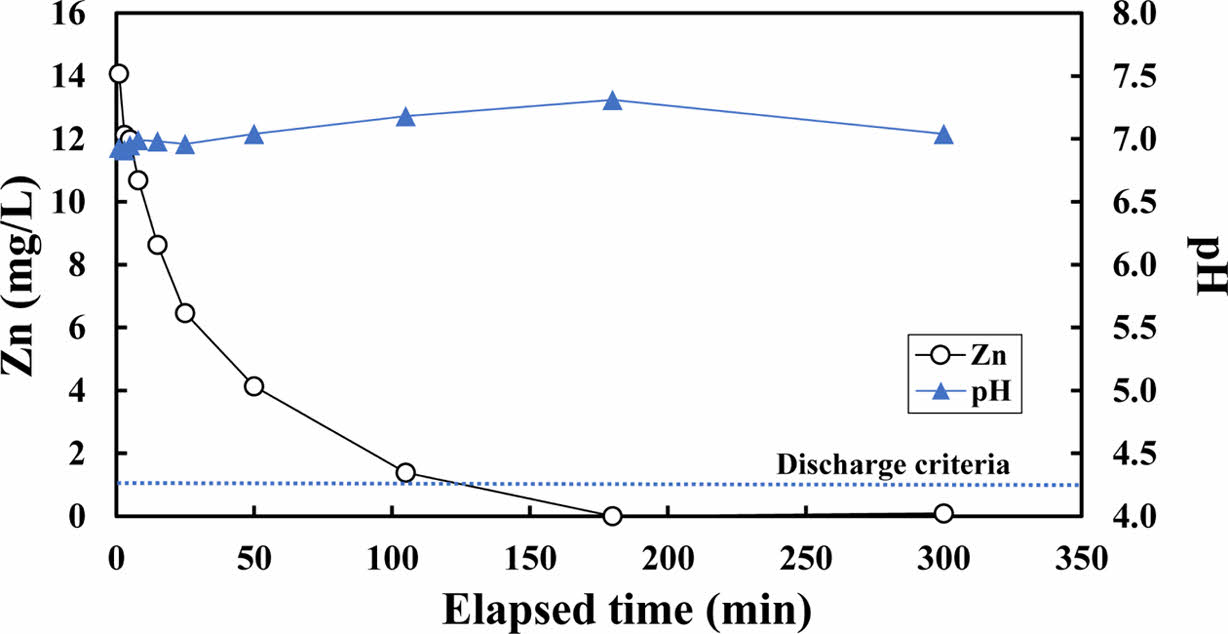
알럼 슬러지 기반 흡착제의 아연 흡착능을 평가하기 위해 Zn 농도 15.7 mg/L의 용액과 흡착제를 반응시키며 시간에 따른 농도 변화를 평가하였다(Fig. 3). 반응 전 초기 pH는 6.87인 것으로 나타났고, 반응 후의 pH는 6.91~7.31의 범위를 보였다. 해당 실험의 반응 전, 후 조건에서 PHREEQC 모델링을 수행한 결과 Zn(OH)2의 SI가 약 -2.04 ~ -1.09 범위로 음의 값을 나타내어 침전 개연성이 낮은 것으로 추정된다. 실험 결과 시간에 따라 농도가 감소하는 경향이 뚜렷하게 나타났으며, Zn 농도는 105분~180분 사이에 배출허용기준(청정지역, 1 mg/L) 이하로 감소하였다.
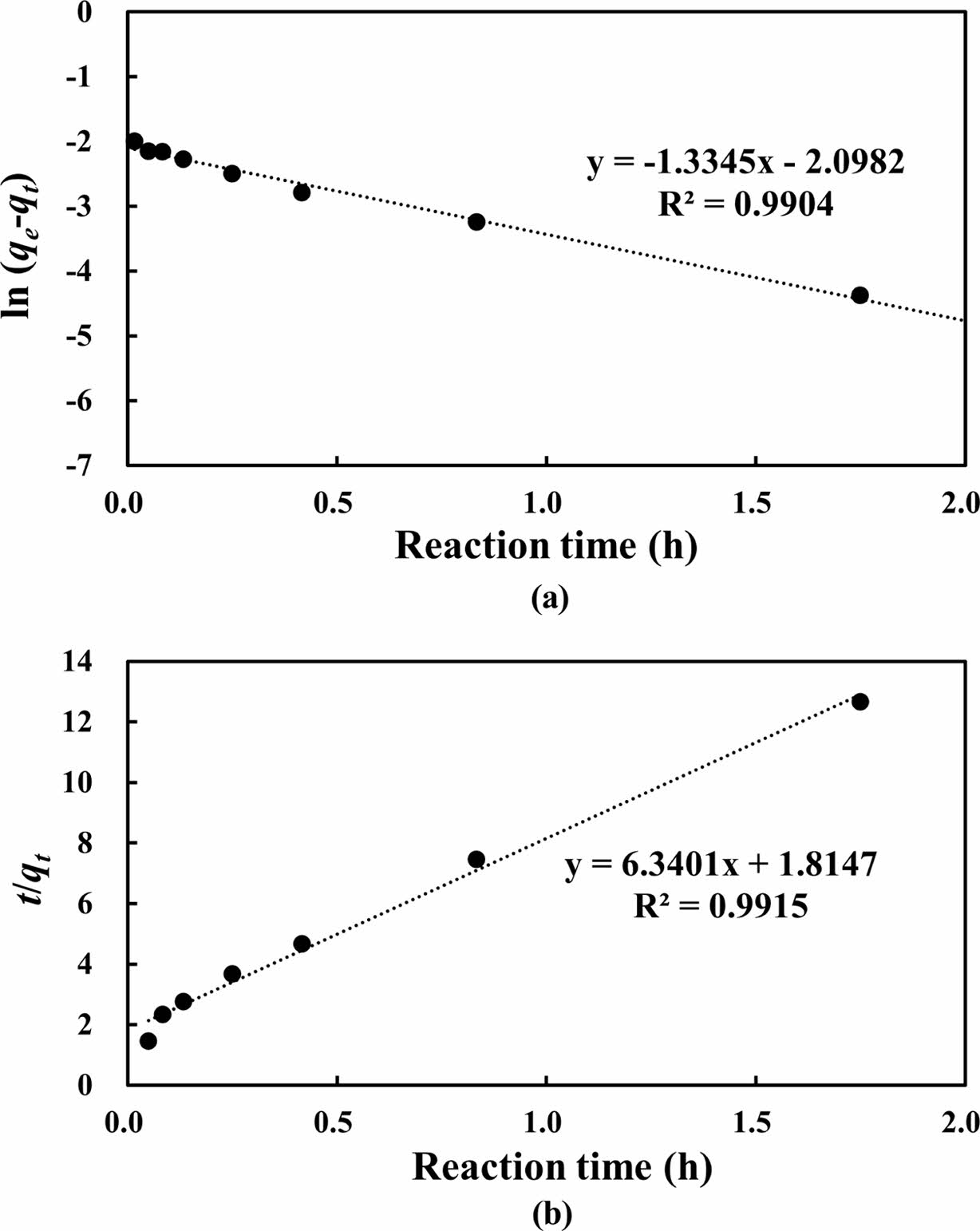
위의 실험 결과에 유사 1차 반응속도 모델(pseudo-first-order kinetic model)과 유사 2차 반응속도 모델(pseudo-second-order kinetic model)을 적용하여 평가한 결과, 흡착에 대한 유사 1차 반응속도 모델(R2 = 0.9904)과 유사 2차 반응속도 모델(R2 = 0.9915)에서 모두 높은 결정계수를 나타내었다(Fig. 4).
Lagergren 모델로도 알려진 유사 1차 반응속도 모델은 흡착제 표면에서의 물리적 흡착과 초기 흡착 메커니즘을 설명하는 데 적합하며, 각 흡착질 분자가 하나의 흡착 site에 결합한다고 가정한다(Tejada et al., 2016; Zaboon et al., 2018). 모델에서 높은 결정계수는 초기 흡착 과정이 표면 site에서의 정전기적 상호작용에 의해 잘 설명될 수 있음을 의미한다. 반면, 유사 2차 반응속도 모델은 흡착질 분자가 흡착제의 두 개 활성 site에 흡착된다고 가정하며, 흡착질과 흡착제 간의 강한 화학적 결합을 설명한다(Ho and Mckay, 1999; Shikuku et al., 2018). 모델에서 높은 결정계수는 시간이 지남에 따라 화학적 흡착이 지배적인 제거 메커니즘으로 전환되는 과정을 반영한다. 또한, 알럼 기반 흡착제를 활용하여 다양한 금속 이온을 흡착시켜 제거한 선행 연구결과에 따르면 Zn을 포함한 금속 이온의 흡착 메커니즘은 주로 화학적 흡착인 것으로 나타났다(Paj¹k, 2023; Silvetti et al., 2015).
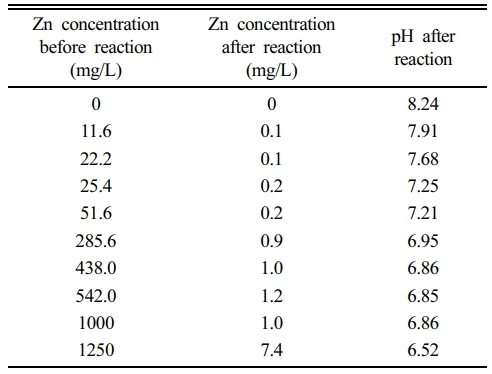
한편, 이와 관련된 알럼 슬러지 기반 흡착제 사용 시 pH 증가 현상을 다양한 Zn 농도 조건에서 평가한 결과, 반응 후 pH는 6.50~8.20로 모든 반응기에서 증가하였으며, Zn 농도가 높을수록 pH 증가폭은 감소하는 경향을 보였다(Table 1). 특히, Zn 농도가 1250 mg/L로 높은 경우에도 상당량의 아연이 제거되어 7.4 mg/L만 잔류하였는데, 이는 아연이 수산화물을 형성하며 침전하는 과정에서 많은 OH-가 소모되었기 때문으로 판단된다. 이와 같은 결과는 Zn 농도가 높을수록 OH- 소비가 증가하여 pH 증가폭이 감소했음을 나타낸다. 또한, 알럼 슬러지 기반 흡착제의 영전하점이 5.25이므로, pH 5.25 이상에서 흡착제 표면이 음전하를 띄는 경향이 있어 H+를 흡착하였을 가능성이 높아 pH 증가에 기여했을 것으로 추정된다.
3.2. 등온흡착 실험 결과
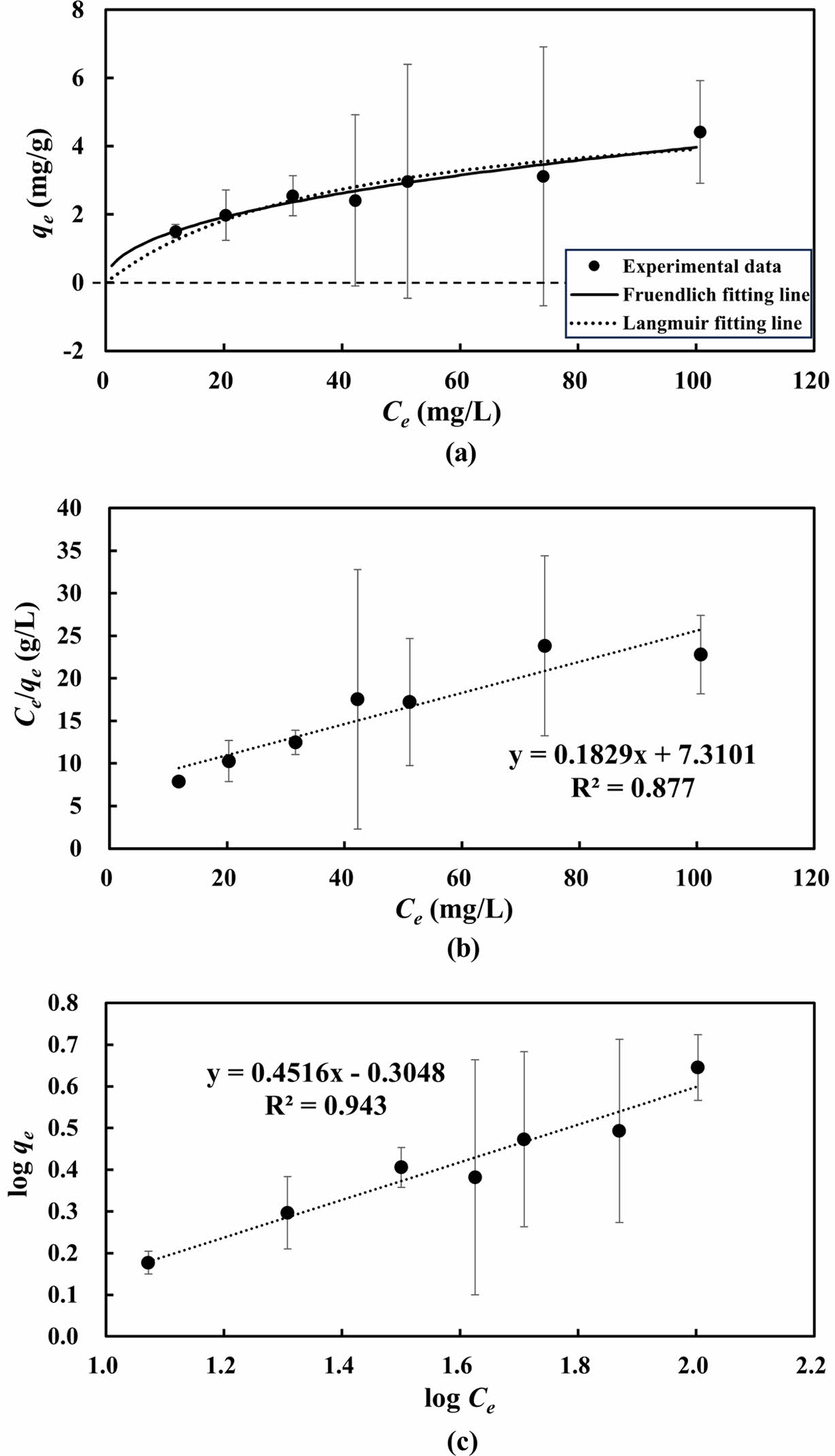
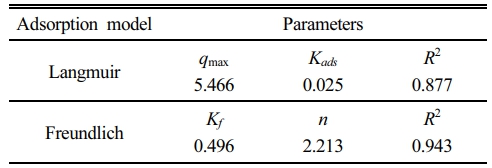
아연이 Zn(OH)2로 침전되는 것을 방지하기 위해 pH를 5.3으로 조정한 후 7일간 교반하며 등온흡착 실험을 수행하였다. 반응 후의 pH는 6.5~7.0의 범위로 나타났으며, 흡착 실험 결과 Freundlich 흡착모델을 적용했을 때의 결정계수가 0.943으로 Langmuir 흡착모델의 결정계수(0.877)보다 높게 나타나, Freundlich 흡착모델이 실험 데이터를 보다 잘 설명하는 것으로 나타났다(Fig. 5). 한편, Langmuir 흡착모델을 기반으로 한 최대 흡착량(qmax)은 약 5.5 mg/g으로 추정되었다(Table 2).
선행 연구결과에 따르면, 알럼 기반 흡착제에 대한 Zn의 최대 흡착량(qmax)은 약 3.27 mg/g인 것으로 나타났으며, Freundlich 흡착모델을 보다 잘 따르는 것으로 나타났다(Silvetti et al., 2015). Freundlich 흡착모델의 결정계수가 Langmuir 흡착모델보다 높게 나타난 것은 흡착제 표면이 이질적이고 다양한 흡착 site를 가지며, 비선형적인 다층 흡착 특성을 보였기 때문으로 해석된다. 이는 알럼 기반 흡착제가 다양한 결합 에너지와 비균질적인 site 구조를 가지고 있음을 시사한다.
3.3. pH에 따른 흡착능 실험 결과
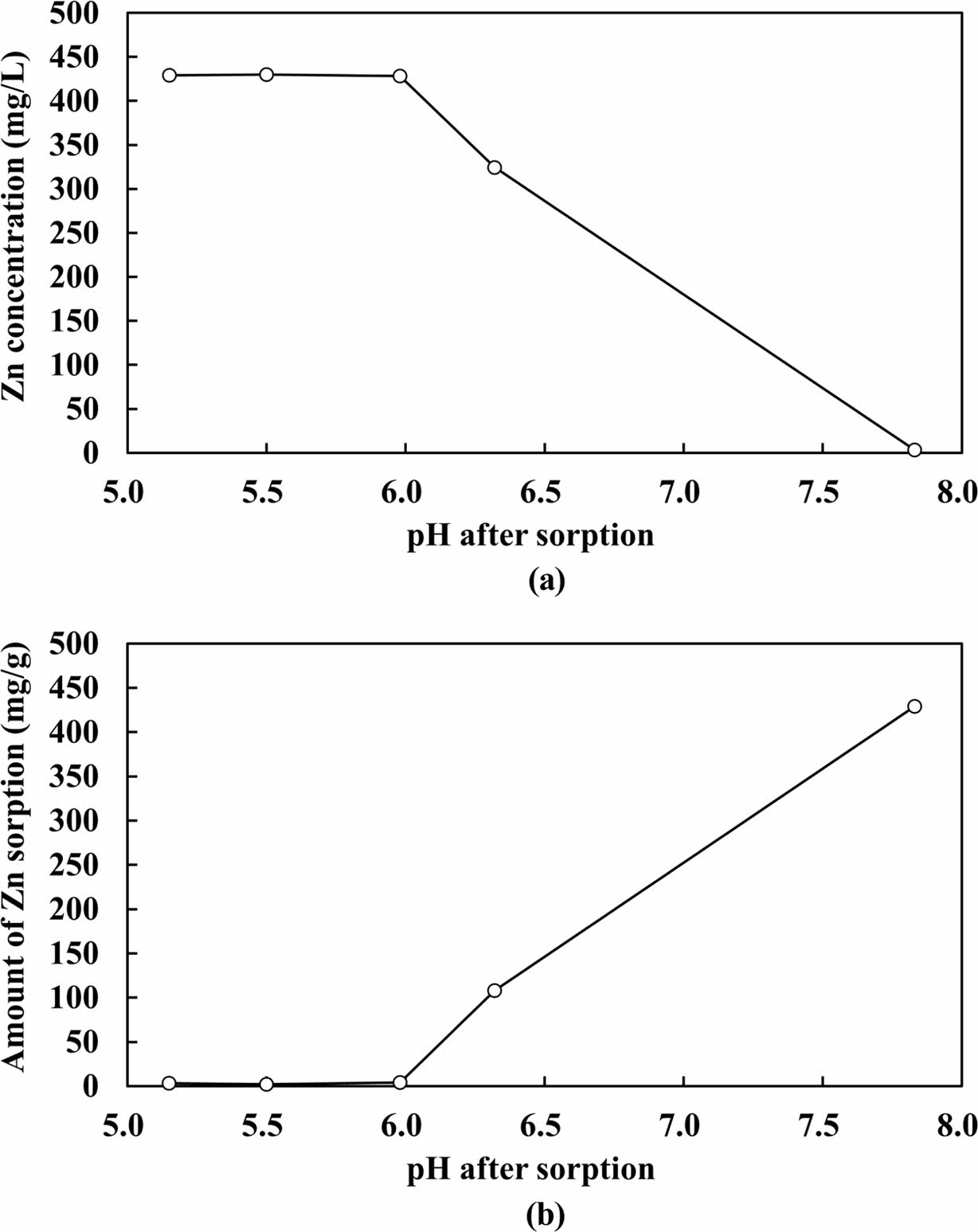
초기 pH를 4.0~8.0으로 조정한 5개 반응기에 대하여 pH에 따른 흡착 효율 변화를 평가한 결과 초기 pH가 5 이하일 때에는 반응 후 pH가 증가하며 6 이상일 때에는 감소하였는데(Fig. 6a), 이는 3.1절에서 논의한 바와 같이 PZC가 5.25인 영향을 반영하는 것으로 판단된다.
Zn 농도의 경우, 특히 반응 후 pH 6.3 및 7.8에서 Zn 농도가 크게 감소하였다. 이를 흡착능으로 환산할 경우 각각 108 및 429 mg/g으로 상당히 높게 나타났다. 또한, PHREEQC를 이용한 지구화학적 모델링 결과 반응 후 pH가 6.3 및 7.8이었던 반응기의 초기 pH는 7.0 및 8.0이었는데, 이 조건에서 해당 반응기 용액에서는 Zn(OH)2의 포화지수가 -0.11~1.65, Zn4(OH)6SO4의 포화지수가 1.64~6.94로서, 수산화물 및 황산염-수산화물 등으로 포화되어 침전될 수 있는 것으로 계산되었다. 따라서, 해당 조건의 반응기들에서는 흡착보다는 침전에 의해 아연이 제거된 것으로 판단된다.
한편, 반응 후 pH 6에서는 최대 약 4.0 mg/g의 흡착능을 보였으며(Fig. 6b), 이는 3.2절의 등온흡착 실험에서 추정한 최대 흡착량(5.5 mg/g)을 뒷받침한다(Table 2).
3.4. 컬럼실험 결과
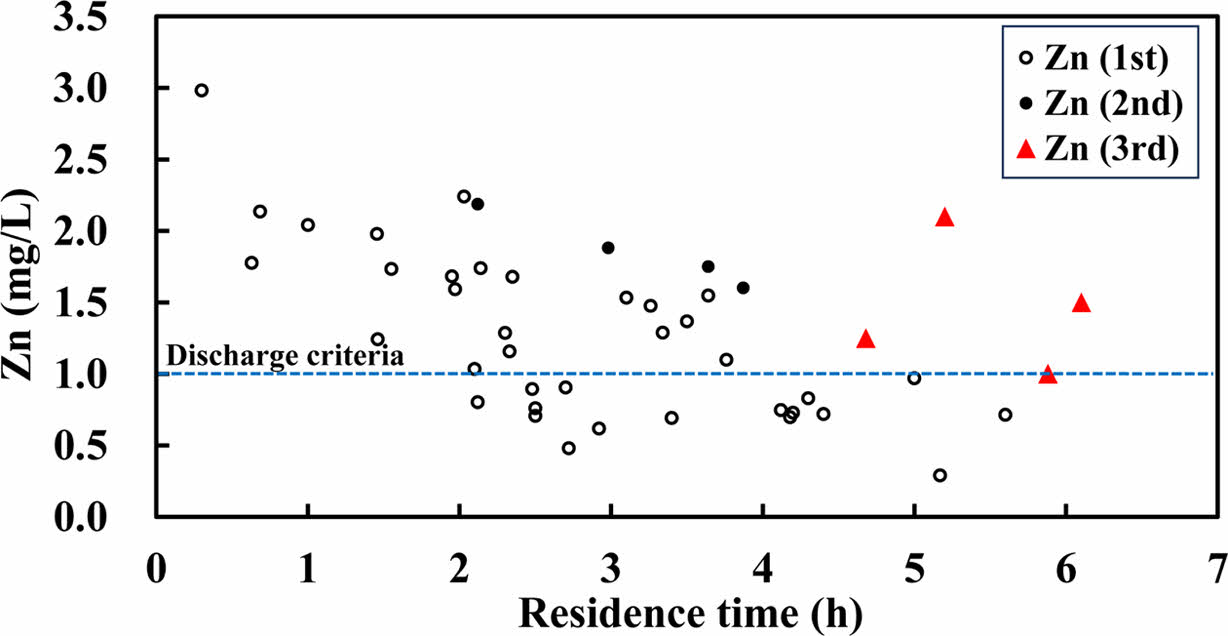
Zn 4.6~6.4 mg/L, pH 6.42~7.72의 원수를 사용하여 341일간 흡착 컬럼을 운영하였다. 이중 초기(1st phase, 9개월간, 285일까지) 및 중기(2nd phase, 286~309일)에서 체류시간이 증가함에 따라 Zn 농도가 감소하는 경향을 보였다(Fig. 7). 1st phase 기간 중 체류시간이 4시간 이상일 때 Zn 농도가 기준치인 1 mg/L 이하로 처리되었다. 그리고 2nd phase 및 3rd phase(310~341일)에서는 동일한 체류시간 조건에서도 Zn 농도가 1st phase 대비 상대적으로 높아진 것이 눈에 띄게 나타났는데, 이는 파과 시점에 다다랐음을 시사한다. 따라서 파과 시점은 286일(약 9개월)로 평가되었으며, 이때의 누적 처리량은 1432 BV인 것으로 도출되었다.
컬럼 실험 완료 후 흡착제 표면의 SEM-EDS 분석 결과, 주로 아연으로 이루어진 판상의 결정이 다량으로 표면에 존재함이 관찰되었다(Fig. 8). da Silva et al.(2013)과 Richetta et al.(2016)도 ZnO의 SEM-EDS 분석 결과 해당 사진과 유사한 판상 결정 형태를 보고하였다. ZnO의 경우 Zn(OH)2의 건조 및 탈수에 따라 생성될 수 있으므로, 이는 컬럼 운영 시 흡착제 표면에서 아연 수산화물이 포화, 석출되었음을 시사한다. 또한 이는 3.1절 및 3.3절에서 지시한 흡착제에 의한 아연 수산화물 표면침전 영향을 뒷받침한다.
한편, 컬럼 실험 전 흡착제 표면의 SEM-EDS 분석 결과, 흡착제 표면은 주로 거칠고 다공성인 구조를 가지는 것으로 관찰되었다(Fig. 9). EDS 분석에서는 구성 성분의 대부분이 Al과 O로 나타나, 알럼 기반 흡착제가 주로 알루미늄 (수)산화물 형태로 존재함을 시사한다(Fig. 9c). 또한, 실험 전 단계이므로 아연은 검출되지 않았다.
|
Fig. 3 Zn concentrations and pH according to reaction time with alum sludge-based adsorbent. Soild-to-liquid ratio is 1:12.5, and pH and Zn concentrations of influent are 6.87 and 15.7 mg/L, respectively. |
|
Fig. 4 (a) Pseudo-first-order and (b) pseudo-second-order kinetic models for the Zn adsorption experiment in this study |
|
Fig. 5 (a) Comparison of experimental data with Langmuir and Freundlich models and (b) Langmuir and (c) Freundlich adsorption model fits for Zn adsorption isotherm experiments. Error bars indicate double standards deviations of duplicate experiments. |
|
Fig. 6 Plots of (a) Zn concentrations and (b) amount of Zn sorbed per unit mass of adsorbent versus pH after sorption. |
|
Fig. 7 Plot of Zn concentrations versus residence time for the column experiment. Periods of the 1st, 2nd, and 3rd phases are until 285 days, 286-309 days, and 310-341 days, respectively. |

|
Fig. 8 SEM-EDS analytical results of the adsorbent surface after the column experiment. (a) Surface morphology of the adsorbent at 5,000× magnification, (b) detailed view of Zn precipitates at 10,000× magnification, (c) elemental composition from EDS analysis, and (d) SEM image indicating the EDS analysis region. |

|
Fig. 9 SEM-EDS analytical results of the adsorbent surface before the column experiment. (a) Surface morphology of the adsorbent at 1,020× magnification, (b) detailed view of Zn precipitates at 2,830× magnification, (c) elemental composition from EDS analysis, and (d) SEM image indicating the EDS analysis region. |
|
Table 1 pH values and Zn concentrations after reaction with the adsorbent, according to initial Zn concentrations. Initial pH was 6.3 |
|
Table 2 Langmuir and Freundlich adsorption model parameters for Zn adsorption by alum sludge-based adsorbent |
본 연구에서는 알럼 슬러지 기반 흡착제를 사용하여 아연을 제거하는 회분식 및 컬럼 실험을 수행하여 아연 제거 특성과 처리 효율을 평가하였다. 컬럼 실험 결과, 4시간 이상 체류 시 4.6~6.4 mg/L의 아연을 배출허용기준 이내로 처리하였으며, 이때 Zn 흡착 컬럼의 파과시점은 1432 BV 가량으로 약 9개월에 해당하였다. 다양한 Zn 농도에 따라 pH가 증가하는 영향을 평가하고 다양한 pH에 따라 아연이 처리되는 효율을 평가한 결과 알럼 슬러지 기반 흡착제는 H+의 흡착 등으로 pH를 높이는 기작이 존재함이 나타났다. 또한 pH가 7 가량에 해당하는 경우 아연이 수산화물로 저감되는 경향이 나타났으며, pH 6.4~7.7로 운영한 컬럼 실험 종료 이후 흡착제 표면에서도 아연 산화물이 관찰되어 운영 중 아연 수산화물이 표면침전되었음을 시사하였다. 이러한 아연의 표면침전 영향을 배제한다면, pH 5.3 조건에서의 등온흡착 실험 및 Langmuir 모델 평가 결과 최대흡착능은 5.5 mg/g으로 추정되었다. 따라서, 정수장 알럼 슬러지 기반 흡착제는 광산배수 및 산업폐수, 그리고 오염지하수 등에 포함된 아연을 흡착 등의 기작으로 제거하기 위한 매질로서 활용성이 높은 것으로 나타났다. 이는 폐기물을 재활용하는 환경친화적 효과와 함께 에너지를 사용하지 않는 자연정화공법 흡착반응조의 매질로서 기대된다.
이 논문은 2022~2024년 한국광해광업공단으로부터 기술연구사업비를 지원받았으며 또한 2024~2025년 정부 (해양수산부)의 재원으로 해양수산과학기술진흥원-해양유해물질오염원 추적기법개발 사업(RS-2022-KS221655)의 지원을 받았으며 상지대학교 대학원의 지원을 받아 수행된 연구로서 이에 감사드립니다. 건설적이고 다양한 코멘트들을 주신 익명의 심사위원들께 감사드립니다.
- 1. Bhattacharya, A.K., Mandal, S.N., and Das, S.K., 2006, Adsorption of Zn(II) from aqueous solution by using different adsorbents. Chem. Eng. J., 123(1-2), 43-51.
-

- 2. Cho, H.-G., Kim, E.-Y., and Jeong, G.-Y., 2001, Surface chemical properties of the Youngdong illite ore: The pH of zero proton charge and surface site density. J. Miner. Soc. Korea., 14, 12-20.
- 3. Coston, J.A., Fuller, C.C., and Davis, J.A., 1995, Pb2+ and Zn2+ adsorption by a natural aluminum- and iron-bearing surface coating on an aquifer sand. Geochim. Cosmochim. Acta., 59, 3535-3547.
-

- 4. da Silva, P.S., Maciel, J.M., Wohnrath, K., Spinelli, A., and Garcia, J.R., 2013, Electrodeposition of alloys coatings from electrolytic baths prepared by recovery of exhausted batteries for corrosion protection. In M. Aliofkhazraei (Ed.), Modern Surface Engineering Treatments. IntechOpen.
-

- 5. Fosmire, G.J., 1990, Zinc toxicity. Am. J. Clin. Nutr., 51, 225-227.
-

- 6. Fu, F. and Wang, Q., 2011, Removal of heavy metal ions from wastewaters: A review. J. Environ. Manage., 92, 407-418.
-

- 7. Ho, Y.S. and McKay, G., 1998, A comparison of chemisorption kinetic models applied to pollutant removal on various sorbents, Process Saf. Environ. Prot., 76(4), 332-340.
-

- 8. Ho, Y.S. and McKay, G., 1999, Pseudo-second order model for sorption processes. Process Biochem., 34, 451-465.
-

- 9. Hua, T., Haynes, RJ., and Zhou, Y-F., 2018, Competitive adsorption and desorption of arsenate, vanadate, and molybdate onto the low-cost and its role in P adsorption, Chem. Eng. J., 302, 120-127.
-

- 10. Ippolito, JA., Barbarick, KA., and Elliott, HA., 2011, Drinking water treatment residuals: a review of recent uses, J. Environ. Qual., 40,1-12.
-

- 11. Jain, A., Raven, K.P., and Loeppert, R.H., 1999, Arsenite and arsenate adsorption on ferrihydrite: Surface charge reduction and net OH- release stoichiometry, Environ. Sci. Technol., 33, 1179-1184.
-

- 12. Janyasuthiwong, S., Rene, E.R., Esposito, G., and Lens, P.N.L., 2015, Effect of pH on Cu, Ni and Zn removal by biogenic sulfide precipitation in an inversed fluidized bed bioreactor. Hydrometallurgy., 158, 94-100.
-

- 13. Jo, J.Y., Choi, J.H., Tsang Y.F., and Baek, K., 2021, Pelletized adsorbent of alum sludge and bentonite for removal of arsenic. Environ. Pollut., 277, 116747.
-

- 14. Kim, K.-H., Kang, C.-U., Kim, S.-J., Kim, T.-H., Ji, W.-H., Jang, H.-S., and Park, H.-S., 2018, Study on determination of design Factor of bioreactor for sulfate reduction in mine drainage. J. Korean Soc. Miner. Resour. Eng., 55(6), 527-537.
-

- 15. Kim, Y-S., Kim, D-H., Yang, J-S., and Baek, K., 2012, Adsorption characteristics of As(III) and As(V) on alum sludge from water purification facilities. Sep. Sci. Technol., 47,2211-2217.
-

- 16. Kim, Y.J., Choi, S.Y., and Kim, Y.H., 2019, Synthesis of Iron Oxide and Adsorption of Arsenic on Iron Oxide. J. Environ. Sci. Inter., 28(1), 99-106.
-

- 17. Kiran, B. and Thanasekaran, K., 2011, Copper biosorption on Lyngbya putealis: Application of response surface methodology (RSM). Int. Biodeterior. Biodegrad., 65, 840-845.
-

- 18. KOMIR (Korea Mine Rehabilitation and Mineral Resources Corporation), 2021, Development of Site-Specific Sorption Processes to Remove Heavy Metals in Low-Flow Mine Drainages, Technology Report 2021-041.
- 19. Kumar, R., Kang, C-U., Mohan, D., Khan, MA., Lee, J-H., Lee, S.S., and Jeon, B-H., 2020, Waste sludge derived adsorbents for arsenate removal from water. Chemosphere., 239, 124832.
-

- 20. Lagergren, S., 1898, Zur theorie der sogenannten adsorption geloster stoffe, Bihang till K. Svenska Vet-Akad. Handlingar., 24, 1-39.
- 21. Lee, S.E., Neue, H.U., Park, J.K., and Lim, S.H., 1993, Comparison of the ion adsorption method, potentiometric titration, and backitration technique for surface charge measurement in UItisol, Alfisol, and Inceptisol. Korean J. Soil Sci. Fert., 26, 160-171.
- 22. Lee, W.C., Jung, H.S., Kim, J.Y., and Kim, S.O., 2009, Study on adsorption features of arsenic onto lepidocrocite. Econ. Environ. Geol., 42(2), 95-105.
- 23. Lens, P.N.L. and Kuenen, J.G., 2001, The biological sulfur cycle: Novel opportunities for environmental biotechnology. Water Sci. Technol., 44, 57-66.
-

- 24. Liang, F., Xiao, Y., and Zhao, F., 2013, Effect of pH on sulfate removal from wastewater using a bioelectrochemical system. Chem. Eng. J., 218, 147-153.
-

- 25. Mohan, S. and Gandhimathi, R., 2009, Removal of heavy metal ions from municipal solid waste leachate using coal fly ash as an adsorbent. J. Hazard. Mater., 169(1-3), 351-359.
-

- 26. Oladoja, N.A. and Aliu, Y.D., 2009, Snail shell as coagulant aid in the alum precipitation of malachite green from aqua system. J. Hazard. Mater., 164(2-3), 1496-1502.
-

- 27. Pająk, M., 2023. Alum sludge as an adsorbent for inorganic and organic pollutants removal from aqueous solutions: a review. Int. J. Environ. Sci. Technol., 20, 10953-10972.
-

- 28. Parkhurst, D.L. and Appelo, C.A.J., 2013, Description of input and examples for PHREEQC version 3—A computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations, in: U.S. Geological Survey Techniques and Methods, Book 6. U.S. Geological Survey, p. 497.
-

- 29. Richetta, M., Digiamberardino, L., Mattoccia, A., Medaglia, P.G., Montanari, R., Pizzoferrato, R., Scarpellini, D., Varone, A., Kaciulis, S., Mezzi, A., Soltani, P., and Orsini, A., 2016, Surface spectroscopy and structural analysis of nanostructured multifunctional (Zn, Al) layered double hydroxides. Surf. Interface Anal., 48(7), 514-518.
-

- 30. Shikuku, V.O., Zanella, R., Kowenje, C.O., Donato, F.F., Bandeira, N.M., and Prestes, O.D., 2018, Single and binary adsorption of sulfonamide antibiotics onto iron-modified clay: Linear and nonlinear isotherms, kinetics, thermodynamics, and mechanistic studies. Appl. Water Sci., 8, 175.
-

- 31. Silvetti, M., Castaldi, P., Garau, G., Demurtas, D., and Deiana, S. 2015, Sorption of cadmium(II) and zinc(II) from aqueous solution by water treatment residuals at different pH values. Water Air Soil Pollut., 226,313.
-

- 32. Tejada, C., Herrera, A., and Ruiz, E., 2016, Kinetic and isotherms of biosorption of Hg (II) using citric acid treated residual materials. Ing. Compet., 18, 117-127.
-

- 33. Wan Ngah, W.S., and Hanafiah, M.A.K.M., 2008, Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents: A review. Bioresour. Technol., 99, 3935-3948.
-

- 34. Wang, S. and Peng, Y., 2010, Natural zeolites as effective adsorbents in water and wastewater treatment. Chem. Eng. J., 156, 11-24.
-

- 35. Wu, F.R., Tseng, R.L., and Juang, R.S., 2010, A review and experimental verification of using chitosan ans its derivatives as adsorbents for selected heavy metals. J. Environ. Manage., 91(4), 798-806.
-

- 36. Yoo, K., Jeong, J., Sohn, J., and Lee, J., 2006, Application of sulfate-reducing bacteria for treatment of mine drainages. J. Korean Soc. Miner. Resour. Eng., 43, 160-167.
- 37. Zaboon, S., Abid, H.R., Yao, Z., Gubner, R., Wang, S., and Barifcani, A., 2018, Removal of monoethylene glycol from wastewater by using Zr-metal organic frameworks. J. Colloid Interface Sci., 523, 75-85.
-

 This Article
This Article
-
2025; 30(1): 20-29
Published on Feb 28, 2025
- 10.7857/JSGE.2025.30.1.020
- Received on Jan 5, 2025
- Revised on Jan 12, 2025
- Accepted on Jan 31, 2025
 Services
Services
Shared
 Correspondence to
Correspondence to
- Duk-Min Kim
-
Department of New Energy and Mining Engineering, Sangji University, Wonju 26339, Republic of Korea
- E-mail: kdukmin8@sangji.ac.kr





